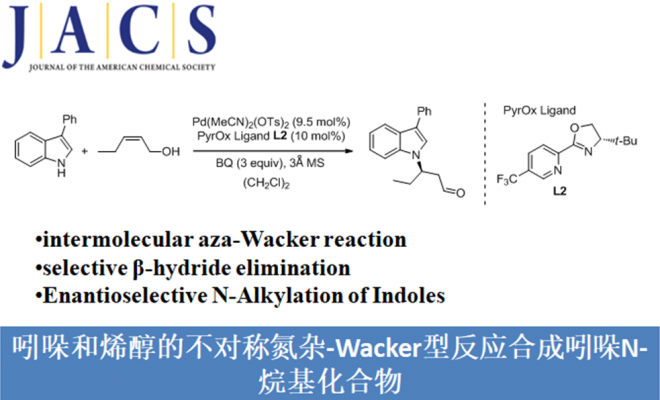
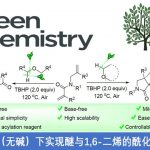
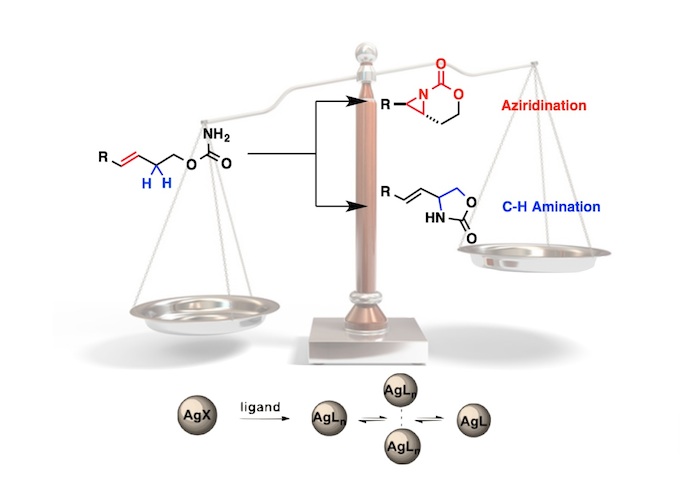
吲哚化合物是一种重要的N-杂环骨架,广泛存在于天然产品、具有药理活性的化合物、农用化学品以及美国FDA批准的药物中。吲哚作为亲核试剂最常见的是C2和C3位进攻,而关于吲哚N-H键官能团化的报道较少。吲哚N-H键官能团化可用于合成含不对称C-N键的化合物,这对较多生物活性物质的合成具有重要意义(Scheme 1a)。氮杂-Wacker型反应可作为吲哚N-H键转化为不对称C-N键的重要策略。传统的分子间的aza-Wacker型反应可将末端烯烃转化为烯胺化合物(Scheme 1b)[1]。因此,美国犹他大学Matthew S. Sigman课题组猜想1,2-二取代的烯烃[2]可与吲哚发生氮杂-Wacker型反应,合成含不对称C-N键的化合物。但该反应存在β-氢化物选择性消除的问题即发生β-Hb消除可得到目标产物,β-Ha消除可形成烯胺化合物(Scheme 1c)。其次,应用1H-吲哚衍生物作为亲核试剂同样存在较多挑战:1)吲哚的C2和C3位与氮原子均可作为亲核位点;2)在氮杂-Wacker型反应中,氨化钯中间体会经历顺式-加成反应或反式-加成反应,这两种反应互为竞争关系。为了解决这些问题,美国犹他大学Matthew S. Sigman课题组报道了第一例吲哚和烯醇的不对称氮杂-Wacker型反应,合成各种含功能性集团的高区域选择性和高对映选择性的吲哚N-烷基化产物。该报道是较为少见的分子间氮杂-Wacker型反应。
Enantioselective N‑Alkylation of Indoles via an Intermolecular Aza-Wacker-Type Reaction
Allen, J. R.; Bahamonde, A.; Furukawa, Y.; Sigman, M. S.*
J. Am. Chem. Soc. 2019, early view DOI: 10.1021/jacs.9b01476
Scheme 1 背景介绍
论文作者介绍
研究者:Matthew S. Sigman教授
研究者经历
- 1992, B.S., Sonoma State University
- 1996, Ph.D., Washington State University
- 1997-1999, NIH Postdoctoral Fellow, Harvard University
获奖情况
- 2000-2002, Research Innovation Award, Research Corporation
- 2000-2002, Research Innovation Award, Research Corporation
- 2001-2006, NSF Faculty Early Career Development (CAREER) Award
- 2001-2006, NSF Faculty Early Career Development (CAREER) Award
- 2004, Pfizer Award for Creativity in Organic Chemistry
- 2004, Camille Dreyfus Teacher-Scholar Award
- 2008, University of Utah Distinguished Honors Professor
- 2009, Robert W. Parry Teaching Award
- 2010, Arthur C. Cope Scholar Award
- 2011, U of U Distinguished Scholarly & Creative Research Award
- 2011, Fellow of the American Association for the Advancement of Science
- 2012-present ,Peter J. Christine S. Stang Presidential Endowed Chair of Chemistry
研究方向
Pd催化的烯烃氧化反应;Heck型反应不对称催化和配体设计;乳腺癌治疗先导药-新型二芳基甲胺化合物的合成;C-H键官能团化反应
论文概要
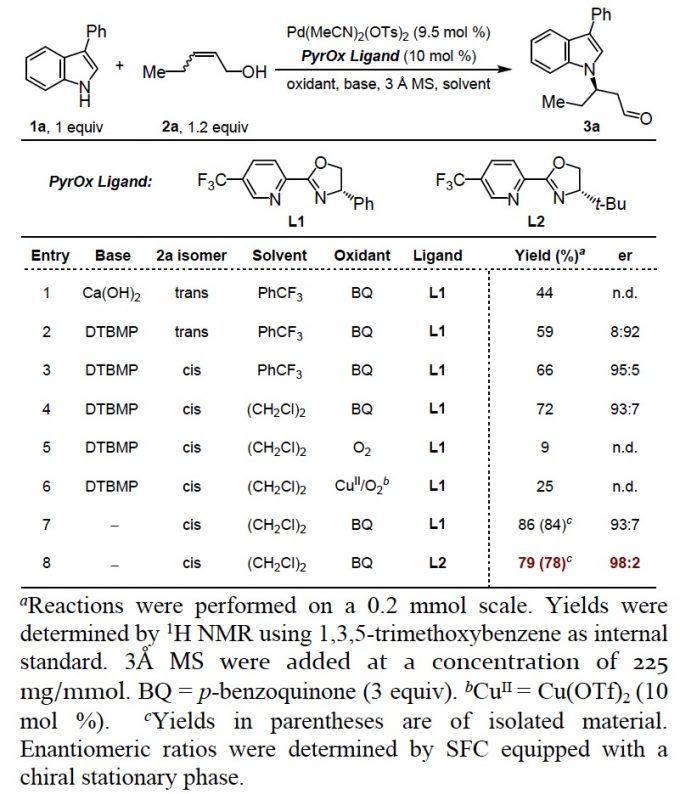
以3-苯基吲哚1a和烯醇衍生物2a作为模板底物,作者对催化剂、溶剂、碱等反应条件进行优化,发现1a 和cis–2a 在9.5 mol% Pd(MeCN)2(OTs)2和10 mol% L2为催化剂,3.0 equiv BQ为氧化剂,225 mg/mmol 3 Å 分子筛为添加物,(CH2Cl)2为溶剂,室温条件下反应,能以79%的收率和96%的对映选择性得到目标产物(Table 1)。
Table 1 条件优化
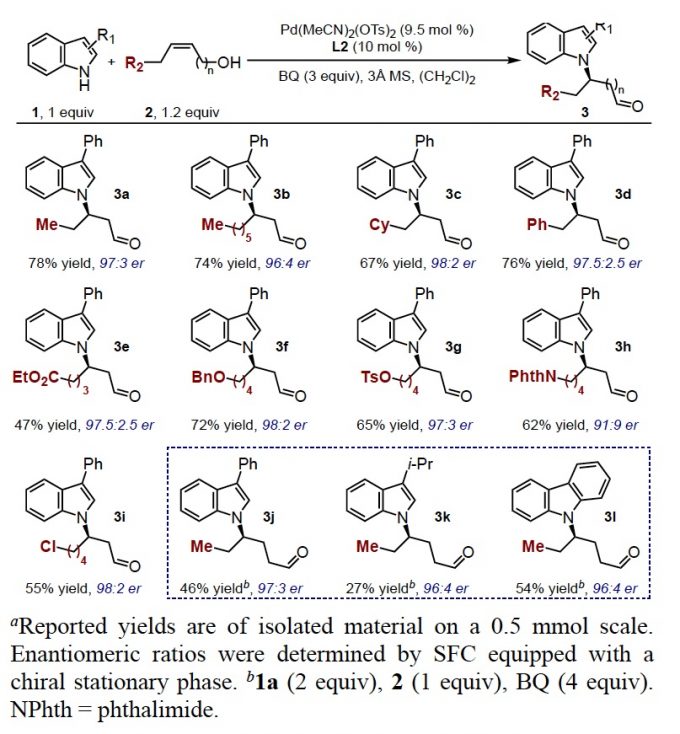
在最优反应条件下,作者考察了烯醇衍生物的底物范围(Table 2)。正戊烷取代、环己烷、芳基取代以及各种酯基、苄基醚、甲苯磺酸、带保护基的胺以及烷基氯等功能性基团取代的烯丙基醇均具有良好的耐受性,能以中等至良好的收率和优异的对映选择性得到相应产物。此外,高烯丙基醇也能较好的适应反应条件,能以中等的收率和较高的对映选择性得到相应产物。
Table 2 烯醇衍生物的底物扩展
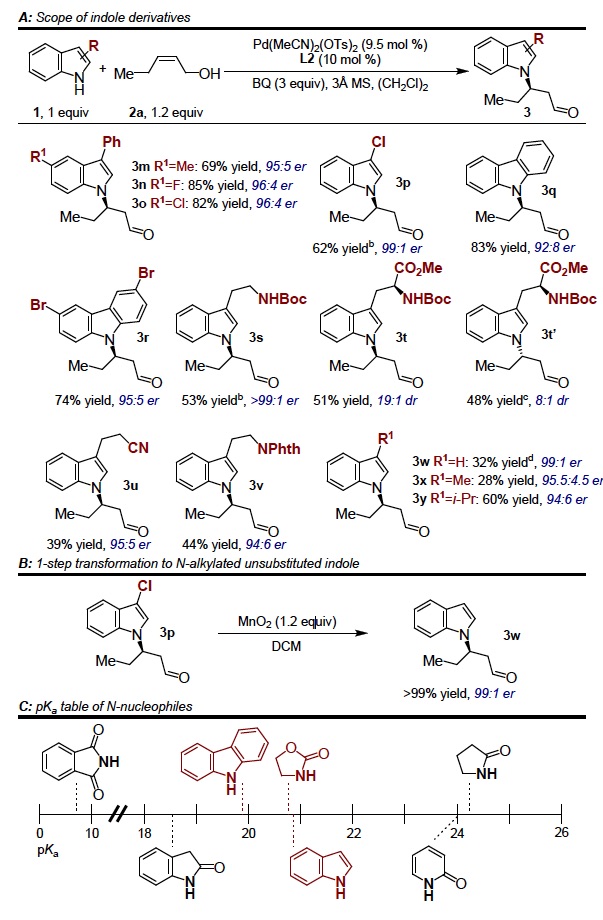
紧接着,作者对吲哚的底物范围进行了考察(Figure 1a)。不论吲哚C5位为吸电子取代基还是给电子取代基,这类底物均能较好的适应反应条件,能以良好的收率和优秀的对映选择性得到相应产物。C3位各种吸电子的氯、溴、给电子的甲基、异丙基以及色胺衍生物取代的吲哚均具有耐受性,能以中等至良好的收率和优秀的对映选择性得到相应产物。若C3位的苯基换成H,则会观察到有副产物的生成。为了克服这种局限,以3p为模板,在二氧化锰的二氯甲烷中反应,能以良好的收率和对映选择性得到C3位无取代的产物3w(Figure 1b)。紧接着,作者考察了一系列与吲哚pKa值相近的N-杂环亲核试剂的反应情况。大多数N-杂环化合物均不能得到N-烷基化产物,只有pKa值最相近的恶唑烷酮表现出较好的亲核能力,但具体原因尚不清楚。
Figure 1 吲哚衍生物及其它N-杂环亲核试剂的反应情况
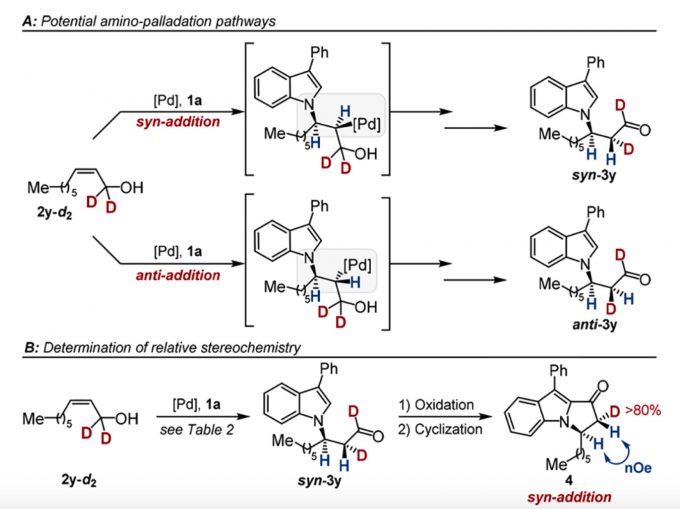
为了更深入了解该反应的机理,作者又进行了氘代实验以及计算研究。氘代烯丙基醇(2y–d2)用于区分顺式-和反式-加成过程中的氨化钯中间体(Scheme 2b)。两种不同的氨化钯中间体可转化为两种非对映选择性的产物3y(Scheme 2a)。氘代实验数据显示Pd-氢化物与烯烃的构型保持一致。通过1H NMR耦合常数(均为实验和计算)以及一维NOE实验数据显示该反应是通过顺式-氨基-钯化途径。另外,产品3r的绝对配置是通过X射线晶体学确定为R-构型。
Scheme 2 机理研究
论文总结性评论
美国犹他大学Matthew S. Sigman课题组报道了第一例吲哚和烯醇的不对称氮杂-Wacker型反应,合成各种含功能性集团的高区域选择性和高对映选择性的吲哚N-烷基化产物,并巧妙地避免传统的烯胺化合物的形成。该报道是较为少见的分子间氮杂-Wacker型反应。
参考文献
- Hosokawa, T.; Takano, M.; Kuroki, Y.; Murahashi, S.-I. Tetrahedron Lett. 1992, 33, 6643. DOI: 1016/S0040-4039(00)61007-9
- Xu, L.; Hilton, M. J.; Zhang, X.; Norrby, P.-O.; Wu, Y.-D.; Sigman, M. S.; Wiest, O. J. Am. Chem. Soc. 2014, 136, 1960. DOI: 10.1021/ja4109616
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.