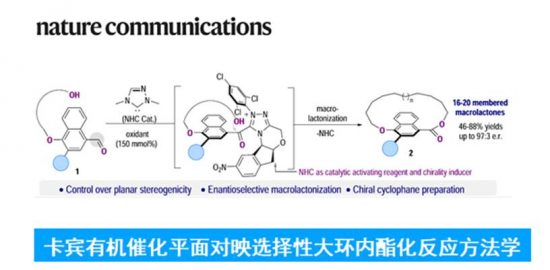
之前我们为大家介绍了胡金波老师的分离Z/E烯烃的最新研究,这一期我们换个角度,介绍的研究是烯烃E/Z之间的转化—由非常廉价的维生素B2(核黄素)作为催化剂成功实现了双键的光照异构化反应。而这一研究的灵感竟然是来自视觉形成的关键物质–视黄醛的异构化反应?(视觉形成机理见视黄醛百度百科)
“A Bio-Inspired, Catalytic E → Z Isomerization of Activated Olefins”
Metternich, J. B.; Gilmour, R.; J. Am. Chem. Soc. 2015, 137, 11254.
DOI: 10.1021/jacs.5b07136
双键的异构化反应
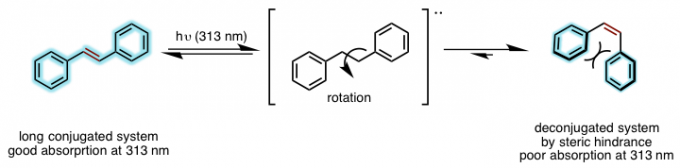
双键的“反顺”(E/Z)异构化是很早就被列入基础有机化学的反应。异构化反应是可逆反应,一般来说,烯烃生成物以热力学稳定的反式(E型)为主。而热力学不稳定的顺式(Z型)的选择性合成是比较难的,通常都是通过光照的反应通过E式的异构化而得到Z式烯烃。带有位阻的取代烯烃,在E式构型下,共轭体系更大,能够吸收313nm波长光,发生异构化为Z式,而有取代基的烯烃由于立体位阻无法实现好的共轭体系,对313nm波长光吸收较差,在光照的条件下,可逆平衡向着生成Z式烯烃的方向移动。(图 1)。如果使用光敏试剂的话,光敏感试剂将从光源吸收所得的能量传递给烯烃,即使是比313nm波长长的光源也可以间接被利用。
虽然人们对二苯乙烯、烷基苯乙烯衍生物的光异构化反应有所了解,但是其他类型的烯烃的光异构化反应我们了解的就很有限了。
近期的反应实例?
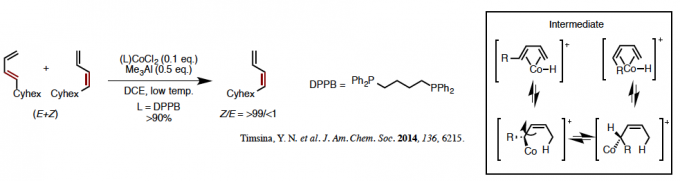
(a) Co络合物作为催化剂用于1,3-双烯衍生物的异构化反应(图 2)[1,2]
最终产物几乎全是Z型的生成物、这是由于立体位阻(1,3烯丙基张力)使得s-cis型不容易得到,无法形成Co络合物中间体(参见图2右栏中钴与1,3-二烯四个(碳)原子配位得到的中间体的平衡混合物)。E型(左上)优先反应,转化为Z式(右上)、从反应结果上看几乎全部转化为Z型双烯,看来Z型选择性异构化反应还是存在的,只不过底物适用范围仅限于1,3-二烯。
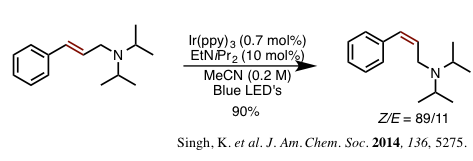
(b)通过 Ir(ppy)3的光照异构化反应(图 3)[3]
Ir(ppy)3作为有效的光敏试剂(光催化剂)、实现光照异构化的研究也有报道。各种各样的烯烃的Z型异构化是有可能的,但是反应中个必须用到昂贵的高价铱络合物。
本文要介绍的反应
明斯特大学的Gilmour教授等人最近报道的双键的Z型选择性光照异构化反应,其中所用催化剂的灵感来源于1967年首次被科学家报道的「视黄醛的光异构化反应」
视黄醛(维生素A的一种)是控制视觉的关键物质之一,在维生素B2(核黄素)的作用下由E型转变为Z型[4]。Gilmour等人尝试将维生素B2作为催化剂,在光照条件下作用于一般的烯烃(图 4)。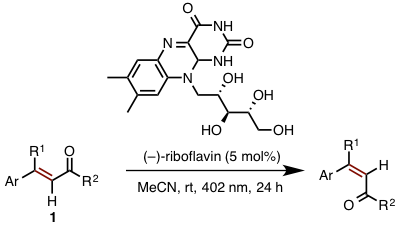
反应的特点
作者将维生素B2做催化剂的光照异构化反应应用于一系列烯酮衍生物。表现出以下三个特征:
- β位取代基(R1) :强供电子基团作为取代基的话,Z选择性高
- 羰基官能基团R2) :醛、酰胺、酮都有高的Z型选择性
- 芳香环(Ar):芳香环上ortho位如果有取代基、芳香环为五元杂环的情况下,Z体选择性降低
- 由特征1的結果推测自由基中间体的稳定性对反应有影响;
- 由特征3我们得知因为空间因素E型和Z型的共轭体系大小的区别是能否实现高选择性的关键。在任何情况下,和现有的光照异构化反应具有同样的特点。
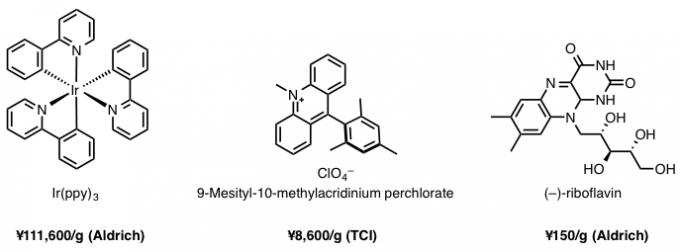
值得一提的是作为催化剂的维生素B2(核黄素)的价格,在这儿做个对比(图5):
- 市售Ir(ppy)3¥111,600JPY/g (Aldrich)、
- 常见的有机光催化剂Acr-Mes(9-Mesityl-10-methylacridinium perchlorate)是¥8,600JPY/g (TCI)、
- 而维生素B2(riboflavin)则相比起上面两项是压倒性的低价格¥150JPY/g(Aldrich)
总结
这一次的研究,作者是用廉价市售的维生素B2作为光催化剂,开发了肉桂酸的衍生物的高Z型选择性异构化反应。
该反应可谓是在新反应开发中温故而知新的一个好例子,这样的发现也让快被人们遗忘的经典研究再一次发光。
参考文献
- Pünner, F.; Schmidt, A.; Hilt, G. Angew. Chem., Int. Ed. 2012, 51, 1270. DOI: 10.1002/anie.201107512
- Timsina, Y. N.; Biswas, S.; RajanBabu, T. V. J. Am. Chem. Soc. 2014, 136, 6215. DOI: 10.1021/ja501979g
- Singh, K.; Staig, S. J.; Weaver, J. D. J. Am. Chem. Soc. 2014, 136, 5275. DOI: 10.1021/ja5019749
- Walker, A. G.; Radda, G. K. Nature, 1967, 215, 1483. DOI: 10.1038/2151483a0