在上一回第4弹中,我们介绍了Aldol反应的一些里程碑成果。
在这第五弹中,小编主要来介绍一下2000年到现在对于Aldol反应广受瞩目的研究实例。上篇(第四弹)也讲过了,以后羟醛缩合反应的主流应该就是开发一些以前被认为不可能反应的反应剂,或者开发新型催化剂提高反应底物的一般性以及产物的选择性。
那么我们一起来看一下一些比较有意思的反应实例吧。
新型催化烯醇生成法
一般烯醇的生成法的话在前面的记事中小编已经给大家介绍过了,大致就是碱催化脱氢,或者用烯胺型有机催化剂等常用手法。但是近年来,不通过脱氢的新方法被研究人员开发应用。这种手法的使用使得一些对弱碱不稳定的底物不再受限制,底物的一般性以及aldol反应的应用性进一步得到扩展,是十分有意义的进步。
接下来就主要介绍一下利用催化剂进行的非脱氢法烯醇的生成及其应用[1]。
● 1,4-还原法生成烯醇
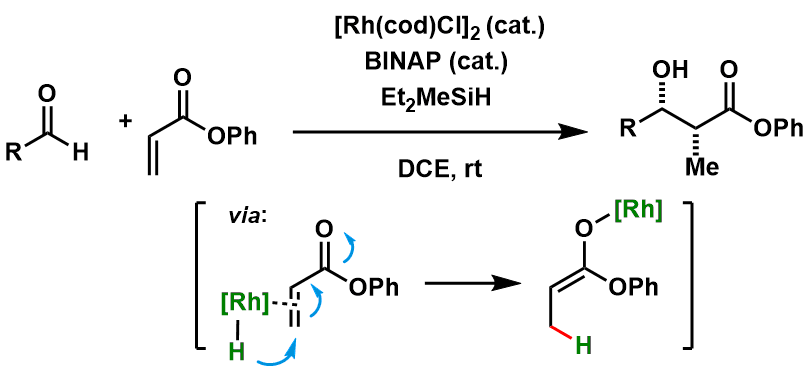
看小标题就大概能知道这是对不饱和羰基化物进行1,4-还原后,形成烯醇的手法。然后再与别的糖基化合物或者醛进行羟醛缩合,形成新的碳碳键。这种方法通常被称为还原羟醛缩合反应。很明显该方法不需要事先利用碱或胺催化剂形成烯醇后再进行反应,实验上也更简便。
而该方法的先驱,波士顿学院的J.P.Morken等人,利用Rh催化实现了这一还原Aldol反应(图1)[2]。
图1: Morken等人开发的催化还原不对称Aldol反应
近年,别的研究组报道了该反应后续的一些改良法,也是利用金属催化把酮变成缩醛,或者先利用烷基进行1,4-加成形成烯醇然后再进行后续一系列的反应等多种多样的手法。
● 通过脱碳酸形成烯醇
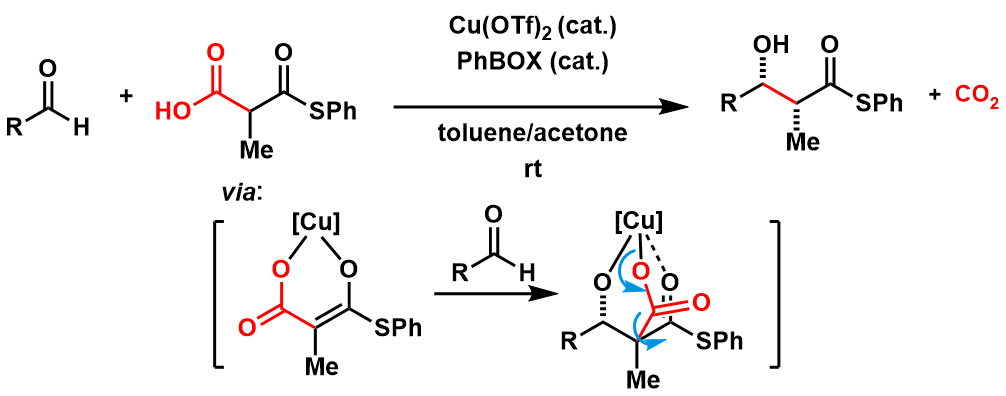
首先成功发现脱碳酸法进行催化不对称Aldol反应的是哈佛大学的M.D.Shair[3]。对于该方法的机理,普遍认为首先酸性较高的亚甲基脱氢形成Cu配位的烯醇,然后再与醛加成后引起脱碳酸,最终形成Aldol产物。该反应在室温条件下进行,反应中不需要加入任何强碱等,所以对底物没有任何限制,是十分实用的手法。
图2: Shair等人开发的脱碳酸型催化不对称Aldol反应
●通过硼酸对炔基的加成反应生成烯醇
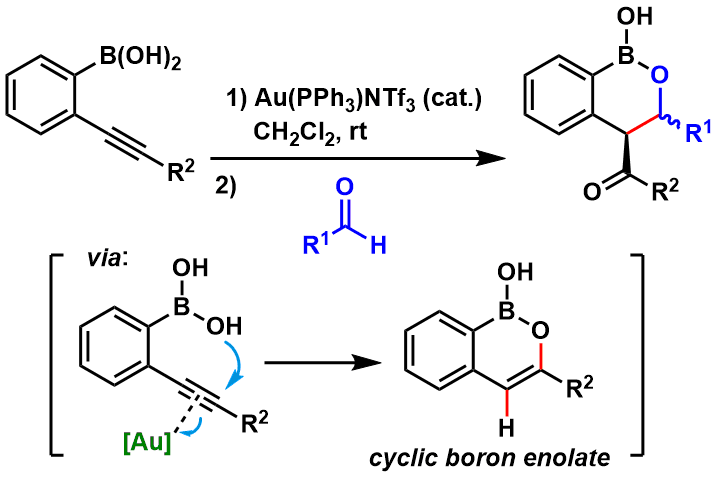
该方法的初衷就是合成硼化烯醇中间体,而此方法的特点就是利用硼酸对炔基进行加成后形成烯醇,由University College London的T. D. Sheppard首次开发报道[4]。反应中使用了金催化剂,室温条件下进行,后续又能与醛进行Aldol反应。但是由于硼酸加成只能在分子内进行,所以收到了一定的限制。不过这种想法不失为烯醇的其他新生成手法提供了一些线索与启发。
图3: Sheppard等人开发的分子内硼酸加成→Aldol反应
●通过烯烃异构化生成烯醇
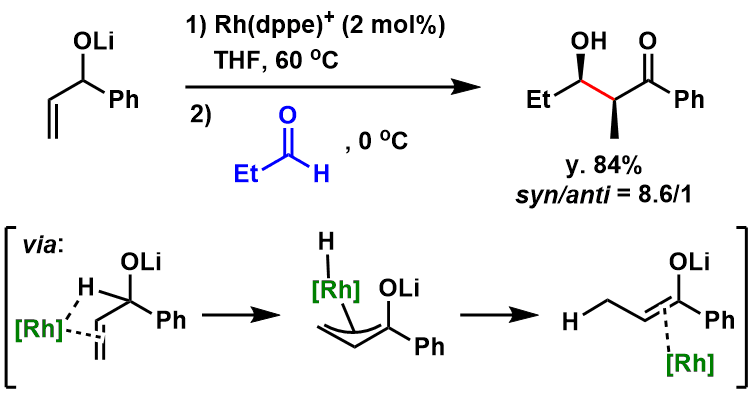
University College London的W. B. Motherwell等人,利用烯烃的催化异构化把烯丙基醇转化成金属化烯醇,然后再进行Aldol反应,该方法论如下图所示[5a, 5b]。该想法的优点:可以使得通常难以形成烯醇的醛也可以选择性转化成烯醇。可以使得通常难以形成烯醇的醛类也可以用此法选择性转化成烯醇[5c]。
图4: Motherwell等人开发的通过异构化催化形成烯醇→Aldol反应
反应性低的底物如何形成烯醇
除了上述给出的例子,其他手法一般都必须通过α位的脱氢化才能形成烯醇进行反应。对于α位C-H键酸性较高的底物(醛或酮)的烯醇转化条件已经发展的很好了,而对于α位C-H键酸性低的底物(酯或酰胺等)来说,一般都需要使用当量以上的强碱进行脱氢,反应条件太剧烈,底物拓展性受很大限制。所以就如第四弹中提到的「直接的Aldol反应」的想法来看,如果能够在温和条件下把α位酸性低的donor底物烯醇化,那么就能解决很多很多问题,开发出更多更多样的反应。
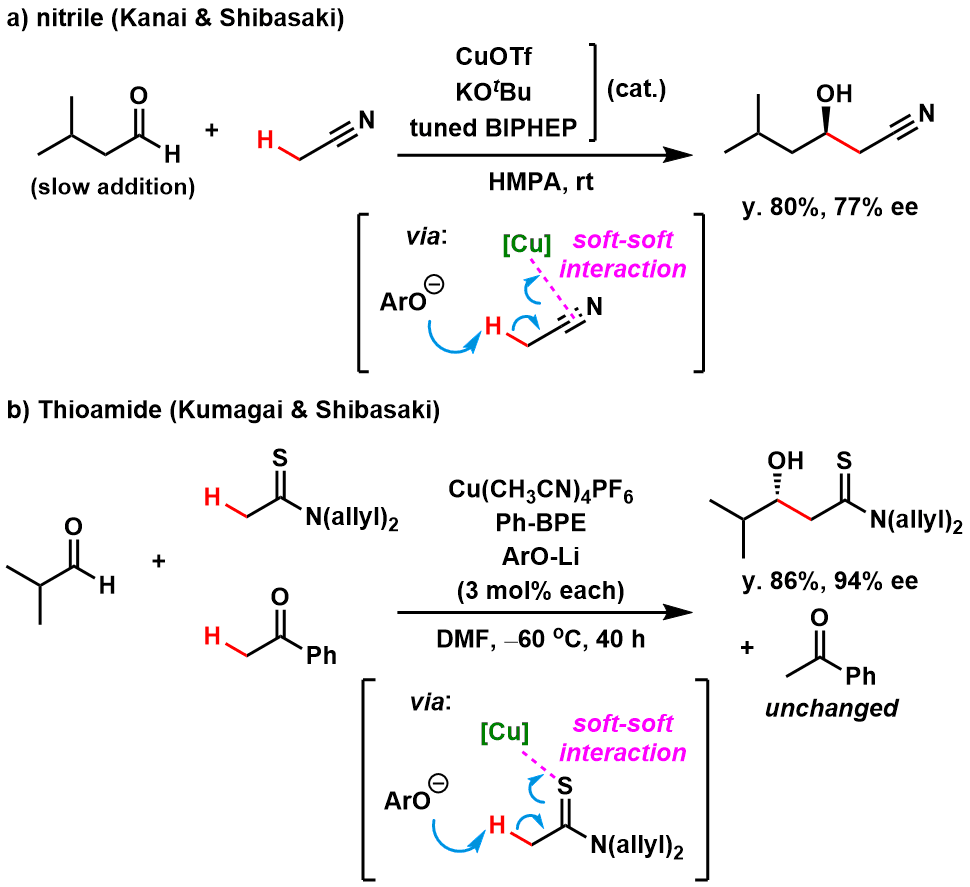
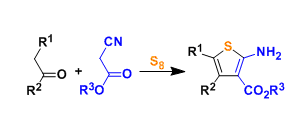
就小编所知,腈,硫代酰胺,酰胺,羧酸等已经可以利用催化剂催化形成烯醇,并且后续对C=X双键进行亲核加成的应用例已经有所报道。下图中给出了一个应用实例[5, 6]。
但是到目前为止都是通过活化含有羰基的作为donor使用的底物,相反的对于acceptor还没有更多新颖的idea报道,作为小编,一个作催化剂设计与反应开发的小博来说,如果能够通过催化剂的设计来把这个常识打破的话,那么是不是就屌爆了~
图5 :烷基腈与硫代酰胺的催化烯醇化→不对称Aldol反应
另外对于一些相关联反应、比如对于高活性 C=N键的催化烯醇加成(酰胺[7]、酯[8]、羧酸[9])或对缺电子的C=C键烯醇加成(酰胺[10])也已经被报道。
对于这些反应,目前为止,限制还是很多,有些体系醛/酮都无法作为亲电试剂使用。这类反应严格上来说一般都不归为Aldol反应,但是还是可以作为未来Aldol反应发展的参考。
结语
综上,我们从Aldol反应的基础知识,到历史发展,再到前沿实例做了一个简要得介绍。当然要很全面的列出各个发展时期的经典反应那真的有点为难小编,请大家理解下。如果想对Aldol有更深的认识了解的话,请筒子们查阅相关书籍或者文献。
从一开始的反应的发现,到后续这么多年的研究发展,说实话这样的的反应真的是很稀有,而且直到现在对于Aldol反应的研究还从未终止过。Aldol反应不失为有机合成领域的王道反应之一!
有机合成,说实话是一个特别累的专业,每天闷在研究室,看文献做实验,别人工作我实验,别人休息我还在实验。但是发现新东西,探索新反应的过程跟成就感也就像毒药一样促使着我们沉浸其中。作为小编个人来说,读博刚开始是为了高工资,而渐渐地发现兴趣超过了初衷,而这辈子,我也只想一直继续的干合成。
共勉!
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
参考文献
- Sheppard, T. D. Synlett 2011, 1340. DOI: 10.1055/s-0030-1260570
- Taylor, S. J.; Duffey, M. O.; Morken, J. P. J. Am. Chem. Soc. 2000, 122, 4528. DOI:10.1021/ja9944453
- (a) Magdziak, D.; Lalic, G.; Lee, H. M.; Fortner, K. C.; Aloise, A. D.; Shair, M. D. J. Am. Chem. Soc.2005, 127, 7284. DOI: 10.1021/ja051759j (b) Fortner, K. C.; Shair, M. D. J. Am. Chem. Soc. 2007,129, 1032. DOI: 10.1021/ja0673682 (c) Review: Wang, Z.-L. Adv. Synth. Catal. 2013, 355, 2745. DOI:10.1002/adsc.201300375
- (a) Edwards, G. L.; Motherwell, W. B.; Powell, D. M.; Sandham, D. A. J. Chem. Soc., Chem. Commun. 1991, 1399. DOI: 10.1039/C39910001399 (b) Gazaard, L. G.; Motherwell, W. B.; Sandham, D. A. J. Chem. Soc. Perkin Trans. 1, 1999, 979. DOI: 10.1039/A901370I (c) Lin, L.; Yamamoto, K.; Matsunaga, S.; Kanai, M. Angew. Chem. Int. Ed. 2012, 51, 10275. DOI: 10.1002/anie.201205680
- Suto, Y.; Tsuji, R.; Kanai, M.; Shibasaki, M. Org. Lett. 2005, 7, 3757. DOI: 10.1021/ol051423e
- (a) Iwata, M.; Yazaki, R.; Suzuki, Y.; Kumagai, N.; Shibasaki, M. J. Am. Chem. Soc. 2009, 131, 18244. DOI: 10.1021/ja909758e (b) Iwata, M.; Yazaki, R.; Chen, I.-H.; Sureshkumar, D.; Kumagai, N.; Shibasaki, M. J. Am. Chem. Soc. 2011, 133, 5554. DOI: 10.1021/ja200250p
- Kobayashi, S.; Kiyohara, H.; Yamaguchi, M. J. Am. Chem. Soc. 2011, 133, 708. DOI:10.1021/ja108764d
- Yamashita, Y.; Suzuki, H.; Kobayashi, S. Org. Biomol. Chem. 2012, 10, 5750. DOI:10.1039/c2ob25522g
- Morita, Y.; Yamamoto, T.; Nagai, H.; Shimizu, Y.; Kanai, M. J. Am. Chem. Soc. 2015, 137, 7075. DOI:10.1021/jacs.5b04175
- Suzuki, H.; Sato, I.; Yamashita, Y.; Kobayashi, S. J. Am. Chem. Soc. 2015, 137, 4336. DOI:10.1021/jacs.5b01943