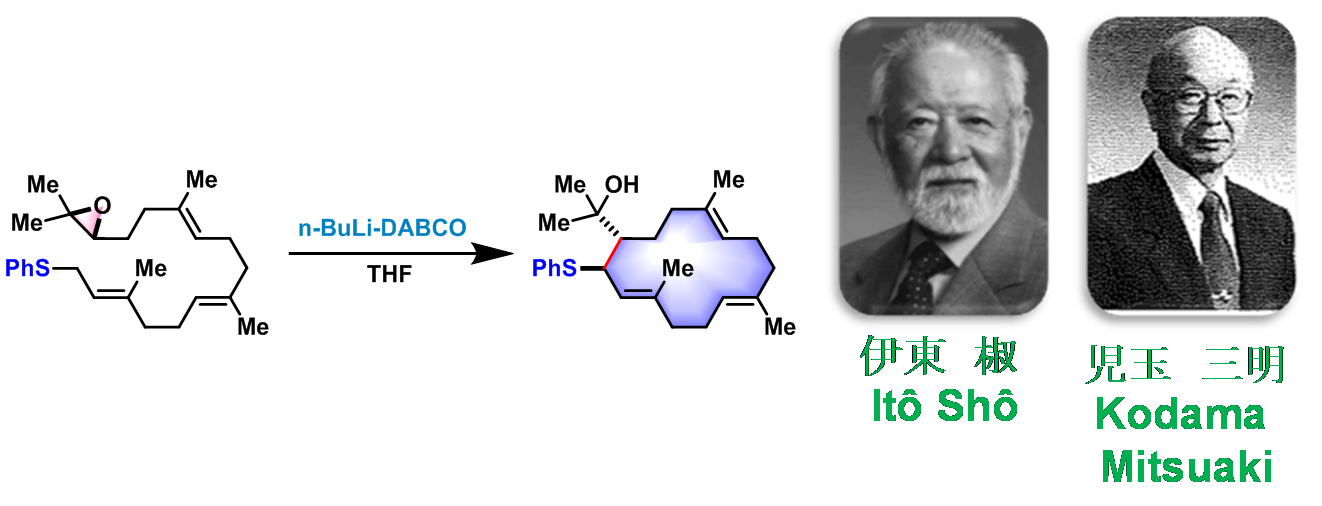
概要
Ito-Kodama环化(Ito-Kodama cyclization)是在强碱n-BuLi-DABCO参与下,α-硫基碳负离子(α-sulfenyl carbanion)与环氧化物之间进行的立体选择性分子内关环反应。该反应由日本Tohoku大学化学系(東北大学化学研究科,Department of Chemistry, Tohoku University)的Itô (伊東 椒, Itô Shô)与Kodama (児玉 三明, Kodama Mitsuaki)在1975年首次报道[1]。
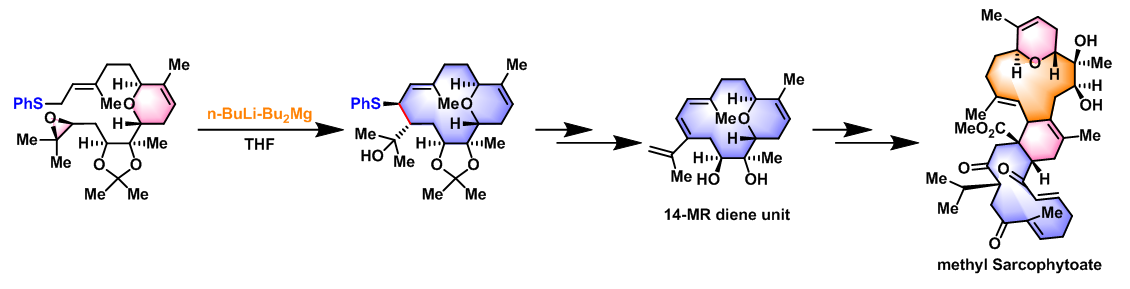
1997年,Nakata采用n-BuLi-Bu2Mg体系,提高了目标产物的产率,并对底物范围进行了扩展[2]。目前,该反应主要应用于各类大环萜类天然产物全合成的关键步骤[3]-[9]。
基本文献
- [1] Kodama, Y. Matsuki, S. Itô, Tetrahedron Lett, 1975, 16, 3065. doi: 10.1016/S0040-4039(00)75075-1.
- [2] M. Yasuda, M. Ide, Y. Matsumoto, M. Nakata, Synlett 1997, 899. doi: 10.1055/s-1997-967.
- [3] M. Kodama, Y. Matsuki, S. Itô, Tetrahedron Lett, 1976, 17, 1121. doi: 10.1016/S0040-4039(00)93767-5.
- [4] M. Kodama, Y. Matsuki, S. Itô, Tetrahedron Lett, 1977, 18, 2763. doi:10.1016/S0040-4039(01)83066-5.
- [5] K. Shimada, M. Kodama, Tetrahedron Lett, 1981, 21, 4275. doi: 10.1016/S0040-4039(01)82931-2.
- [6] M. Kodama, T. Takahashi,T. Kojima, S. Itô, Tetrahedron Lett, 1982,23, 3397. doi: 10.1016/S0040-4039(00)87625-X.
- [7] M. Kodama, K. Fukuzumi, M. Kumano, Bull. Chem. Soc. Jpn. 1989, 37, 1691.doi: 10.1248/cpb.37.1691.
- [8] M. Yasuda, M. Ide, Y. Matsumoto, M. Nakata, Bull. Chem. Soc. Jpn. 1998, 71, 1417. doi: 10.1246/bcsj.71.1417.
- [9] T. Ichige, Y. Okano, N. Kanoh, M. Nakata, J. Org. Chem. 2009, 74, 230. doi: 10.1021/jo802249k.
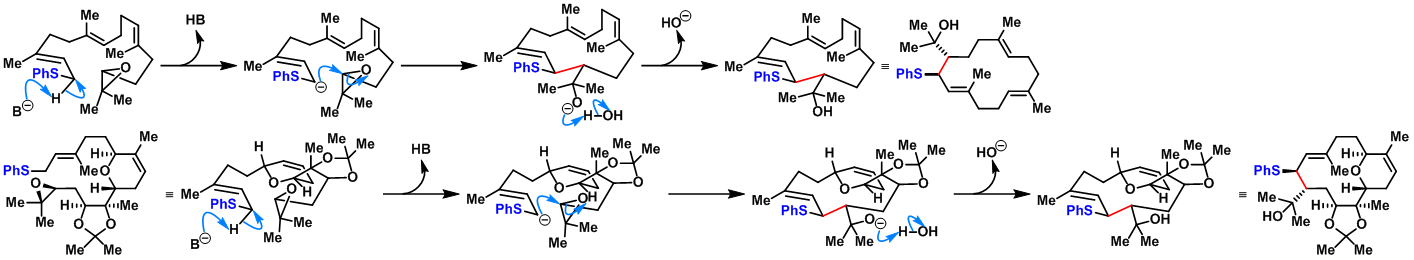
反应机理
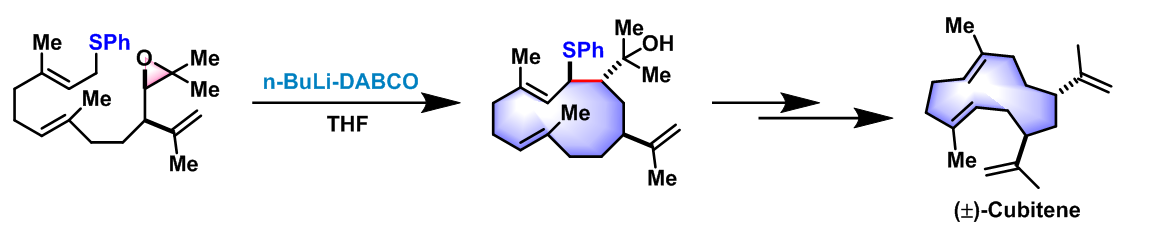
反应实例
(±)-Cubitene的立体选择性合成[1]-[2]
methyl Sarcophytoate中14员环二烯单元的对映专一性合成[3]-[5]
实验步骤
n-BuLi-DABCO条件
将环化底物 (1 eq)置于干燥的三口烧瓶中,并进行抽真空-充氩气过程1h,随后加入DABCO (1.02 eq),继续进行抽真空-充氩气过程20 min。再加入无水THF (底物浓度为0.003 M),后将反应体系置于干冰-甲醇浴 (-70 oC)内进行冷却。在-70 oC下搅拌40 min后,向上述反应体系中加入正丁基锂 (0.5 M,正己烷溶液,1.02 eq)。继续维持-70 oC,搅拌2h后,升温至0 oC,再继续搅拌2h,直至反应结束。反应结束后,加入适量水淬灭反应。淬灭完成后,减压除去溶剂,将上述反应混合物加水稀释,并采用乙酸乙酯进行萃取。合并的有机相依次用饱和碳酸氢钠、水及饱和食盐水进行洗涤,并用无水硫酸镁进行干燥。减压除去溶剂后,将粗产物采用氧化铝柱色谱 (正己烷/乙酸乙酯 10:1v/v作为洗脱剂)进行分离纯化,获得最终目标产物。
n-BuLi-Bu2Mg条件
在室温氩气气氛下,向丁基镁 (1 M正庚烷溶液,正丁基镁/仲丁基镁1:1,6 eq)中加入正丁基锂 (1.6 M正己烷溶液,3 eq)。降温至0 oC,向环化底物 (1 eq)的无水THF溶液(底物浓度为0.003 M)中加入上述强碱混合物。将上述反应混合物再次升至室温,并搅拌3h。反应结束后,加入适量水淬灭反应。淬灭完成后,减压除去溶剂,将上述反应混合物加水稀释,并采用乙酸乙酯进行萃取。合并的有机相依次用饱和碳酸氢钠、水及饱和食盐水进行洗涤,并用无水硫酸镁进行干燥。减压除去溶剂后,将粗产物采用氧化铝柱色谱 (正己烷/乙酸乙酯 10:1v/v作为洗脱剂)进行分离纯化,获得最终目标产物。
实验安全须知
小编郑重提示:丁基锂类试剂对空气中的水氧较为敏感,(尤其叔丁基锂遇空气极易自燃,进而造成严重实验事故,如美国ULCA的P. Harran研究室的研究助理S. Sangji就因使用叔丁基锂时,操作不当发生火灾,最终烧伤致死) 取用这类试剂时,均需要严格的无水无氧操作。尤其对于叔丁基锂,必要时建议在氩气手套箱中小心操作(操作时,实验台面务必整洁,同时移除台面上全部的可燃性的物品,如棉花、滤纸、有机溶剂及各类塑料容器等)。用注射器(最好采用带有Luer Lock的注射器)操作时,可将针头插入胶塞中隔绝空气,同时务必确保其密封性优良,最好采用抽取氩气(氩气与空气有较大的密度差异,比氮气能够更好地排除注射器内的空气)的方法,排除注射器内的空气,并严格按规范操作(安全的操作方法详见M. B. Johansen, J. C. Kondrup, M. Hinge, A. T. Lindhardt, Org. Process Res. Dev., 2018, 22, 903. doi: 10.1021/acs.oprd.8b00151),并穿戴防火实验防服。取用结束,拔出注射器时,尤其叔丁基锂,要严格防止溅出。实验结束后,务必要用醇类溶剂小心淬灭残留在注射器内的丁基锂试剂。反应的淬灭过程同样需要小心,可用正己烷类惰性溶剂先稀释,再用醇滴加淬灭,仔细操作。
参考文献
- [1] M. Kodama, T. Takahashi, T. Kojima, S. Itô, Tetrahedron 1988, 44, 7055. doi: 10.1016/S0040-4020(01)86074-9.
- [2] J. Wefer, K. Simon, T. Lindel, Phytochem Rev, 2013, 12, 1568. doi: 10.1007/s11101-012-9257-1.
- [3] M. Yasuda, M. Ide, Y. Matsumoto, M. Nakata, Synlett 1997, 899. doi: 10.1055/s-1997-967.
- [4] R. E. Mulvey, F. Mongin, M. Uchiyama, Y. Kondo, Angew. Chem. Int. Ed. 2007, 46, 3802. doi: 10.1002/anie.200604369.
- [5]T. Ichige, Y. Okano, N. Kanoh, M. Nakata, J. Am. Chem. Soc. 2007, 129, 9862. doi: 10.1021/ja073952e.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.