概要
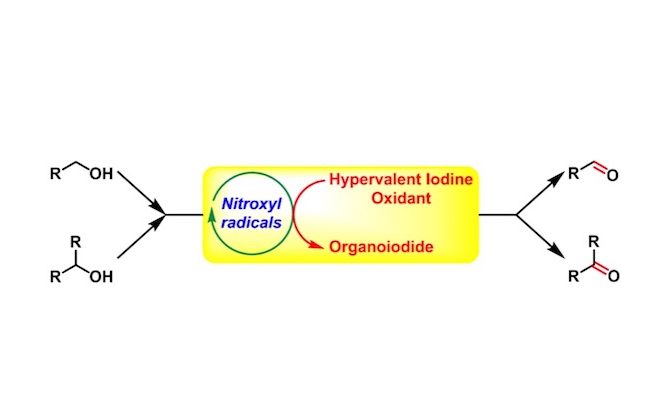
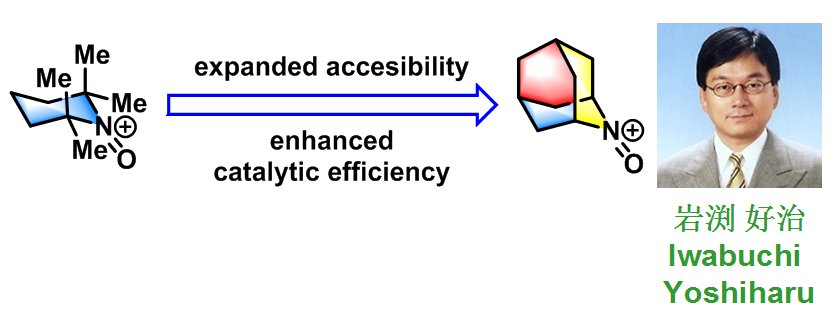
Cella-Piancatelli-Iwabuchi醇氧化(Cella-Piancatelli-Iwabuchi Alcohol Oxidation),是在氮氧自由基(N-oxy radicals or nitroxyl radicals),如TEMPO1, 2, 3催化下,采用mCPBA1、二乙酸碘苯3(BAIB)、三氟乙酸碘苯4等作为共氧化剂(co-oxidant),进行的一级与二级醇氧化为相应羰基化合物的反应。该反应在1975年由J.A.Cella首次报道1。然而,上述催化剂用于位阻较大的二级醇氧化时,反应活性较差。2006年日本东北大学(Tohoku University)的岩渊好治(Iwabuchi Yoshiharu)研究组采用较小位阻的AZADO(azaadamantane-N-oxyradical)5-6与1-Me-AZADO,成功将位阻较大的二级醇氧化为酮,扩展了底物应用范围,同时极大提高了氮氧自由基的催化效率。
2009年,该研究组又报道了比AZADO及1-Me-AZADO活性更高、更稳定,并具有更低位阻的9-氮杂双环[3.3.1]壬烷-N-氧基自由基(ABNO)7作为有机催化剂。之后,Iwabuchi又采用1-Me-AZADOCl/亚氯酸钠体系8,成功将一级醇氧化为相应羧酸。
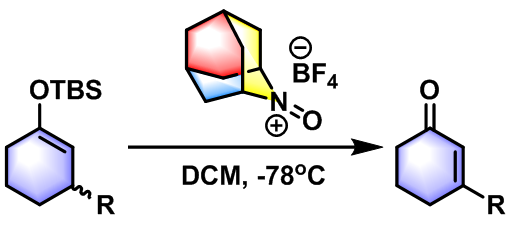
2012年,Iwabuchi研究组将该反应条件成功扩展至烯醇醚氧化为α,β-不饱和酮的反应9-10。
目前,该反应已经广泛应用于各类具有生理活性的天然产物构建时的关键步骤11-13。
基本文献
- [1] J. A.Cella, J. A. Kelley, E. F. Kenehan, J. Org. Chem. 1975, 40, 1860. doi:10.1021/jo00900a049.
- [2]A. E. J.deNooy,Arie C. Besemer, H. van Bekkum, Synthesis 1996, 1153. doi:10.1055/s-1996-4369.
- [3]A. De Mico, R. Margarita, L. Parlanti, A. Vescovi, G. Piancatelli, J. Org Chem 1997, 62, 6974. doi:10.1021/jo971046m.
- [4] M. Shibuya, M.Tomizawa, I. Suzuki,Y. Iwabuchi, J. Am. Chem. Soc. 2006, 128, 8412. doi: 10.1021/ja0620336.
- [5] G. Piancatelli, Francesca Leonelli, Org Syn. 2006, 83, 18. doi:10.15227/orgsyn.083.0018.
- [6]M. Shibuya, Y. Sasano, M. Tomizawa, T. Hamada, M. Kozawa, N. Nagahama, Y. Iwabuchi, Synthesis2011, 3418.doi:10.1055/s-0030-1260257.M. Shibuya,
- [7]M. Tomizawa, Y. Sasano, Y. Iwabuchi, J. Org. Chem. 2009, 74, 4619. doi:10.1021/jo900486w.
- [8]Shibuya M., Sato T., Tomizawa M., Iwabuchi Y., Chem. Commun., 2009, 1739.doi:10.1039/B822944A.
- [9]M. Hayashi, M. Shibuya, Y. Iwabuchi, Org. Lett2012,14, 154.doi:10.1021/ol2029417
- [10]Y. Iwabuchi,Chem. Pharm. Bull. 2013, 61, 1197.doi: 10.1248/cpb.c13-00456.
- [11]K.C. Nicolaou,A. Ortiz, H. Zhang, P. Dagneau, A. Lanver, M. P.Jennings, S. Arseniyadis, R. Faraoni, D. E. Lizos, J. Am. Chem. Soc. 2010, 132, 7138. doi:10.1021/ja100740t.
- [12]S. V. Pronin, S. A. Kozmin, J. Am. Chem. Soc. 2010, 132, 14394. doi: 10.1021/ja107190w.
- [13]J. R. Butler, C. Wang, J. Bian, J. M. Ready, J. Am. Chem. Soc. 2011, 133, 9956. doi:10.1021/ja204040k.
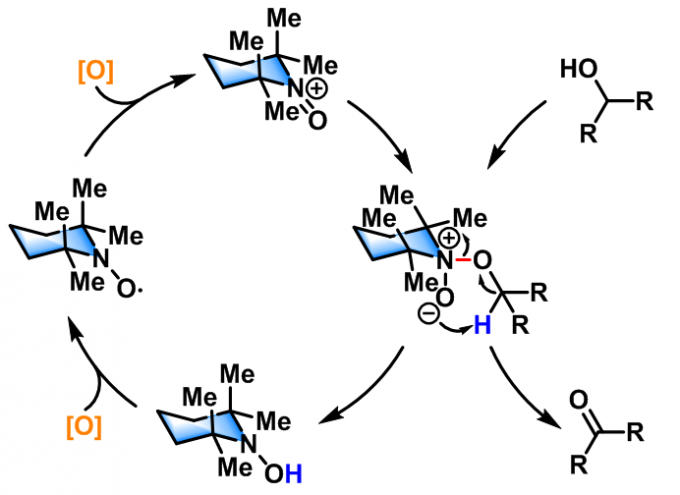
反应机理
反应实例
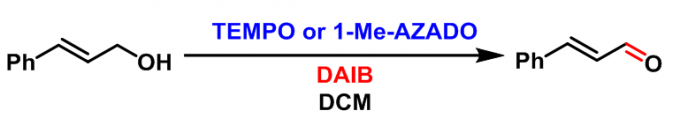
肉桂醛的合成[1]
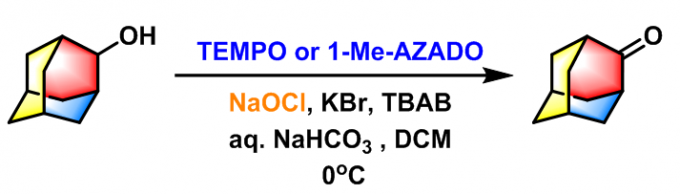
金刚烷酮的合成[1]
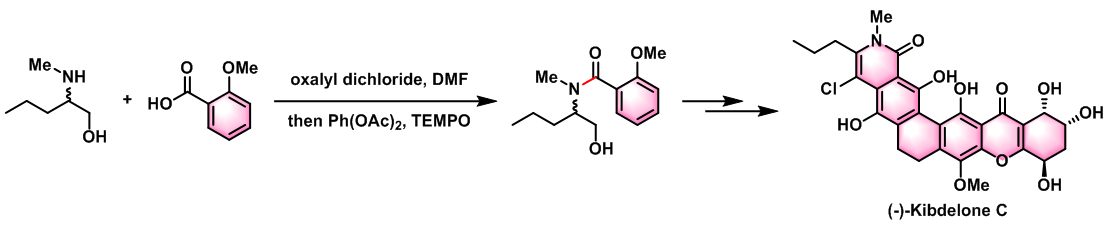
(-)-Kibdelone C的对映选择性合成[2]
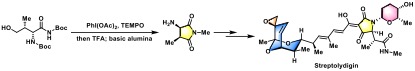
细菌RNA聚合酶Streptolydigin的合成[3]
实验步骤
采用TEMPO作为催化剂:将BAIB(1.1eq.)加入到醇(1 eq.)与TEMPO(0.1 eq.)的DCM(底物浓度为1M)溶液中。将上述反应混合物在室温下搅拌2.5 h。反应结束后,将反应液用DCM稀释,后加入sat. Na2S2O3洗涤,再加入DCM萃取有机相。将合并的有机相依次用NaHCO3及饱和食盐水洗涤,减压除去溶剂后,对所得粗产物采用硅胶柱色谱进行分离纯化,获得相应目标产物。
采用AZADO或1-Me-AZADO作为催化剂,NaOCl作为氧化剂:0oC下,向醇(1 eq.)与1-Me-AZADO(1 eq.)的DCM(底物浓度为0.4M)溶液及含有KBr(0.1 eq.,浓度为0.074 M)与Bu4NBr(0.05 eq.,浓度为0.037 M)的sat. NaHCO3(2 mL)水溶液形成的两相混合物中加入预先混合的NaOCl(8% Cl)与sat. NaHCO3(1:1.4v/v)水溶液(滴加时间超过6 min)。维持0oC,将上述反应混合物剧烈搅拌20 min后,加入sat. Na2S2O3水溶液淬灭反应。淬灭结束后,分出水相,并用乙醚进行萃取,将合并的有机相加入饱和食盐水进行洗涤,随后用无水MgSO4进行干燥,减压除去溶剂。将粗产物采用快速柱色谱(SiO2, Et2O/正己烷, 1:6v/v)分离纯化,获得相应目标产物。
采用AZADO或1-Me-AZADO作为催化剂,DAIB作为氧化剂:将PhI(OAc)2(DIAB, 1.5 eq.)加入到醇(1 eq.)及1-Me-AZADO(10 eq.)的DCM(底物浓度为1M)溶液中。将上述反应混合物在室温下搅拌40min后,将反应液用Et2O稀释,再依次加入sat. NaHCO3与sat. Na2S2O3水溶液淬灭反应。淬灭结束后,分离出有机层,将水相继续用乙醚进行萃取,将合并的有机相加入饱和食盐水进行洗涤,随后用无水MgSO4进行干燥,减压除去溶剂。将粗产物采用快速柱色谱(SiO2, Et2O/正己烷, 1:6v/v)进行分离纯化,获得相应目标产物。
实验实验安全须知
小编郑重提示:有机高价碘化合物具有较强的爆炸性,实验称量及反应结束后的淬灭过程均需要十分小心、仔细操作。
参考文献
- [1] M. Shibuya, M. Tomizawa, I. Suzuki,Y. Iwabuchi, J. Am. Chem. Soc. 2006, 128, 8412. doi: 10.1021/ja0620336.
- [2] J. R. Butler, C. Wang, J. Bian, J. M. Ready, J. Am. Chem. Soc. 2011, 133, 9956. doi:10.1021/ja204040k.
- [3] S. V. Pronin, S. A. Kozmin, J. Am. Chem. Soc. 2010, 132, 14394. doi: 10.1021/ja107190w.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.