由醇合成金属有机化合物
- 概要
硅醚化是保护醇羟基的有效方法。常用于实验室规模的精密合成中。
常用硅原子上有至少两个相同取代基R’的有机硅试剂,否则硅原子会产生不对称中心,使非对应异构体的后处理变得复杂。
TBS, TIPS, TBDPS基的空间位阻大,分子中同时存在仲醇或叔醇羟基时,可选择性的只保护伯醇羟基。
- 基本文献
・Corey, E. J.; Venkateswarlu, A. J. Am. Chem. Soc. 1972, 94, 6190. DOI: 10.1021/ja00772a043
・Corey, E. J.; Cho, H.; Rucker, C.; Hua, D. H. Tetrahedron Lett. 1981, 22, 3455. doi:10.1016/S0040-4039(01)81930-4
・Review: Nelson, T. D.; Crouch, R. D. Synthesis 1996, 1031. DOI: 10.1055/s-1996-4350
- 反应机理
1.保护
通常硅化学中,硅原子上置换反应是通过五配位的中间体进行的,离去基团(电负性最强基团)在中间体(六面体)发生反转时离去。
2.脱保护
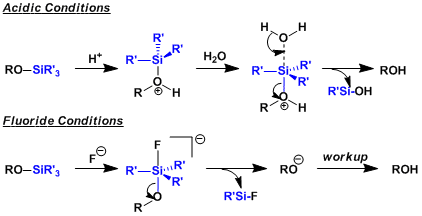
和保护的机理相同也是通过五配位中间体完成的,即使在酸性条件下也一样。因为硅阳离子不稳定,所以不会通过碳置换(即SN1过程)来进行。用氟源脱保护的驱动力是形成强的Si-F键(Si-F键比Si-O键强大致30kcal/mol)
- 反应实例
保护 脱保护的典型实例[1]
用NaH做碱,对二醇中的一个羟基保护(mono-protection)很有效。[2]
碘做催化剂的TMS保护[3]
用Si-BEZA保护[4]:温和条件下对叔醇羟基的保护
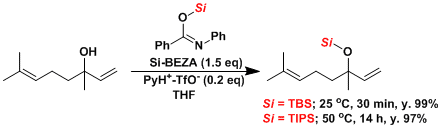
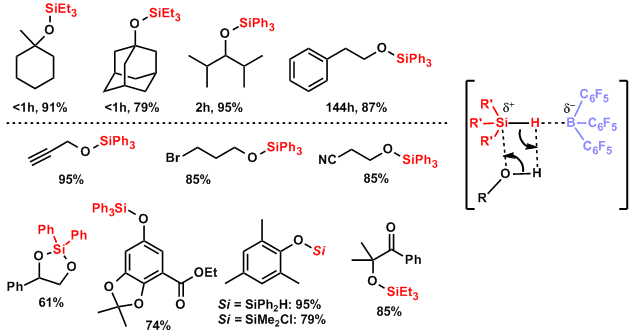
用三(全氟苯基)硼烷的硅醚合成[5]:不光能和许多的官能团反应,对有空间障碍的醇也能在短时间内保护
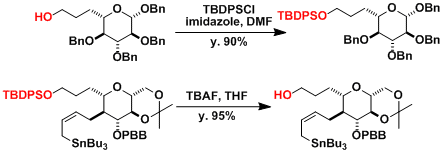
实验步骤
把醇(4.40 g, 13.6 mmol)溶解于DMF(90mL)中,在0 C 下加入咪唑(3.88 g, 56.9 mmol)
和叔丁基二甲基氯硅烷(4.09 g, 27.1 mmol)。 升至室温,搅拌16 h。加入足量的水结束反应,用水和乙酸乙酯萃取三次。有机相用硫酸镁干燥,过滤后浓缩,粗产物用柱层析色谱(正己烷:乙酸乙酯= 50:1)纯化分离。目标产物为黄色液体(99%收率)
l 用R’3SiCl/咪唑或R’3SiOTf/2,6-二甲基吡啶的条件,可高收率的得到硅醚。后者反应活性高,可用于保护反应较慢的仲醇,叔醇。
l 脱保护一般可在酸性条件下加水分解或者用含F负离子的氟化物。后者反应发生的动力是生成强的Si-F键
实验技巧
使用DMF作为溶剂时,反应淬灭时用大量水稀释,再用正己烷(或石油醚)/乙酸乙酯混合溶剂萃取效果较好。DMF不容易进入有机相,萃取操作更容易。
以下列举一些常用的保护基
TBS是一般作为首选,其他基团也用
TMS基是最容易脱保护的基团,所以一般用在保护大位阻的叔醇,或短时间的保护
酸性条件下稳定性 TMS<TES<TBS<TIPS<TBDPS
对氟负离子稳定性 TMS<TES< TIPS < TBS <TBDPS
TBAF条件下脱保护生成的烷氧基铵碱性强,不适用于对碱性条件敏感的化合物。为了缓冲碱性条件,可加入醋酸,或者尝试更温和的HF Py、3HF Et3N等缓冲体系。


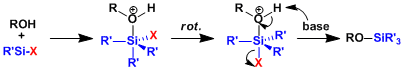

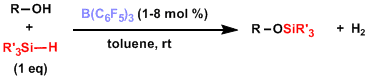















No comments yet.