概要
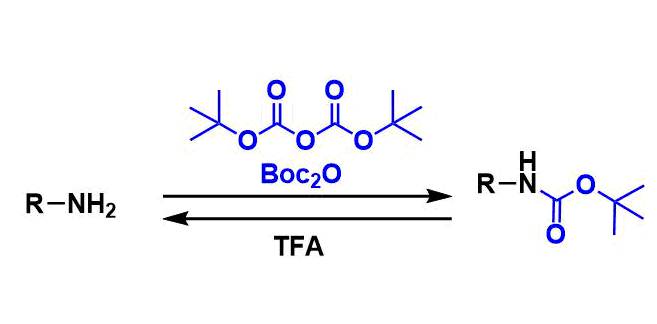
叔丁氧基羰基保护基(tert-butoxycarbonyl, Boc)、它经常用于通过形成氨基甲酸酯来保护胺基。特别是,它被用作胺保护基的主要选择。在某些情况下,它还用于酒精和苯酚上羟基的保护基。
对于强碱条件下的酯水解条件・亲核条件・接触还原条件・弱的氢化物的还原条件耐受性好,脱保护通常在强酸性条件下进行。因此,它可以与Fmoc保护基,Cbz保护基等互补使用。
它还广泛用于肽固相合成方法。
基本文献
- Lundt, B. F.; Johansen, N. L.; Vølund, A.; Markussen, J. Int. J. Pept. Protein Res.1978, 12, 258. doi:10.1111/j.1399-3011.1978.tb02896.x
- Chankeshwara, S. V.; Chakraborti, A. K. Org. Lett. 2006, 8, 3259. doi:10.1021/ol0611191
Boc-SPPS
- Merrifield, R. B. Biochemistry 1964, 3, 1385. DOI: 10.1021/bi00897a032
review
- Agami, C.; Couty, F. Tetrahedron 2002, 58, 2701. doi:10.1016/S0040-4020(02)00131-X
反应机理
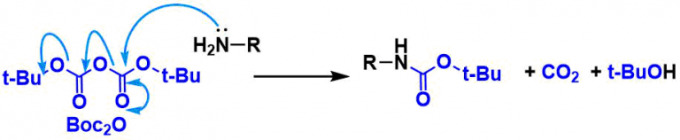
保护
二碳酸二叔丁酯(Boc2O)是用的最多的。反应中的碱通常为吡啶或三乙胺。对于氨基酸的保护等,使用无机碱的Schotten-Baumann条件也很常见。
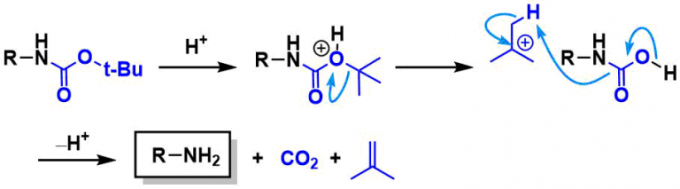
脱保护
在强酸性条件下通过产生叔丁基阳离子脱保护。经常使用三氟乙酸(TFA)/二氯甲烷或neat条件,盐酸/甲醇条件等。由于仅副产挥发性异丁烯和CO2,因此后处理也很简单。
反应实例
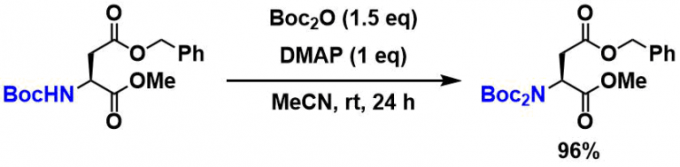
通过添加DMAP、可以对亲核性较低的酰胺基保护、而且可以进行吲哚上氮的保护或者也可以合成di-Boc体。下面为其中的一个示例[1]。
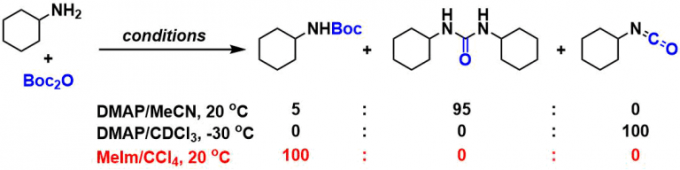
DMAP条件下也会存在over reaction的问题(特别是苯胺的保护等),在这个时候、可以选择试一下N-甲基咪唑的条件[2]。
对环状氨基甲酸酯和恶唑烷酮的羰基进行加溶剂分解时,可以用Boc保护[3]。
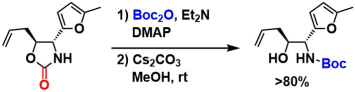
one-step将Fmoc基替换成Boc基[4]。
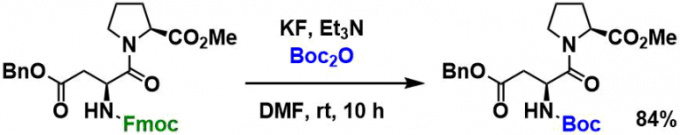
叠氮基在加氢还原的条件下与Boc2O共存、得到Boc保护的产物[5]。
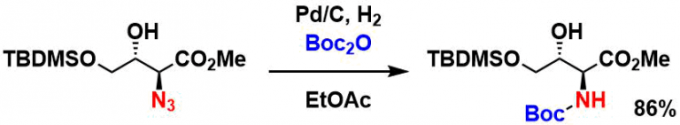
TMSOTf/Et3N或者TMSOTf/2,6-lutidine条件下、可以进行对酸性条件不稳定的化合物的选择性脱Boc反应。下面就是一个Cyclotheonamide B的全合成的实用例子[6]。
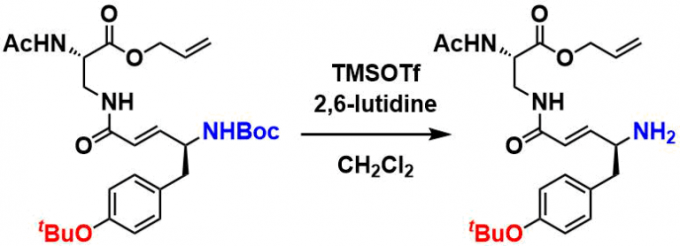
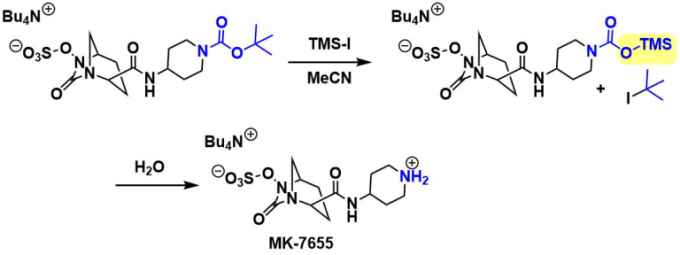
TMS-I条件下的脱保护[7]。下述的实例中[8]、对于底物中含有其他敏感基团的情况下,也可以实现选择性脱Boc。
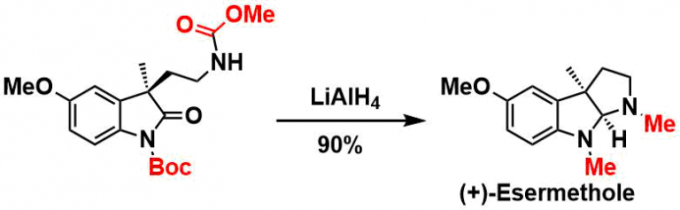
另外通过LiAlH4处理、直接还原成甲基的情况也有。请参照下图中(+)-Esermethole合成应用实例[9]。
实验技巧
- 在脱保护过程中,化合物中含有的亲核部分通常与副产的叔丁基阳离子反应。为了防止这种情况,可以加入阳离子清除剂(苯甲醚,硫代苯甲醚,苯硫酚,二甲基硫醚等)作为添加剂。
- 在Boc脱保护过程中形成的铵化合物是、可以通过2%MeOH/Et2O从有机化合物中分离(参考)。
- 咪唑/三氟乙醇条件适合于破坏和除去过量的Boc2O[10]。
实验步骤
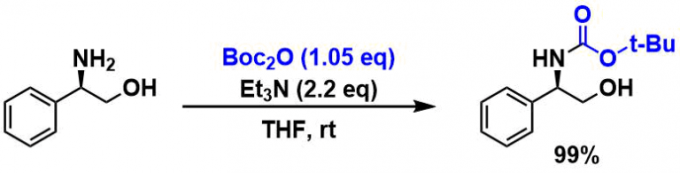
(R)-苯基甘氨酸(1.0 g、7.3 mmol)溶解于THF(10 mL)、在冰浴下加入三乙胺(2.14 mL、15.4 mmol)和Boc2O(1.08 g、7.7 mmol)的THF溶液(10 mL)、在室温下搅拌2小时。 然后减压浓缩到一半体积,然后加入hexane重结晶。 抽滤得到固体、用hexane洗净。 产率1.72 g(99%)。
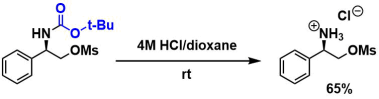
在二氧六环(10 mL)中、(R)–2-(叔丁氧基羰基氨基)-2-苯基乙基甲磺酸盐(2.5 g、7.9 mmol)的溶液中滴加HCl(10 mL、4 M in dioxane)、搅拌1小时。旋蒸除去挥发性物质,residue用乙腈/乙醚重结晶。 产率1.28 g(65%)
参考文献
- Englund, E. A.; Gopi, H. N.; Appella, D. H. Org. Lett. 2004, 6, 213. DOI: 10.1021/ol0361599
- (a) Basel, Y.; Hassner, A. J. Org. Chem. 2000, 65, 6368. DOI: 10.1021/jo000257f(b) Ragnarsson, U.; Grehn, L. Acc. Chem. Res. 1998, 31, 494. DOI: 10.1021/ar980001k
- Ishizuka, T.; Kunieda, T. Tetrahedron Lett. 1987, 28, 4185. doi:10.1016/S0040-4039(00)95574-6
- Li, W.-R.; Jiang, J.; Joullie, M. M. Tetrahedron Lett. 1993, 34, 1413. doi:10.1016/S0040-4039(00)60305-2
- Saito, S.; Nakajima, H.; Inaba, M.; Moriwake, T. Tetrahedron Lett. 1989, 30, 837. doi:10.1016/S0040-4039(01)80629-8
- Bastiaans, H. M. M.; van de Baan, J. L.; Ottenheijm, H. C. J. J. Org. Chem. 1997, 62, 3880. DOI: 10.1021/jo961447m
- (a) Lott, R. S.; Chauhan, V. S.; Stammer, C. H. J. Chem. Soc., Chem. Commun.1979, 495. doi:10.1039/C39790000495 (b) Olah, G.; Narang, S. C. Tetrahedron1982, 38, 2225. doi:10.1016/0040-4020(82)87002-6 (c) Jung, M. E.; Lyster, M. A. J. Chem. Soc., Chem. Commun. 1978, 315. doi:10.1039/C39780000315
- Liu, Z.; Yasuda, N.; Simeone, M.; Reamer, R. A. J. Org. Chem. 2014, 79, 11792. doi:10.1021/jo502319z
- Bui, T.; Syed, S.; Barbas, C. F. III J. Am. Chem. Soc. 2009, 131, 8758. DOI: 10.1021/ja903520c
- Basel, Y.; Hassner, A. Synthesis 2001, 550. DOI: 10.1055/s-2001-12350
相关书籍
Greene’s Protective Groups in Organic Synthesis
- 著者Peter G. M. Wuts
- 参考価格¥ 12,342
- 出版社John Wiley & Sons Inc
外部链接
- tert-Butyloxycarbonyl protecting group – Wikipedia
- tert-butyl carbamate (Organic Chemistry Portal)
- Protecting Group (PG) (PDF)
- Boc solid phase peptide synthesis
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.