作者:石油醚
导读:
近日,德国明斯特大学的Frank Glorius教授课题组以系列硫醚作为双功能试剂,实现了BCB的硫-炔基化、硫-烯基化以及硫-烯丙基化反应,大部分例子都显示出了优异的区域选择性和立体选择性(>95:5)。同时,硫-烯基化还展示了优异的E式选择性。该研究具有原子利用率高、反应条件简单温和以及优异选择性等优势。该研究为BCB环实现顺式双功能化研究提供了新的思路和空间
syn-Selective Difunctionalization of Bicyclobutanes Enabled by Photoredox-Mediated C–S σ-Bond Scission
Huamin Wang, Johannes E. Erchinger, Madina Lenz, Subhabrata Dutta, Constantin G. Daniliuc, and Frank Glorius*
J. Am. Chem. Soc. 2023, ASAP. doi: 10.1021/jacs.3c08512.
正文:
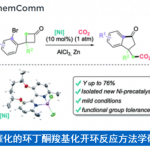
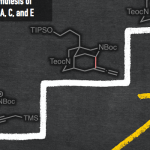
环丁基结构在药物分子中广泛存在,因此,构筑该类型的分子骨架具有重要的研究意义。双环[1.1.0]丁烷(BCB)近年来通过strain-release的方式成为了构筑含环丁基的化合物的重要前体。但是,该领域的区域选择性和立体选择性依然面临着很大的挑战,尤其合成多取代环丁烷衍生物的选择性难以控制。最近,Frank Glorius课题组通过光氧化诱导两组分双官能团化反应,以strain-release方式合成了一系列顺式硫-炔基取代、硫-烯基取代以及硫-烯丙基取代的环丁烷产物,反应显示出了优异的区域选择性和立体选择性(如图1所示)。
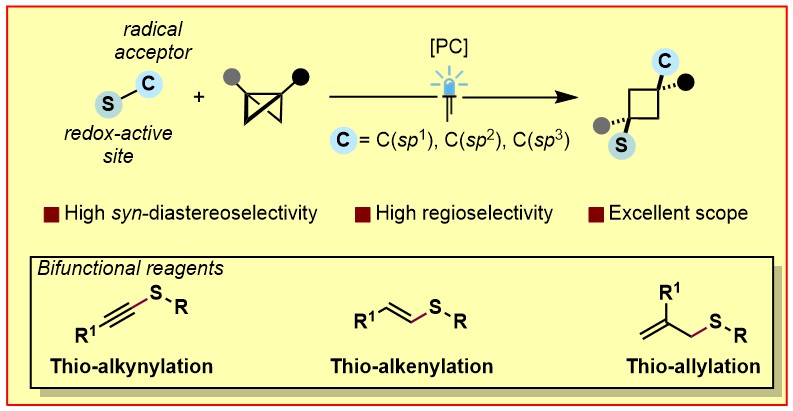
图1. BCB的顺式双硫化-碳化反应
首先作者在经过系列条件优化后,发现以[Acr-Mes2]+[ClO4]−作为光催化剂,可以在温和条件下,以89%的收率得到BCB的顺式硫甲基-炔基化。作者还进行了不同反应条件的敏感性评估,进一步了解了反应的适用性(如图2所示)。
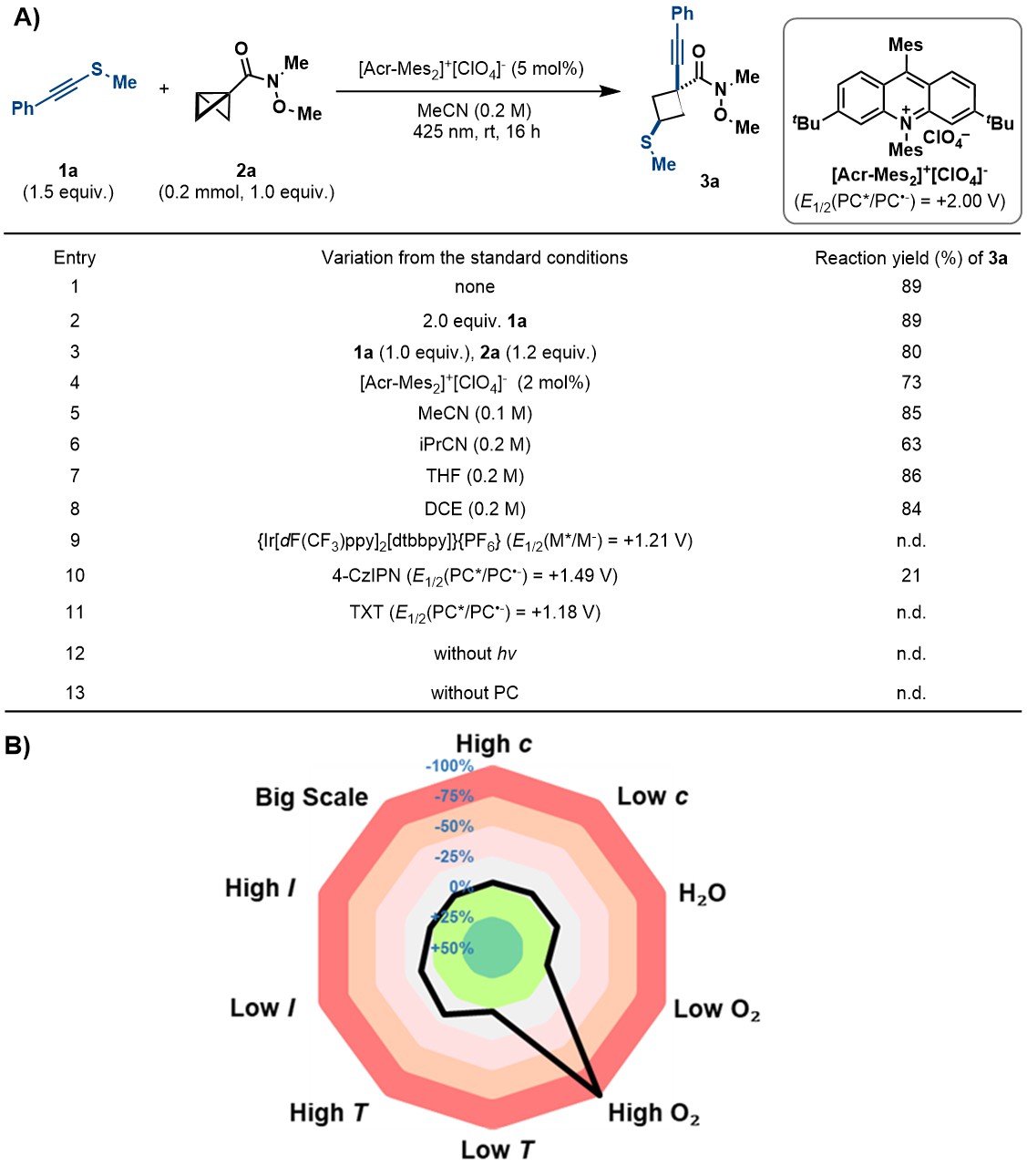
图2.反应条件优化以及敏感性因素评估
在最优反应条件下,作者进行了反应底物的拓展。一系列炔基硫化物都可以作为双功能试剂得到目标产物,同时显示了优异的区域选择性和立体选择性(r.r.和d.r.>95:5)(如图3和图4所示)。同时,硒化-炔基化也可以在该条件下进行。另外,在该氧化诱导顺式双官能团化的策略指导下,作者使用一系列烯基硫化物和烯丙基硫化物作为双功能试剂,得到相应的目标产物,大部分例子的r.r.值和d.r.值都大于95:5(如图4所示)。
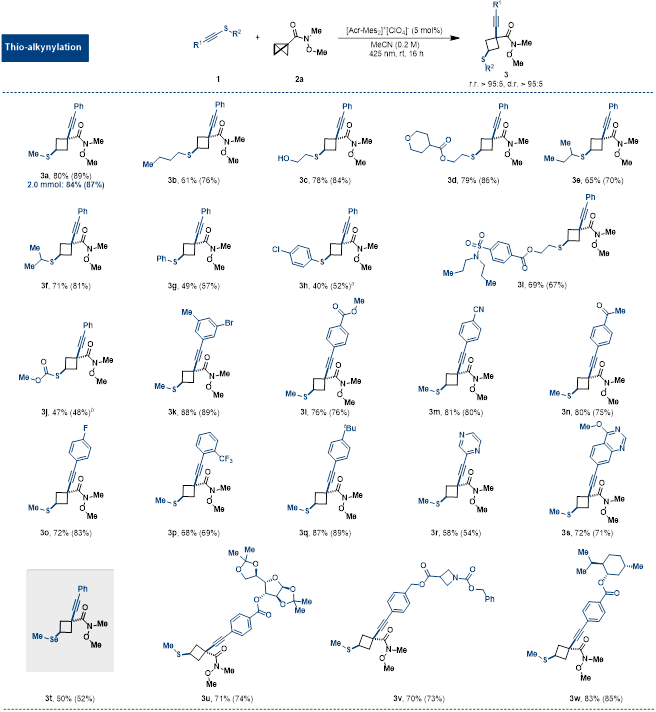
图3. BCB的硫化-炔基化底物拓展
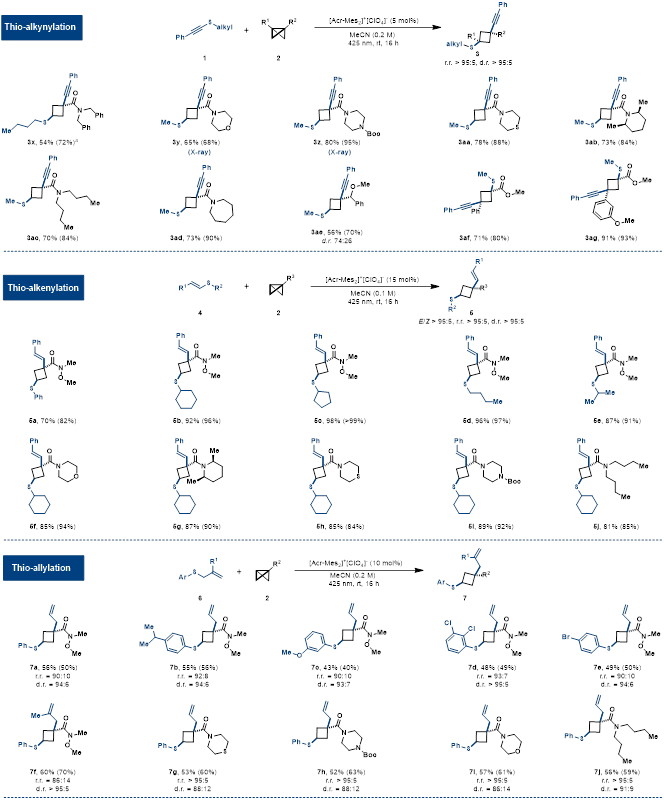
图4.BCB的硫化-炔基、烯基、烯丙基化底物拓展
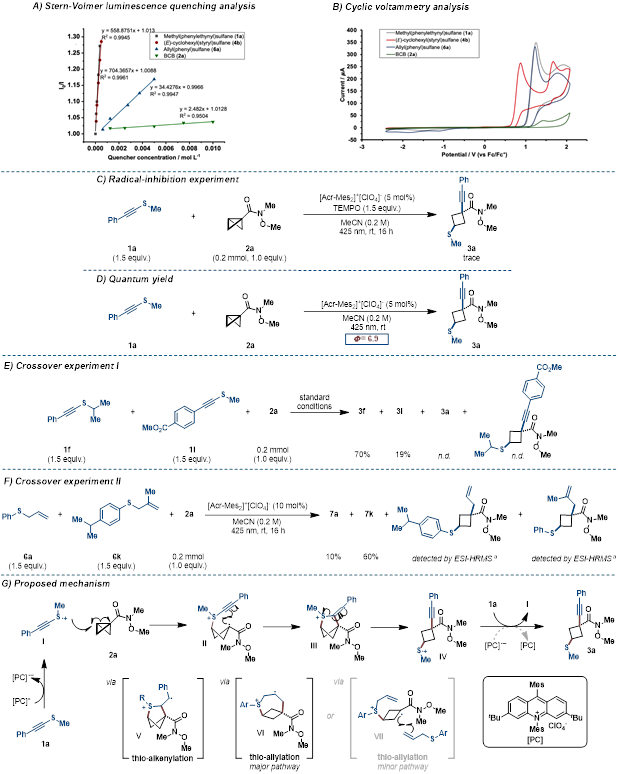
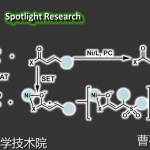
图5.机理研究
最后,作者通过系列的机理研究验证了反应的机制(如图5所示)。例如,量子产率实验结果揭示了该反应经历链式的过程。分子间的交叉控制实验证实了,该反应的硫碳化皆是来自于同一个分子内的硫和碳,进一步验证了反应最初的设计。结合光淬灭实验和循环伏安等辅助手段。作者提出了自由基链式双官能团化的过程。
总结:Frank Glorius课题组以系列硫醚作为双功能试剂,实现了BCB的硫-炔基化、硫-烯基化以及硫-烯丙基化反应,大部分例子都显示出了优异的区域选择性和立体选择性(>95:5)。同时,硫-烯基化还展示了优异的E式选择性。该研究具有原子利用率高、反应条件简单温和以及优异选择性等优势。该研究为BCB环实现顺式双功能化研究提供了新的思路和空间。
(王华敏博士供稿)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.



















No comments yet.