一、引言
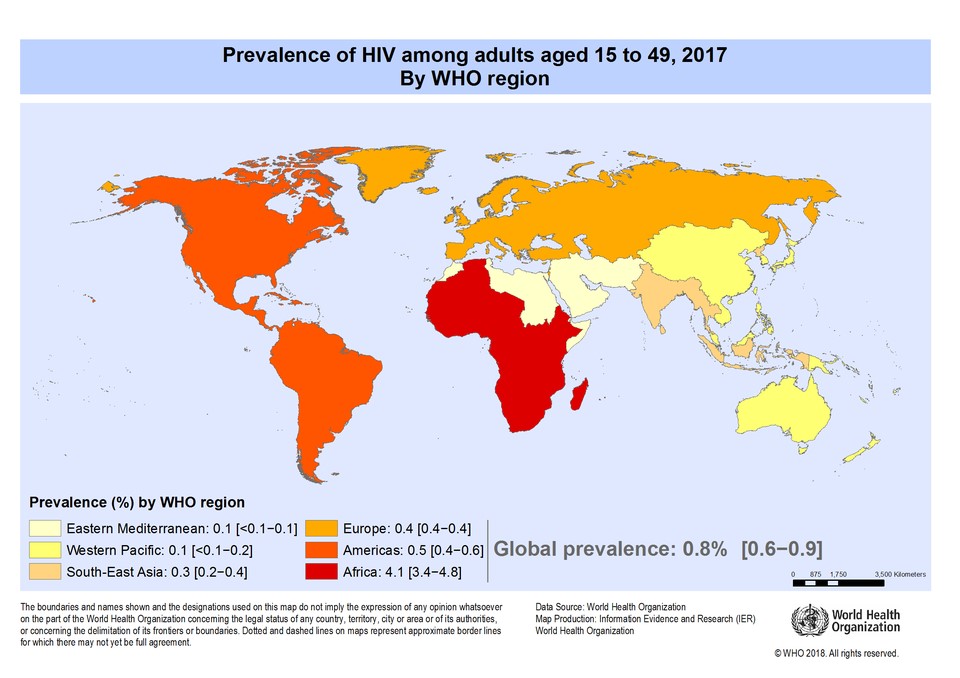
艾滋病是获得性免疫缺陷综合征(Acquired Immune Deficiency Syndrome,AIDS)的音译,它源于一种名为人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)的逆转录病毒,感染后破坏人体免疫系统,使得人体极易感染多种疾病或因各种并发症而死亡。根据世卫组织和联合国艾滋病规划署的估计,截至2018年底,全球约有3790万艾滋病毒感染者,并且这个数字每年都在增加[1],更为严峻的是目前艾滋病毒感染不可治愈,仅能通过长期服用药物将体内病毒抑制于较低水平。
图 1 2017年全球15-49岁成年人中艾滋病毒的流行率(图片来源于WHO)
二、艾滋病毒的复制
艾滋病毒感染宿主细胞后需要复制产生更多的后代,复制过程涉及多个重要环节,理论上而言中断任何过程HIV病毒都不能成功复制,因而这些关键环节也成了研制艾滋药物的重要靶点。此处,我们仅对艾滋病毒完整的复制周期进行简要介绍。
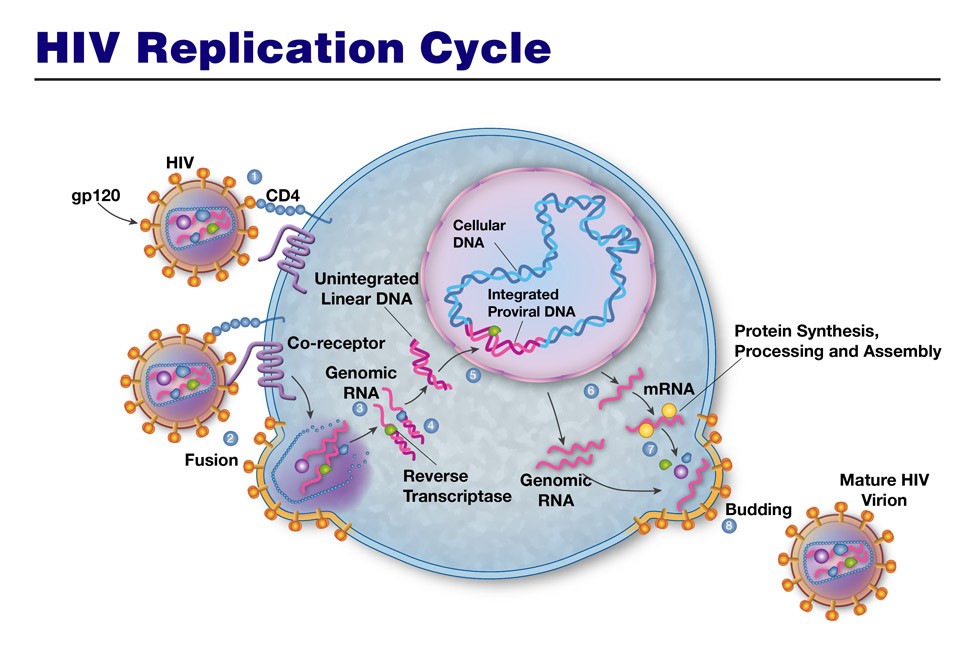
首先,HIV病毒和CD4细胞相互识别融合后将自己的RNA注入宿主细胞,随后病毒RNA在逆转录酶的作用下逆转录(Reverse Transcription)成DNA,经逆转录而来的病毒DNA可以顺利进入宿主细胞的细胞核,还能在整合酶(Integrase)的作用下,“堂而皇之”将自己整合到宿主细胞的DNA当中,成为宿主细胞的一部分。HIV病毒的遗传物质就这样成功伪装进宿主细胞基因组,接着就可以顺理成章地利用宿主细胞的转录机制,来转录各种病毒RNA,以及合成各种病毒蛋白,合成好的病毒RNA和病毒蛋白还要在宿主细胞内组装成熟,形成后代病毒颗粒的雏形,再经蛋白酶的修饰作用,最终成为有感染能力的完整的HIV病毒颗粒。[2]
图 2 艾滋病毒的复制周期示意图
三、治疗艾滋病的常见药物
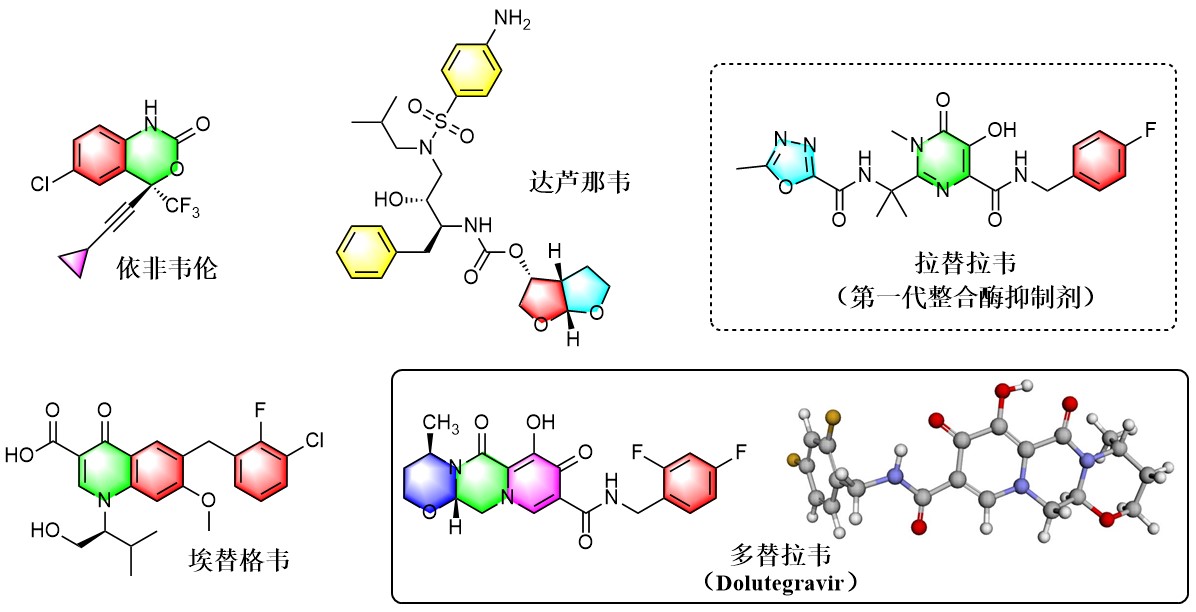
根据前文所述,艾滋药物的研发主要围绕如何阻断病毒复制展开,目前应用最广泛的药物是逆转录酶抑制剂和蛋白酶抑制剂,前者包括依非韦伦、利匹韦林、替诺福韦等,后者则包括达芦那韦、洛匹那韦等。尽管以这两类药物为主的治疗方案极大延长了HIV感染者的预期寿命和生存质量,但它们的弊端也非常明显:其一是毒副作用和不良反应多;其二是药物间的相互作用复杂,限制了感染者其他药物的使用;其三也是目前诸多药物存在的普遍问题——耐药性。鉴于此,一种新型的整合酶抑制剂类药物应运而生,改变了艾滋治疗现状。[3]
图 3 治疗艾滋病的常见药物
2013年经FDA批准,拉替拉韦(Raltegravir,商品名为艾生特)作为第一代整合酶抑制剂进入临床,治疗效果突出,不良反应和药物相互作用都较少。随后另外两个整合酶抑制剂药物埃替格韦(Elvitegravir)和多替拉韦(Dolutegravir)被批准上市,后续研究表明多替拉韦更不易产生耐药性。因此,包括美国在内的许多医疗资源丰富的发达国家越来越愿意推荐使用含整合酶抑制剂的治疗方案作为一线抗病毒药物。2019年7月,世卫组织更是强烈建议将多替拉韦作为艾滋病首选治疗方案。[4]
四、多替拉韦的合成
多替拉韦是由葛兰素史克公司开发的用于治疗艾滋病的首选一线和二线药物,包括孕妇和有生育能力的妇女。从化学角度来看,它是一类高度官能团化的吡啶酮(pyridone)结构衍生物,如何高效合成这类母核结构无疑为后续相关药物研发提供重要参考。2018年,T. D. Roper和T. F. Jamison等人报道了利用流动化学(Flow Chemistry)的方法7步合成了多替拉韦,总产率24%,流动化学提供了一种新颖的合成策略。[5]
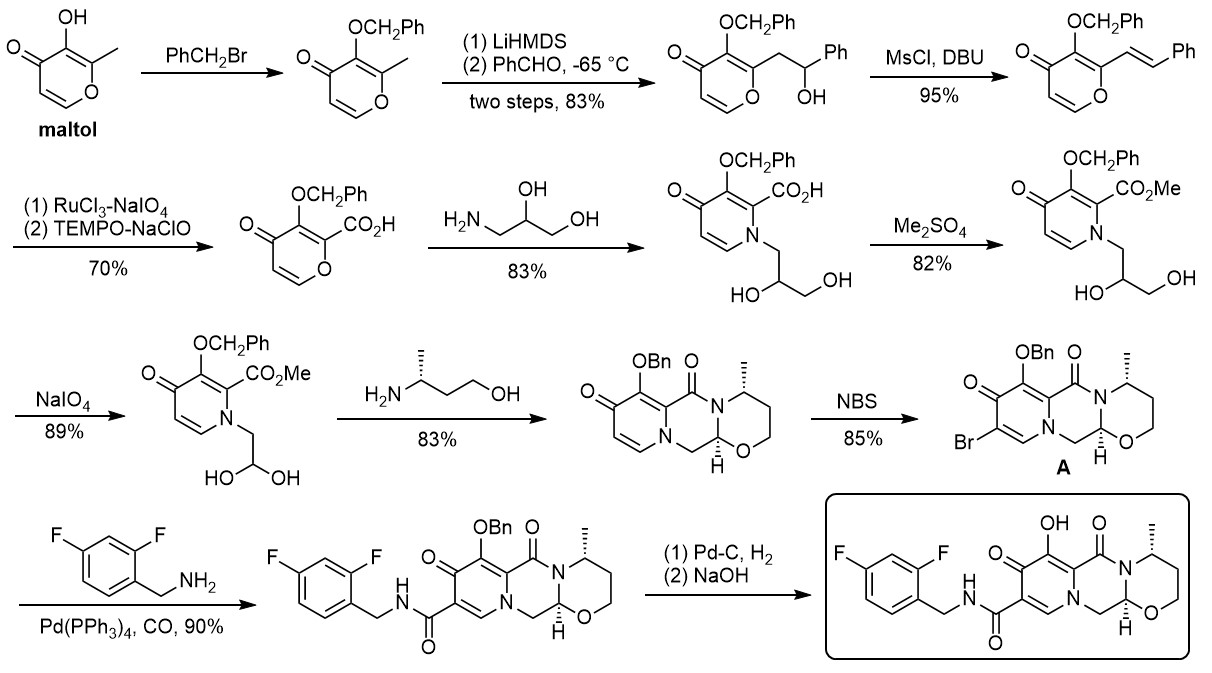
2019年,日本科学家T. Yasukata等人报道了另一种简单的合成方法。他们以简单的麦芽酚(maltol)为起始原料,经亲核取代、消去、氧化、酯化等近十步反应合成了复杂的吡啶酮母核中间体A,随后经“插羰偶联”成功将氟代苄胺引入母核,催化加氢脱苄基保护即可获得最终产物。尽管路线稍显冗长,但由于每步的产率都很理想且原料廉价易得,更适用于大规模生产,因此也不矢为一种优秀的合成路线。[6]
图 4 多替拉韦的代表性合成路线
五、结束语
现如今,随着现代医学技术的不断突飞猛进,越来越多的疾病被人类克服。这一过程中,人们对艾滋病毒的致病机制、传播方式、预防、诊断以及治疗等都有了更加清楚的认识,也有越来越多的药物投入临床使用,在人类与病毒的不懈斗争中发挥了巨大作用。然而,我们还是要清楚地意识到,目前全球范围内“抗艾”形势都十分严峻,多替拉韦这样的药物还远不能治愈艾滋病,更不能让我们过于乐观。我们应当坚信,随着科学技术的不断日新月异,终有一日人类会在这场漫长战斗中取得胜利!
参考资料
- [1] 重要事实. 世界卫生组织.
- [2] 维基百科:https://en.wikipedia.org/wiki/HIV
- [3] 罗丽娟, 黄璐, and 张玉芹. “HIV 整合酶抑制剂药物研究与应用.” 中国新药与临床杂志 2014, 33, 481-484.
- [4] 联合国新闻:https://news.un.org/zh/story/2019/07/1038571
- [5] T. D. Roper, and T. F. Jamison. et al. “7‐Step Flow Synthesis of the HIV Integrase Inhibitor Dolutegravir.” Angew. Chem. Int. Ed. 2018, 57, 7181-7185. DOI: 10.1002/anie.201802256
- [6] Y. Tatsuro, et al. “Practical Synthetic Method for the Preparation of Pyrone Diesters: An Efficient Synthetic Route for the Synthesis of Dolutegravir Sodium.” Org. Process Res. Dev. 2019, 23, 565-570. DOI: 10.1021/acs.oprd.8b00410
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.