作者:杉杉
导读:
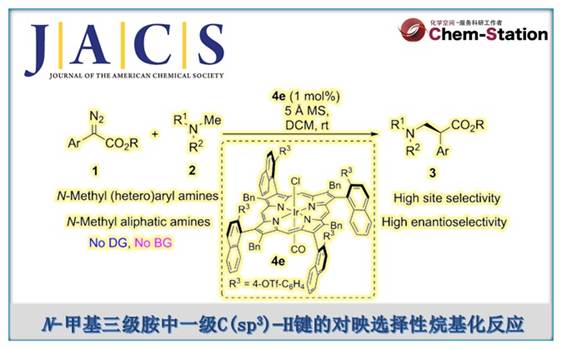
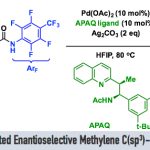
近日,同济大学的赵晓明等课题组在J. Am. Chem. Soc.中发表论文,报道一种轴手性β-芳基铱卟啉配合物催化N-甲基三级胺中一级C(sp3)−H键与重氮化合物的对映选择性烷基化反应,合成了一系列β-手性三级胺,具有优异的对映选择性。值得注意的是,该策略成功应用于手性荷包牡丹碱(bicuculline)的后期修饰,具有高度的非对映选择性。此外,通过氘代实验与HRMS分析鉴定的阳离子铱配合物,并提出了一种合理的反应机理。
Enantioselective Alkylation of Primary C(sp3)−H Bonds in N‑Methyl Tertiary Amine Enabled by Iridium Complex of Axially Chiral β‑Aryl Porphyrins
S. Yuan, S. Li, X. Zhao, Y. Lin, S. Zheng, J. Am. Chem. Soc. 2024, ASAP. doi: 10.1021/jacs.4c12449.
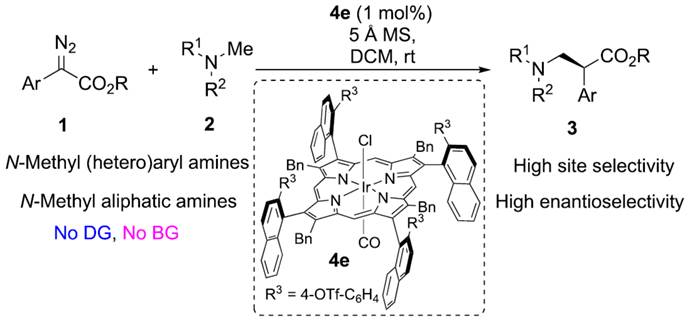
正文:
三级胺广泛存在于各类药物、生物碱天然产物、功能材料、配体与催化剂等中。其中,胺类化合物的直接C-H官能团化是合成三级胺的一种有效的方法。迄今为止,三级胺的直接α-烷基化经历了快速增长[1]。在这些方法中,金属催化三级胺中C(sp3)−H键与卡宾前体的烷基化备受关注[2],特别是在不对称合成中的应用。然而,此类反应仍然存在两个主要挑战(Scheme 1a):1)通过胺对卡宾中心的亲核攻击形成N-叶立德的竞争反应可能会进行,特别是对于脂肪族三级胺,这使得C-H活化难以实现;2)不同类型的C-H键,如一级、二级C(sp3)−H键或C(sp2)−H键,可能会造成选择性问题。为了应对这些挑战,开发能够微妙地区分不同类型C-H键之间能障的新型催化剂是非常可取的。
1999年,Davies与Winkler课题组分别报道了在二铑配合物存在下,环胺与卡宾的不对称C-H官能团化反应。在他们的开创性研究中,必须使用N-Boc保护策略使两种胺失活,以应对叶立德形成的挑战。2002年,Davies课题组[3]发现,即使在电子上更有利的烯丙基位点上(R1 = allyl, Scheme 1b),空间要求高的二铑配合物也会导致N-Me C-H插入选择性。然而,N-Boc保护策略仍然是必要的,并且不同的取代严重影响反应的对映选择性。此外,胺中氮上的α-位芳基也可用于N-失活,伴随着竞争性的C(sp2)−H键活化,这需要使用附近的保护基团或大体积基团来避免不必要的反应(Scheme 1c)。最近,赵晓明课题组[4]报道了一种新设计的C4-对称β-轴向手性卟啉(Por*),并成功应用于铱催化1,4-己二烯的C-H烷基化反应中。近日,同济大学的赵晓明等课题组报道一种β-轴手性铱卟啉配合物催化N-甲基三级胺中一级C(sp3)−H键与重氮化合物的高度位点选择性与对映选择性烷基化反应,合成了一系列β-手性三级胺(Scheme 1d)。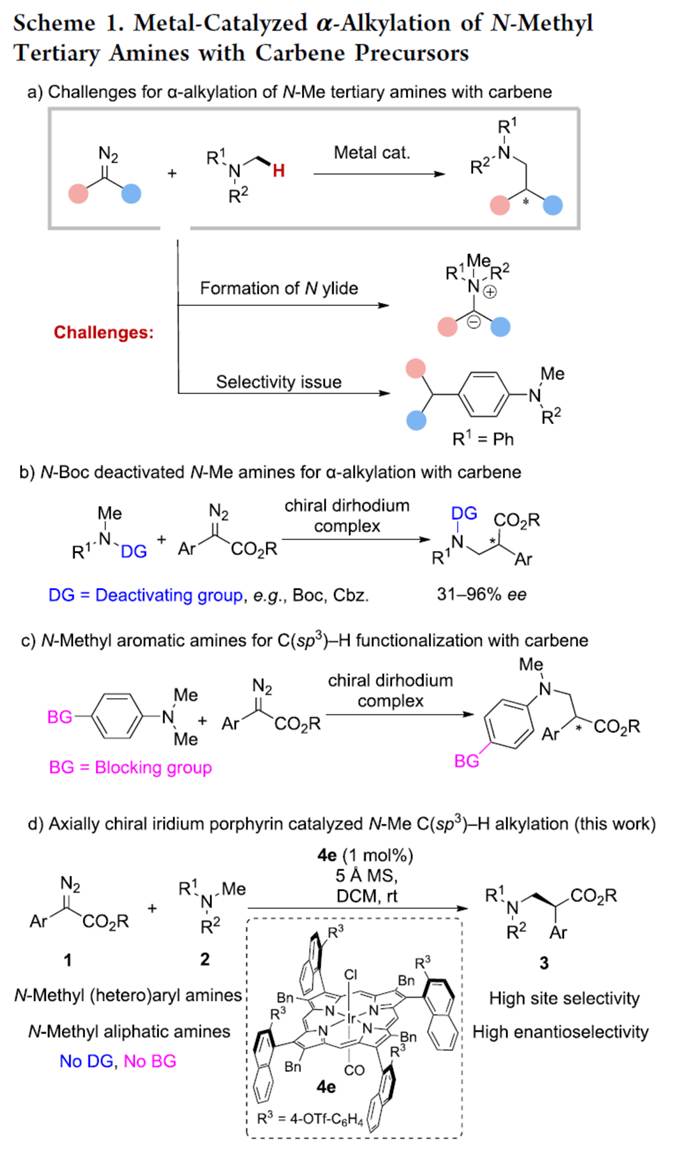
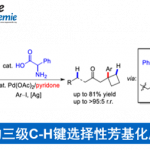
首先,作者采用重氮乙酸酯衍生物1a与N,N-二甲基苯胺2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用1aa作为底物,4e作为催化剂,5Å MS作为添加剂,在DCM反应溶剂中,反应温度为室温,最终获得92%收率的产物3aaa(94% ee)。其中,使用轴向手性铱卟啉Ir(Por*)(CO)(Cl)可以有效地控制位点选择性与对映体选择性。当使用其他重氮乙酸酯1ab–1ad时,对映选择性急剧下降。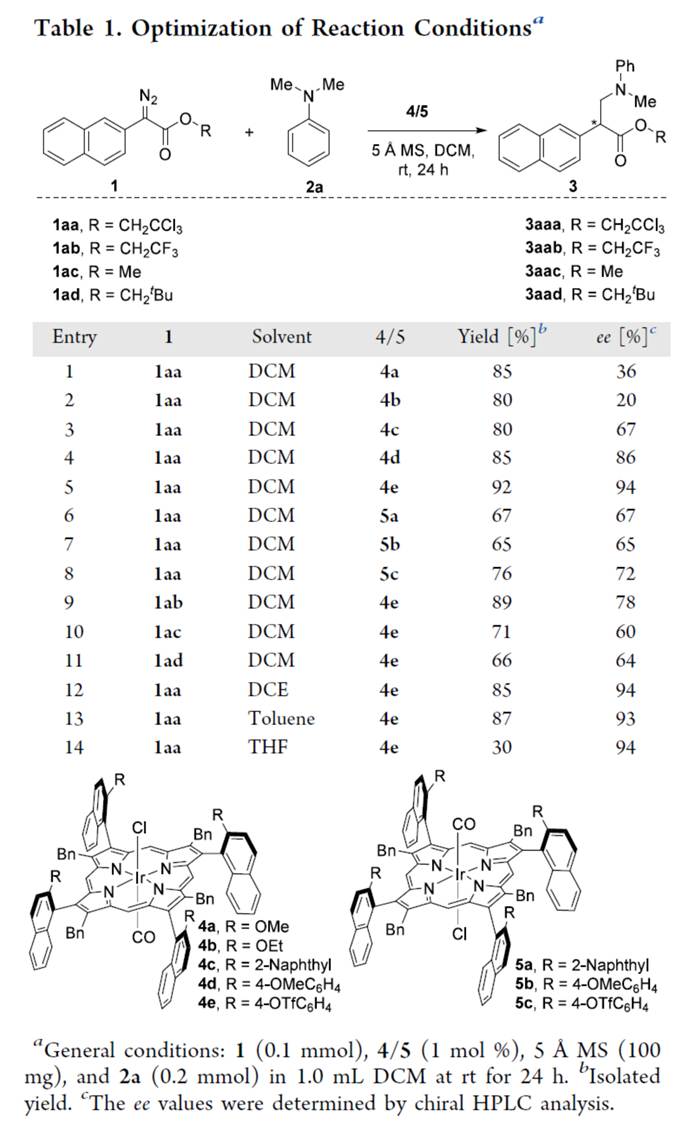
在上述的最佳反应条件下,作者对一系列重氮底物(1)的应用范围进行深入研究(Scheme 2)。研究结果表明,当重氮底物中含有不同电性取代的芳基时,均可顺利进行反应,获得相应的产物3ab–3at,收率为87-99%,ee为87-95%。值得注意的是,一系列活性的基团,如卤素、烷氧羰基、硼基、炔基等,均与体系兼容。同时,含有芴基与杂环取代的重氮酯,也是合适的底物,获得相应的产物3au–3ay,收率为87-96%,ee为90-95%。
随后,作者对N-甲基三级胺(2)的应用范围进行深入研究(Scheme 3)。首先,当底物N,N-二甲基苯胺的芳基上含有不同电性取代基时,均可顺利进行反应,获得相应的产物3ba–3bk,收率为60-98%,ee为87-95%。其次,非对称的N-甲基-N-烷基芳基胺,也是合适的底物,获得相应的产物3bl–3bn,收率为85-90%,ee为95-96%,具有优异的对映选择性。值得注意的是,对于活性的二级苄基或烯丙基C(sp3)−H键在反应中是惰性的,而一级C(sp3)−H对C(sp2)−H烷基化产物的选择性为10/1(3bl/3bl′−3bn/3bn′)。这种特殊的选择性表现出空间要求高的轴手性铱卟啉的优点。此外,N-甲基四氢喹啉、吲哚啉衍生物与N-甲基杂芳胺,也可顺利进行反应,获得相应的产物3bo–3br,收率为70-94%,ee为88-96%。N-甲基烷基三级胺底物,也是合适的底物,获得相应的产物3bs-3bu,收率为60-94%,ee为93-98%。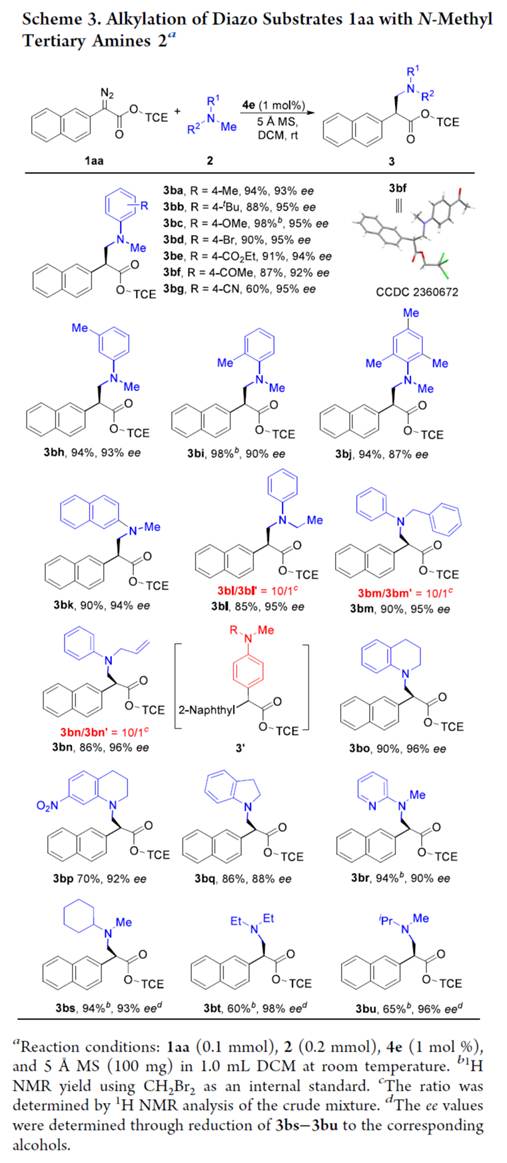
此外,该策略还可用于N-甲基生物碱天然产物的后修饰,如荷包牡丹碱(Scheme 4)。当使用外消旋铱卟啉催化剂时,反应进行顺利,得到3bv与3bw的非对映体混合物,总收率为76%,dr为2/1。在手性催化剂4e的存在下,可以77%的收率得到产物3bv,具有高度的非对映选择性(dr > 20/1)。相比之下,当使用催化剂4e(ent–4e)的对映异构体时,可以76%的收率得到产物3bw,具有同样高度的非对映选择性。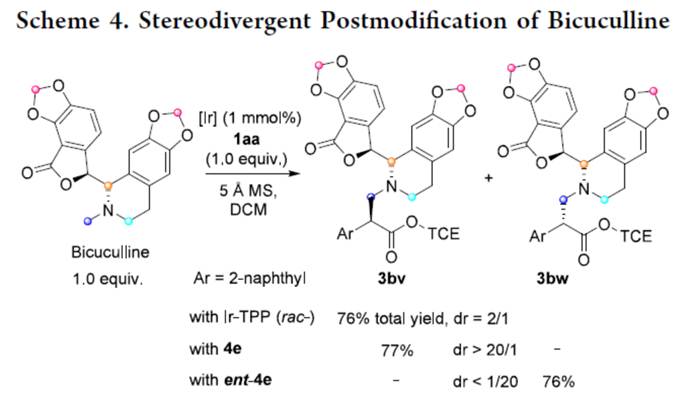
同时,1aa与2d的克级规模实验,同样可以90%的收率得到产物3bd,ee为95% (Scheme 5a)。并且,3bd通过进一步的还原,可以95%的收率得到相应的氨基醇化合物6,ee为95%。化合物6通过进一步的衍生化,可获得具有价值的手性1,3-oxazinanes(7),收率为95%,ee为94% (Scheme 5b)。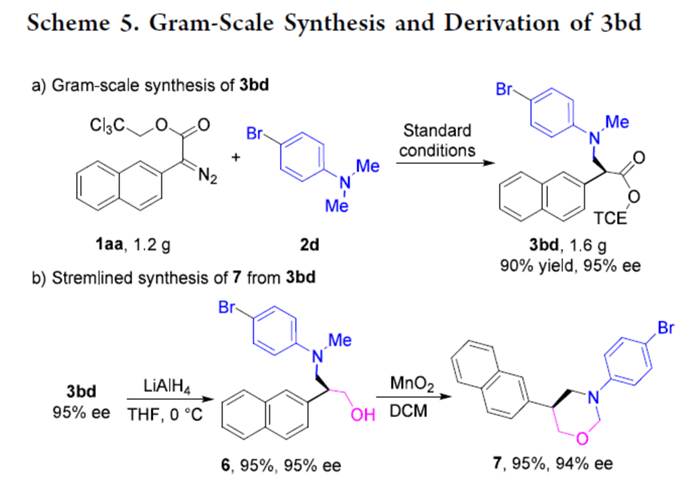
接下来,作者对上述对映选择性烷基化过程的反应机理进行进一步研究 (Scheme 6)。氘代实验结果表明,卡宾插入C(sp3)−H键可能是一个协同过程(Scheme 6a与Scheme 6b)。KIE实验结果表明,C(sp3)−H活化是反应的速率决定步骤(Scheme 6c)。HRMS分析表明,反应形成了一种新型的铱卟啉配合物(4e′),其是一种阳离子铱配合物,也是实际的催化剂(Scheme 6d)。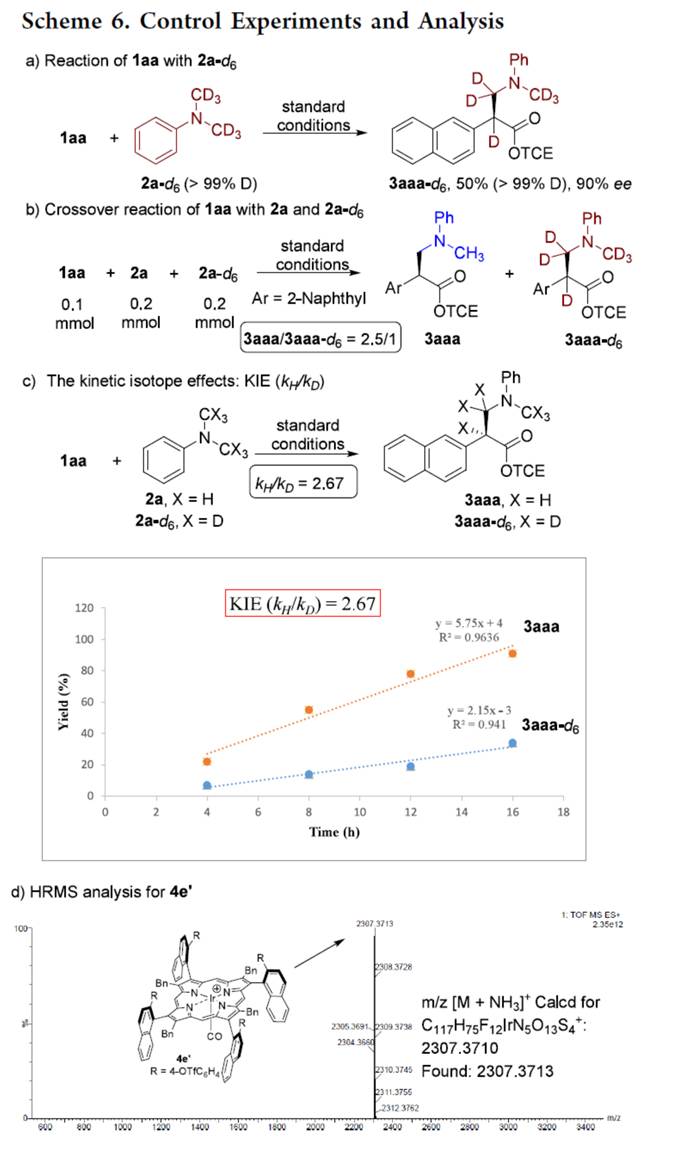
基于上述的实验研究以及前期相关的文献报道[1],作者提出如下合理的反应机理 (Scheme 7)。首先,重氮乙酸酯1与预催化剂Ir(Por*)(CO)(Cl) 4/5中的Cl配体之间发生配体交换,通过N2的释放,生成铱卡宾中间体Int A。其次,在形成的卡宾中间体的情况下,α-N一级C-H发生活化,生成过渡态Int B。最后,从α-N一级C-H键到手性中心的协同氢转移,以及阳离子铱催化剂的分离,从而生成目标的手性三级胺产物3,并完成催化循环的过程。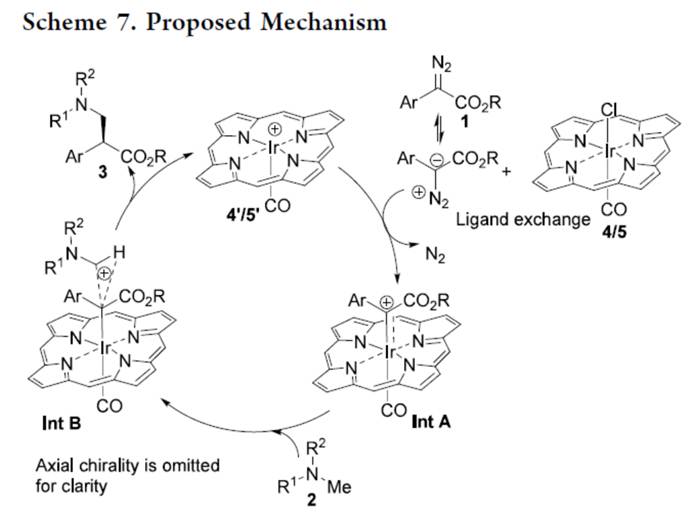
总结:
同济大学的赵晓明等课题组报道一种轴手性铱卟啉配合物催化N-甲基三级胺中一级C(sp3)−H键与重氮化合物的高度位点选择性与对映选择性烷基化反应,合成了一系列β-手性三级胺。同时,该策略具有收率高、底物范围广泛、优良的官能团兼容性以及优良的对映选择性等优势。其次,通过对手性荷包牡丹碱的后期修饰,进一步证明了反应的实用性。
参考文献:
[1] J. Zhang, C. Liu, J. Wu, X. Tan, W. Wu, H. Jiang, Org. Lett. 2024, 26, 4422. doi:10.1021/acs.orglett.4c00880. [2] H. M. L. Davies, R. E. J. Beckwith, Chem. Rev. 2003, 103, 2861. doi:10.1021/cr0200217. [3] H. M. L. Davies, C. Venkataramani, Angew. Chem., Int. Ed. 2002, 41, 2197. doi:10.1002/1521-3773(20020617)41:12<2197::AID-ANIE2197>3.0.CO;2-N. [4] S. Yuan, J. Sun, X. Zhao, J. Zhu, S. Zheng, Angew. Chem., Int. Ed. 2024, 63, No. e202404329. doi:10.1002/anie.202404329.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
关注Chem-Station抖音号:79473891841


















No comments yet.