本问来自日文版,https://www.chem-station.com/blog/2018/01/p-clamp.html
翻译投稿Suming
在2016年,麻省理工学院的Bradley L. Pentelute及其同事,成功的开发出了一种通过将π钳序列 (Phe-Cys-Pro-Phe) 引入肽和蛋白质中,从而达到可以只选择性的修饰其序列中符合条件的半胱氨酸残基的方法。
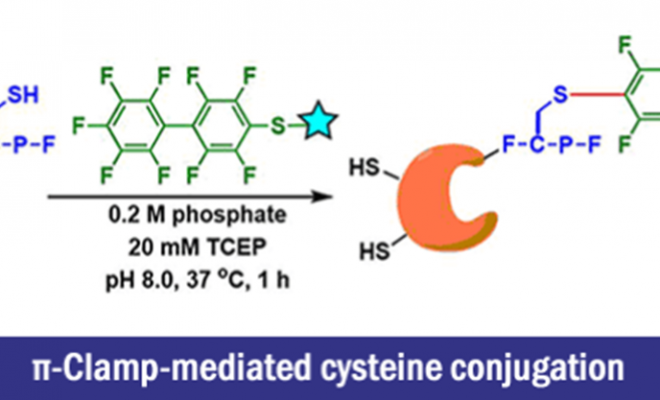
π-Clamp-mediated cysteine conjugation
Zhang, C.;Welborn, M.; Zhu, T.; Yang, N. J.; Santos, M. S.; Voorhis, T. V.; Pentelute, B. L.*
Nat. Chem. 2016, 8, 120–128. doi:10.1038/nchem.2413
现存问题
以往,选择性修饰蛋白质区域一般只能通过使用与其他官能团反应活性低的反应试剂或在有需要的特定位置使用催化剂来促进反应来达成选择性修饰的目的。
在选择性修饰半胱氨酸(Cys)残基的过程中,是可以使用马来酰亚胺的ligation或烷基化的,但这些方法的局限性在于它们都不能实现位置选择性修饰。
鉴于蛋白质是通过自身的三维结构来调节其交互和特定反应的特征,由此我们得到了一个使用特定的序列来加速这个反应的想法,于是我们研发出了一种新的方法。
技术和方法
Pentelute团队发现,全氟芳基与半胱氨酸(Cys)之间的芳香族亲核取代反应可以在有机溶剂中进行,但其在水中的反应速率却非常缓慢。
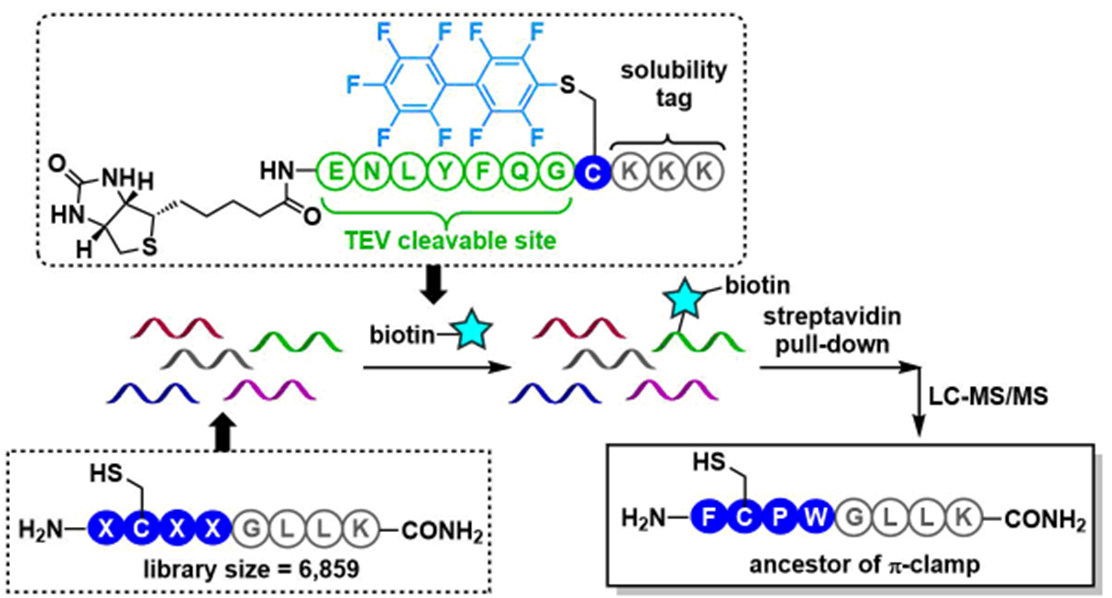
因此,在序列为Xaa-Cys-Xaa-Xaa-Gly-Leu-Leu-Lys(Xaa为任意的氨基酸)的肽库中,加入生物素-全氟芳基探针(即加入TEV蛋白酶中以切段可以分割的序列),再应用使用了链霉亲和素的下拉法后,可以鉴定出含有Phe-Cys-Pro-Trp序列的肽会优先反应。
接着我们使用由9个残基组成的肽作底物进行的反应来作进一步的检验显示:当Xaa都是Phe时可以获得一个比较理想的产率,而当Xaa中的任一个从Phe变为Gly或者当Pro变成D-Pro时,产率便会有一个显著的下降。
至此,我们终于成功地找到了一个叫做π-钳(Phe-Cys-Pro-Phe)的特殊序列。
设想的有效性验证
我们经过了以下的实验可以证明:在含有多个半胱氨酸(Cys)残基的肽或蛋白质中,只有那些包含了“π-钳”序列的半胱氨酸(Cys)残基才能被选择性的全氟化
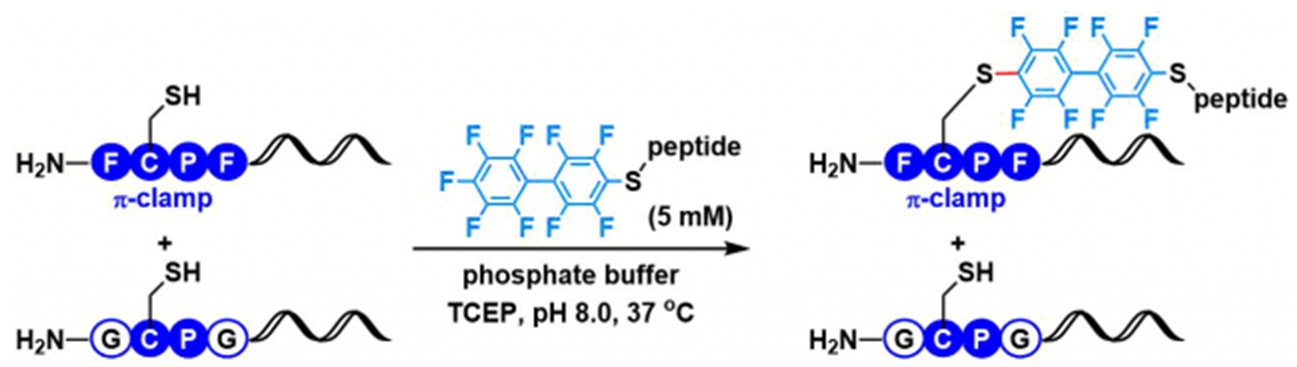
1、竞争实验
对于含有“π-钳”序列的肽来说,当其一部分的“π-钳”产生了gly突变后再在存在竞争的条件下进行反应时,会只选择那些含有“π-钳”序列的肽进行定量的反应。
2、关于肽的选择性确认实验
Pentelute等人选择在那些在N的末端具有半胱氨酸(Cys)同时在C的末端具有“π-钳”序列,并且可以被TEV蛋白酶切割开的蛋白质作为模型进行研究。结果证实只有那些含有“π-钳”的半胱氨酸(Cys)被选择性地修饰了。
3、验证其他蛋白质
在对N端引入了“π-钳”序列的分选酶A应用本反应时我们发现:虽然它含有多个半胱氨酸,但是实验显示只有一部分含有”π-钳”序列被修饰,并且酶的活性也没有降低。
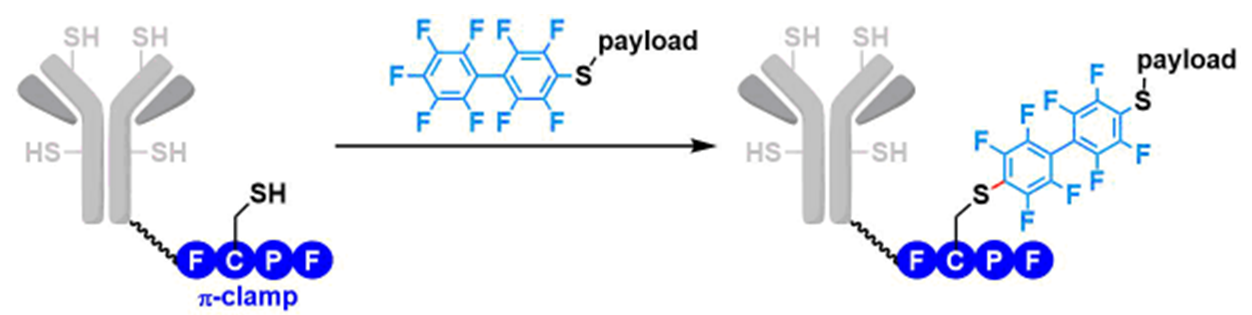
此外,它也可以应用于抗体上,以用来生产抗体药物偶联物(ADC),不过因为ADC是以一种多项混合物的形式呈现的,所以把半胱氨酸(Cys)作为目标位置的特定性修饰在现有的条件下还不能完成。
他们将“π-钳”导入到曲妥珠单抗和西妥昔单抗后,成功的选择性修饰了含有“π-钳”的抗体。而且修饰后抗体的抗原结合能力没有产生太大的改变,对于抗原递呈细胞的结合活性也保持了一个相当的水准。
4、关于“π-钳”的化学结构和反应机制的设想
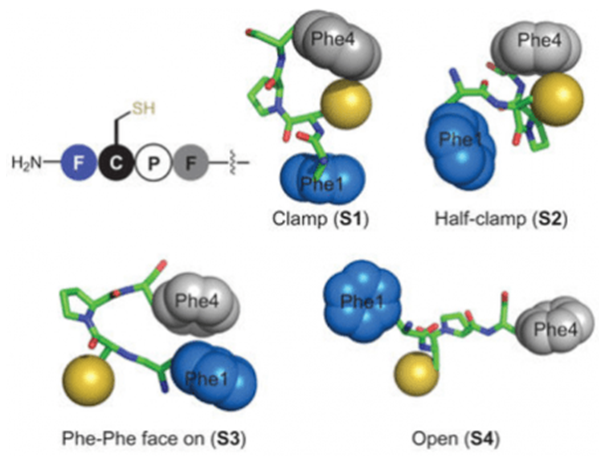
通过利用分子动力学计算(MD)的肽结构(构象)分析和利用密度泛函理论(DFT)的反应能量分析后,我们可以取得如下面的这四张图(Clamp, Half-Clamp, Phe-Phe face on, Open) 所示的“π-钳”的主要结构的示意图
(引用自开题论文)
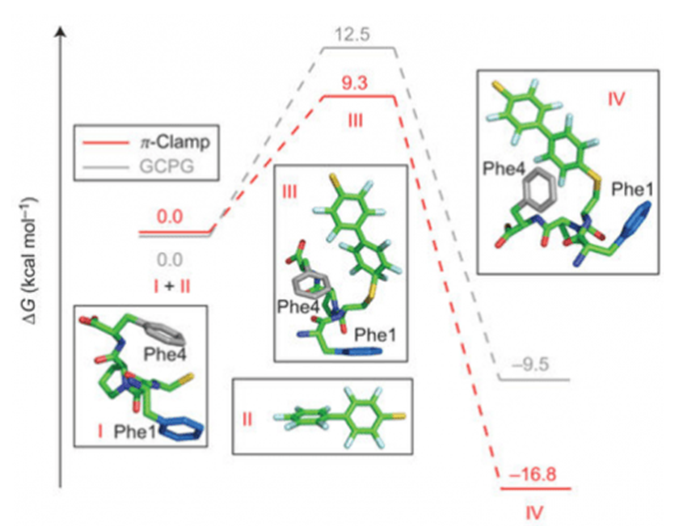
在这个反应中,采用了夹钳结构的情况下,芳基化产物的能量和过渡态的能量会变得特别低,这变得对我们很有利。依据推测我们认为这是因为Phe的芳香环侧链识别了全氟芳基,然后激活了半胱氨酸(Cys)的硫原子,此外,在这个分析中我们还发现”π-钳”序列中第四位的Phe在对于进行芳基化的过程中有着特别重要的作用。
(引用自开题论文)本课题的要点
当”π-钳”序列的位置在肽的氨基酸序列的C端,N端和中间的任合位置都可以取得非常理想的产率。另外,通过引入一个”π-钳”来避开蛋白质的活性中心能够对任意位置进行修饰反应,所以其应用范围也很广。
以不改变蛋白质性质和功能作为限制条件(温度,pH等),让”π钳”能够有效工作的条件是否有限制?
接下来应该阅读的论文有哪些?
1、Pentelute本人已经发表过了一篇针对”π-钳法”进行详细机理分析的后续报告。
2、据称,取得”π-钳”pro的反式构象对于全氟芳基的捕捉功能非常重要,产物中的Phe侧链与全氟芳基会有相互作用。
3、从这些研究中我们可以发现,对于下列含有”π-钳”序列变体的肽可以达到85倍的加速反应效应。我们认为,因为α-Me-Pr的反式构象是固定的,所以”π-π”与芘基的相互作用显得非常重要的。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.