作者:石油醚
导 读
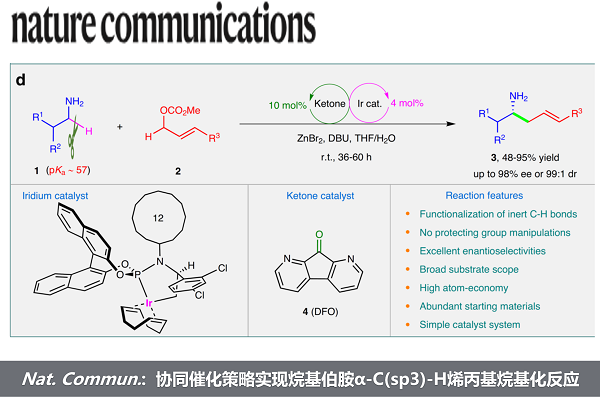
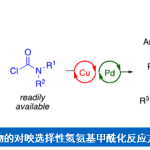
近日,上海师范大学赵宝国教授和陈剑锋副研究员团队基于羰基催化与过渡金属协同催化策略,利用1,8-二氮-9-芴酮作为羰基催化剂,在NH2基团未保护的情况下,实现了烷基伯胺α-C(sp3)-H的直接烯丙基烷基化反应,在温和条件下高效制备了优异对映选择性的手性高烯丙基胺化合物,文章发表于Nature Communications上
“Asymmetric α-C(sp3)–H allylic alkylation of primary alkylamines by synergistic Ir/ketone catalysis
Jianyu Li, Sheng Gong, Shaolun Gao, jianfeng Chen*, Wen-Wen Chen & Baoguo Zhao*
Nat. Commun., 2024, 15, 939, doi: 10.1038/s41467-024-45131-3”
正文:
手性胺广泛存在于各类天然产物、生物活性分子、药物、材料和催化剂中,发展高效的手性胺的制备策略具有重要的意义。上海师范大学赵宝国教授课题组长期从事羰基催化未保护伯胺α位C-H键的不对称官能化反应的研究(Acc. Chem. Res. 2023, 56, 1097-1117),近年来陆续实现了氨基酸酯与膦酰亚胺的仿生Mannich反应,与三氟甲基酮的仿生Aldol反应,与α、β不饱和酯的不对称Michael加成反应,与MBH醋酸酯的不对称烯丙基化反应以及与卤代烷的SN2亲核取代反应等。同时,课题组不仅着眼于氨基酸酯类底物的反应,也对更难活化的惰性伯胺发起挑战,并取得了阶段性的成果,实现了苄胺与芳香醛以及炔丙基胺与三氟甲基酮的反应,制备了丰富多样的手性氨基醇类化合物。相比于苄胺(pKa ~42.5)和炔丙基胺(pKa ~42.6),普通的烷基伯胺的α-C(sp3)-H键的pKa约为57,酸性更弱,想要实现该类底物惰性C-H键的直接官能化反应仍颇具挑战。
烷基伯胺具有很强的亲核性,极易与活性的亲电试剂发生反应,导致N-亲核反应的发生。传统的烷基伯胺α位的官能化反应,需要将NH2基团进行保护,以免对反应产生干扰。相比之下,烷基伯胺α位惰性C-H键的直接官能化反应无需保护基的引入与去除,具有良好的原子经济性和步骤经济性。
近日,上海师范大学赵宝国教授和陈剑锋副研究员团队以1,8-二氮-9-芴酮作为羰基催化剂,突破了烷基伯胺的α C-H键的反应惰性,无需对NH2基团进行保护,联合过渡金属铱的协同催化策略,在温和条件下便可实现烷基伯胺α位的烯丙基烷基化反应,高效的构建了重要化合物手性高烯丙基胺,相关成果发表于Nature Communications上,第一作者为李健羽博士,通讯作者为赵宝国教授和陈剑锋副研究员。
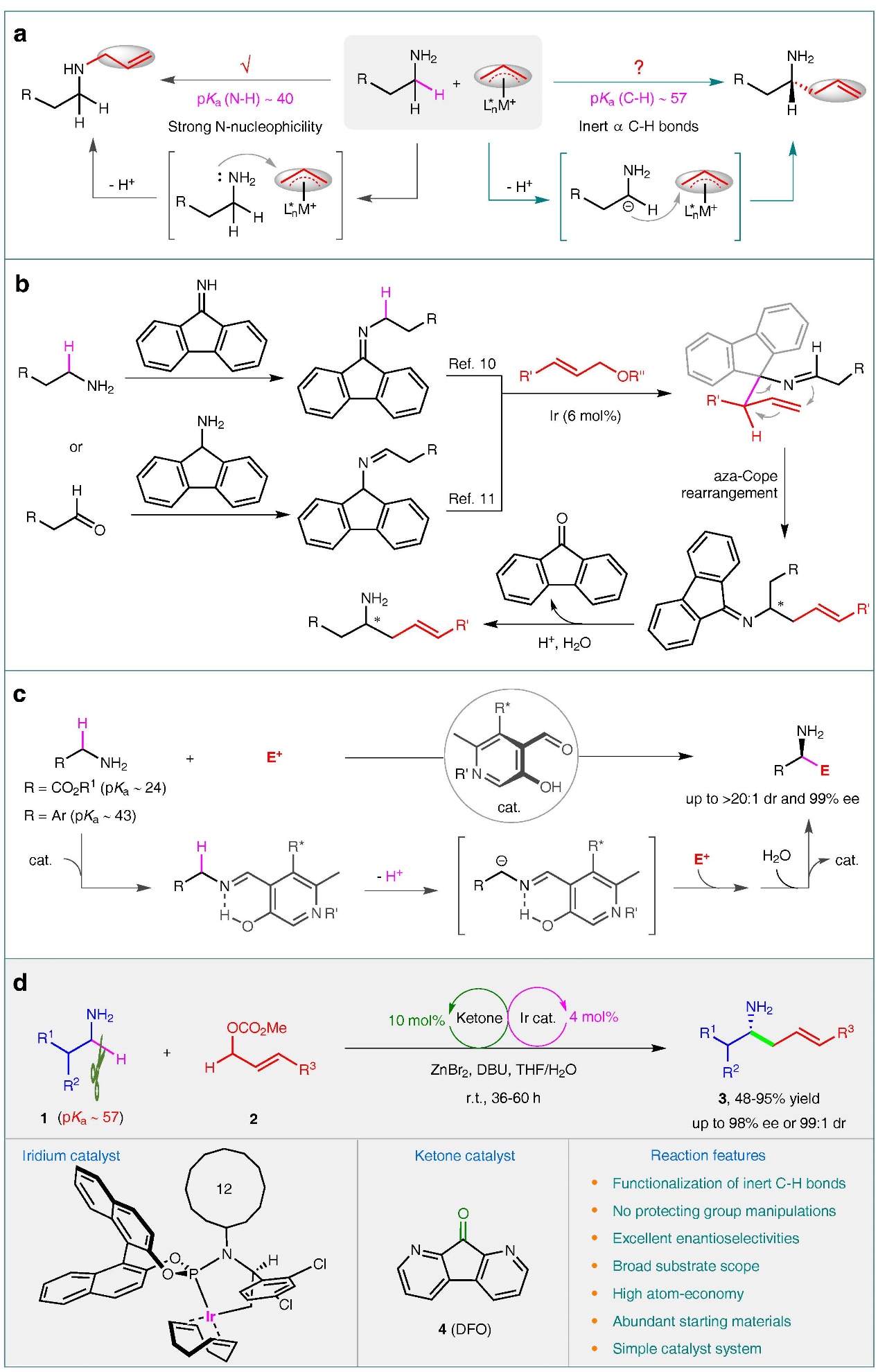
图1. 伯胺α C-H键的官能化反应。图片来源: Nat. Commun.
首先,作者通过对不同电子性质的羰基催化剂进行筛选,发现1,8-二氮-9-芴酮(DFO)具有很高的反应活性,可以以87%的收率获得直链的烯丙基烷基化产物3a。DFO较高的反应活性可能得益于其14 π-电子体系具有很强的吸电子特性。紧接着又对反应使用的过渡金属催化剂和配体进行了筛选,最终选定了Ir(COD)2BF4和亚磷酰胺配体(R,Ra)-L6为最佳的组合,可以获得95%的收率和97%的ee值。该反应在没有DFO的情况下,会发生经典的烯丙基胺化反应。同时,在溶剂中加入少量的水对于提高反应的效率至关重要,这可能是因为水可以促进亚胺的水解从而加速了烷基化产物3a的释放和羰基催化剂DFO的再生。在不加入ZnBr2的情况下,也只会发生经典的烯丙基胺化反应。作者认为ZnBr2作为一种Lewis酸,可以促进烷基胺1a与羰基催化剂DFO生成亚胺启动反应,同时也可能通过与NH2基团配位,降低了其发生N-亲核反应的能力。
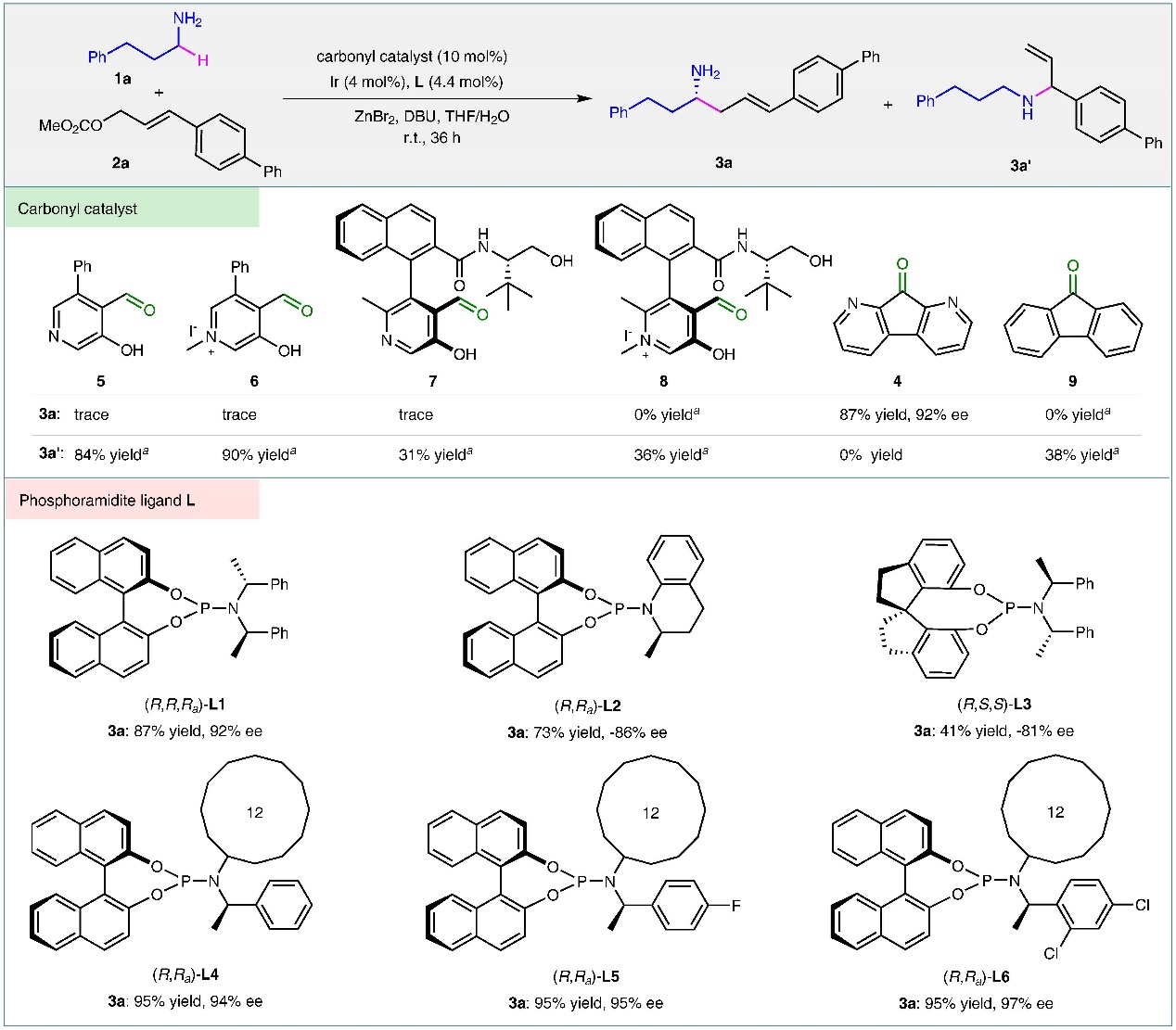
图2. 催化剂筛选。图片来源: Nat. Commun.
在最优条件下,作者对底物范围进行了考察,结果显示各类芳基烯丙基碳酸酯和碳酸二烯酯均能顺利反应,以中等到较高的收率(48-95%)和高对映选择性(80-97% ee)生成α取代的手性胺3a-t。由于烷基烯丙基碳酸酯无法在体系中完成所需要的2-氮杂-Cope重排过程,所以无法进行反应。该反应在含各类官能团的伯烷基胺中也表现出了良好的活性(50-87%收率)和优异的对映选择性(91-98% ee)。底物的范围可以拓宽到手性底物,并同样获得较好的结果。令人印象深刻的是,对于含有一个或两个酸性更强的O-H基团的氨基醇(3ah-aj、3ap-ar和3ba),烷基化仍然能发生在高惰性的α-C-H键上。
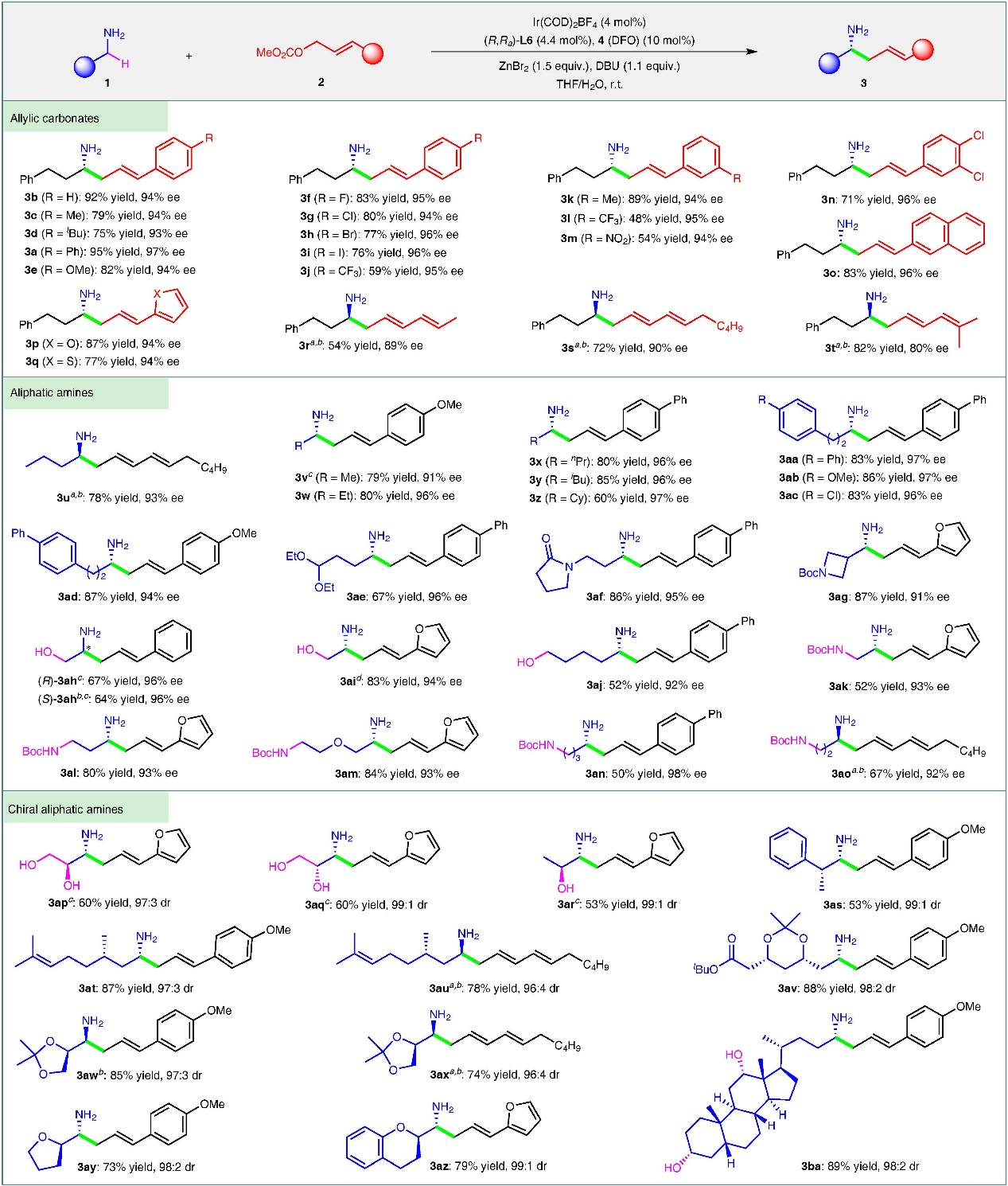
图3. 底物拓展。图片来源: Nat. Commun.
接下来,作者对反应的合成应用进行了研究,首先可以通过克级规模的反应合成高烯丙基胺化合物3w,并能分别完成氢化还原,I2促进的环化反应以及Sharpless双羟化反应,获得良好的收率。合成的高烯丙基胺化合物3s和(S)-3ah也可以通过简单的转化分别制备具有生物活性的手性双环化合物14和潜在抗阿尔兹海默症分子17。
最后,作者对反应机理进行了探究。通过计算发现,正丁胺与DFO形成的亚胺18c的α-C(sp3)-H与正丁胺相比,pKa从57降至了12.5,提升了约1044倍,这使得18c可以轻易的发生去质子化得到氮杂烯丙基负离子19。通过计算Fukui指数,作者发现,19c的α'具有比α位更强的亲核性,所以作者推测反应是由亚胺去质子化后形成的离域的氮杂烯丙基负离子19与过渡金属铱产生的络合物24途径中间态20得到化合物21,随后发生了2-氮杂-Cope重排以及水解过程,最终得到了直链的高烯丙基胺化合物3并释放了羰基催化剂4。通过氘代实验测得KIE值为6.7,作者认为反应的决速步为亚胺的去质子化过程。
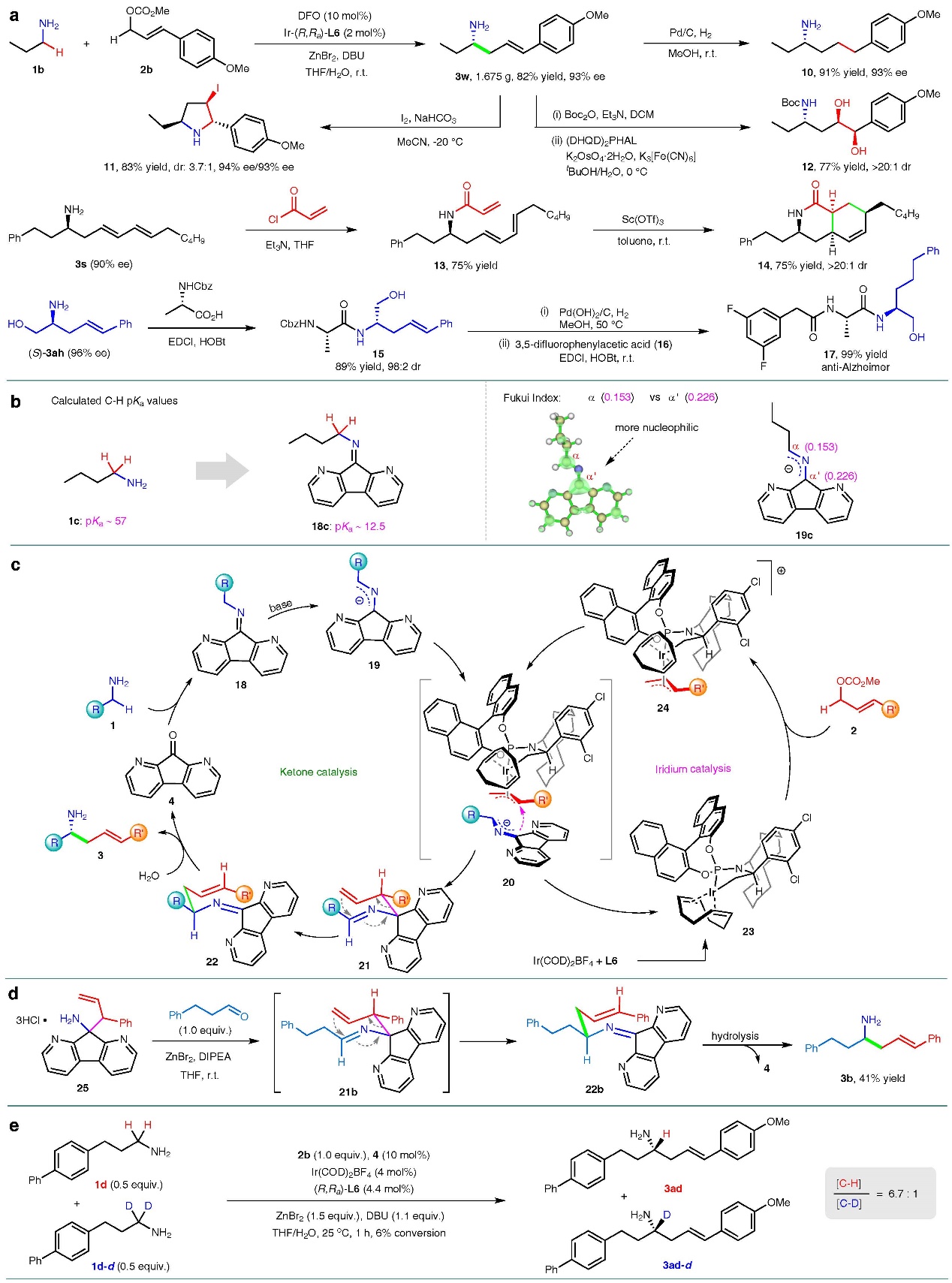
图4. 合成应用与机理研究。图片来源: Nat. Commun.
综上,赵宝国课题组基于羰基催化与过渡金属联合催化的策略,利用1,8-二氮-9-芴酮作为羰基催化剂活化了惰性的烷基伯胺α-C-H键,成功地实现了未保护烷基伯胺与烯丙基碳酸酯的不对称烯丙基烷基化反应,以良好的收率和优异的对映选择性,高效构建了一系列的手性高烯丙基胺化合物,条件温和,底物范围广,为羰基催化的发展和手性胺的合成提供了新的思路。
该工作得到了国家自然科学基金委、上海市教委、上海市科委、上海市仿生催化前沿科学研究基地、上海师范大学等的资金支持。
论文链接:https://doi.org/10.1038/s41467-024-45131-3
(赵宝国教授课题组供稿)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.



















No comments yet.