作者:苏打水
导读:
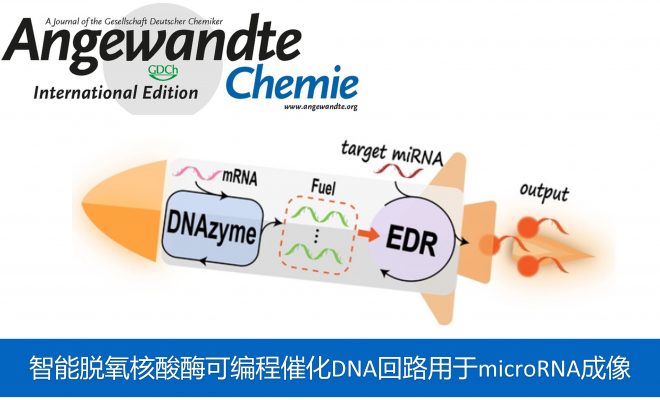
近日,武汉大学的王富安团队报道在Angew. Chem. Int. Ed.中发表论文,报道一种智能的脱氧核酸酶可编程催化DNA回路,实现了活体内高对比度的microRNA成像。
A Smart Deoxyribozyme-Programmable Catalytic DNA Circuit for High-Contrast MicroRNA Imaging
He, Y., Wang, Q., Hong, C., Li, R., Shang, J., Yu, S., Liu, X., Wang, F., Angew. Chem. Int. Ed. 2023, 62, e202307418. doi: 10.1002/anie.202307418
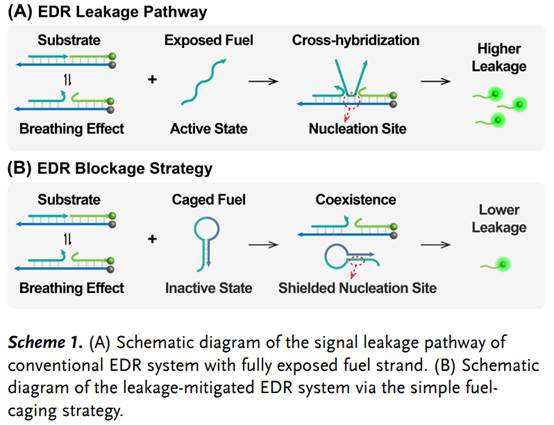
正文:
合成催化DNA回路已被公认为用于灵敏细胞内成像的信号放大工具,但其选择性和效率始终受到不受控制的场外信号泄漏和低效的现场电路激活的限制。因此,内源性可控的DNA回路现场暴露/激活对于实现活细胞的选择性成像是非常理想的。
这里,武汉大学王富安团队将内源性活化的DNA酶策略与催化DNA回路轻松整合,用于体内选择性和高效的microRNA成像。为了防止非特异性激活,团队人员将回路设计成笼状结构,限制其传感性能,再通过引入DNA酶选择性地释放连接靶点,以保证靶细胞中microRNA的高对比度成像(Scheme 1)。
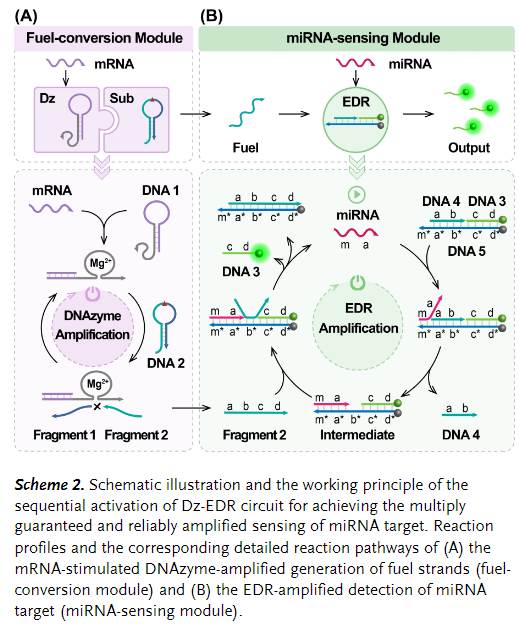
首先,作者通过使用10-23 DNAzyme作为燃料发生器,首次尝试了DNA酶驱动的EDR回路(以下简称Dz-EDR),用于活细胞和体内高准确度和高特异性的microRNA(miRNA)成像。双响应Dz-EDR系统由DNA酶介导的燃料转换模块和多功能miRNA感应EDR扩增模块(Scheme2)组成。在上游燃料转换模块中,建立了细胞特异性mRNA诱导DNA酶的构象转变以催化活性燃料链的产生等构机制。随后,丰富的燃料链驱动了 miRNA 靶标的 EDR 扩增检测[1]。
在燃料转换模块中,反应物发夹DNA 1由mRNA互补序列(紫色)和10-23DNA酶结构域(灰色)组成。没有激活剂TK1 mRNA(肿瘤细胞中特异性表达的肿瘤生长的重要指标),DNA酶部分被限制在发夹的茎区域,没有催化活性。在TK1 mRNA存在的情况下,DNA 1可以通过链置换反应被mRNA特异性激活,导致mRNA-DNA 1杂交体的形成以及DNA酶暴露于其Mg2+辅因子。然后活化的DNA酶可以与DNA 2的环结构域杂交,以催化rAU位点底物的持续切割[2]。结果,热力学不稳定的裂解产物自发解离成片段1和片段2,其中片段2(橄榄绿)作为燃料,为随后的 miRNA感应EDR模块中的熵驱动的链位移反应提供动力。
在miRNA传感模块中,靶microRNA-21(miR-21)的序列m-a与DNA 5的结构域m*-a*互补,因此靶标可以通过分支迁移反应与DNA 5杂交形成中间杂交。随后,新暴露的DNA 5的b*与片段2的结构域b结合形成亚稳结构,可以快速重排以释放miR-21用于回收靶标,并分解DNA 3以产生荧光输出信号。在整个过程中,miR-21作为催化剂,通过一系列分支迁移和熵驱动的反应过程触发EDR系统[3]。一旦 Dz-EDR 系统的传感功能被 TK1 mRNA 激活,通过 mRNA 活化的 DNAzyme 进行的连续切割反应就会产生大量的片段 2,用于通过产生显着放大的读出信号来持续激励 miR-21 触发的 EDR 模块。
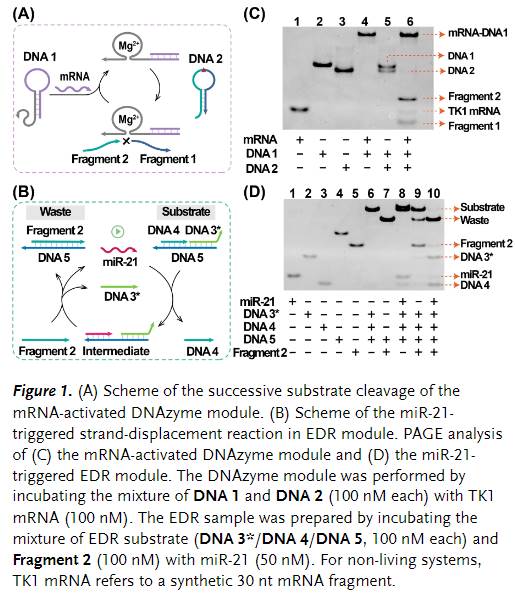
在优化发夹反应物(DNA 1和DNA 2)以在没有靶标的情况下消散潜在的信号泄漏以保持分析物的高信号增益后,作者系统地研究了Dz-EDR系统的工作原理(Figure 1)。
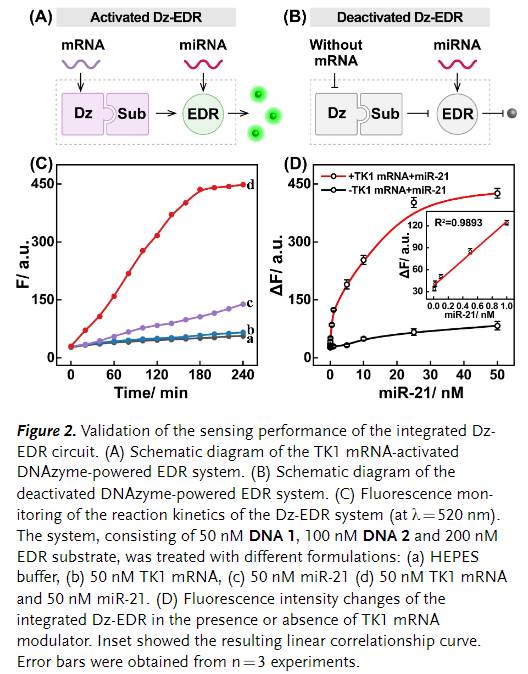 接着,在优化的实验条件下,作者进一步研究了Dz-EDR回路的传感特性(Figure 2)。
接着,在优化的实验条件下,作者进一步研究了Dz-EDR回路的传感特性(Figure 2)。
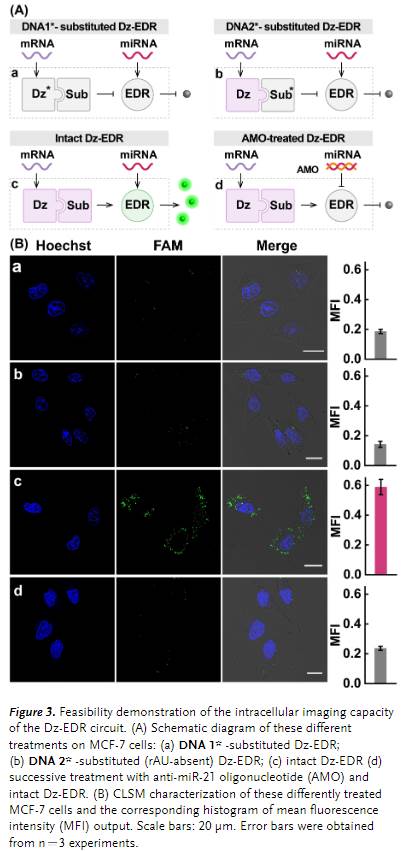
Dz-EDR系统经过测试后具有良好的传感性能,作者进一步使用它来探测活细胞中的细胞内生物分子(Figure 3)。
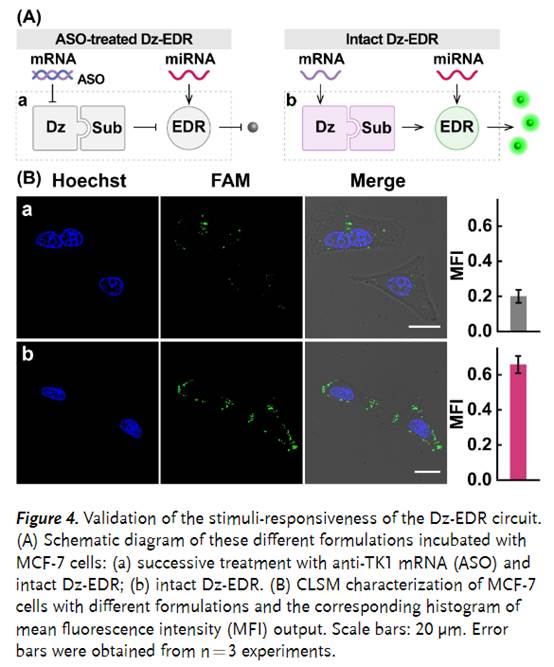
之后,该小组通过转染核苷酸到MCF-7细胞中进行了如下的一系列研究 证明Dz-EDR系统的特异性反应(Figure 4)。
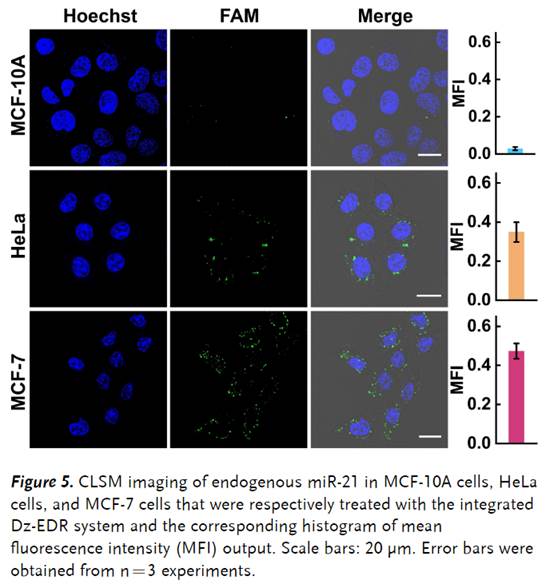
接下来,为了研究Dz-EDR系统区分不同细胞类型的能力,该小组选择癌性MCF-7细胞和HeLa细胞作为具有高表达谱miR-21和激活剂TK1 mRNA的阳性细胞系,以及具有低表达谱miR-10和TK21 mRNA的正常MCF-1A细胞作为阴性对照(Figure 5)。
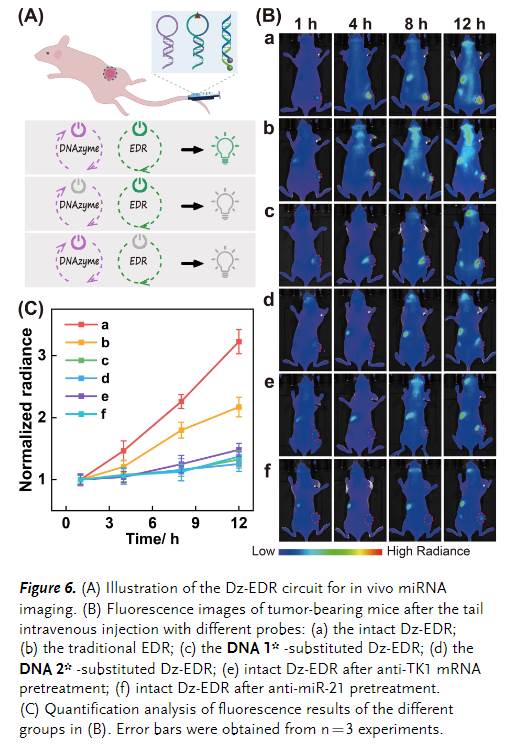
随后,该小组将这些不同的探针通过尾静脉递送到荷瘤裸鼠中(Figure 6),并用于进一步探索Dz-EDR系统的体内传感和成像能力。
总结:
武汉大学王富安团队开发了一种DNA酶驱动的EDR回路,用于体外和体内miRNA成像,具有高信号增益和超低信号泄漏,并通过多种内源性刺激保证的连续分子识别实现高效的细胞辨别。内源性活化的DNA酶可以连续释放这些先前笼住的EDR反应物,通过催化EDR扩增模块激励扩增的miRNA检测。此外,该研究的独特性在于电路结构的模块化和可扩展性,从而可以大大简化系统的整体设计。细胞特异性mRNA激活的DNA酶最初释放EDR反应物,然后可以在活细胞内自主操作,以实现更可靠和特异性的miRNA靶标成像。通过燃料阻断策略,模块化工程分子装置对于在复杂的细胞和体内环境中自动执行特定的生物学任务具有意义,这可以减少可能的信号泄漏和其他复杂组件的干扰。
参考文献:
- [1] H. Wang, Y. Chen, H. Wang, X. Liu, X. Zhou, F. Angew. Chem. Int. Ed. 2019, 58, 7380-7384. doi: 10.1002/anie.201902714
- [2] Z. Qing, J. Xu, J. Hu, J. Zheng, L. He, Z. Zou, S. Yang, W. Tan, R. Yang, Angew. Chem. Int. Ed. 2019, 58, 11574. doi: 10.1002/anie.201812449
- [3] J. Borggräfe, J. Victor, H. Rosenbach, A. Viegas, C. G. W. Gertzen, C. Wuebben, H. Kovacs, M. Gopalswamy, D. Riesner, G. Steger, O. Schiemann, H. Gohlke, I. Span, M. Etzkorn, Nature 2022, 601, 144-149. doi: 10.1038/s41586-021-04225-4
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.




















No comments yet.