作者:石油醚
导读:
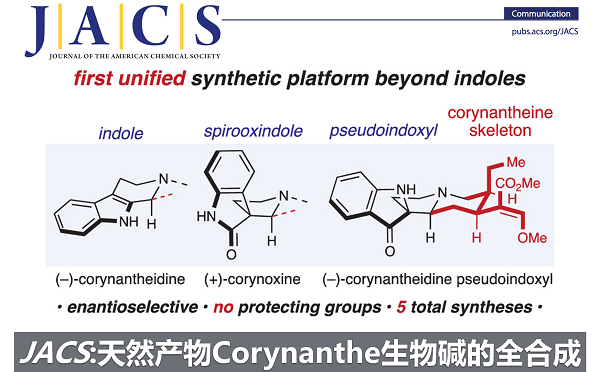
近日,美国西北大学Karl A. Scheidt教授团队在J. Am. Chem. Soc.上,以 “A Platform for the Synthesis of Corynantheine-Type Corynanthe Alkaloids.” 为题,开发了一种快速合成corynantheine 型生物碱的不对称催化平台,实现了(−)-corynantheidine pseudoindoxyl、(+)-corynoxine、(−)-corynoxine B首次不对称合成以及(−)-corynantheidol和 (−)-corynantheidine的全合成。
“A Platform for the Synthesis of Corynantheine-Type Corynanthe Alkaloids.
Yunchan Nam, Anthony T. Tam, Eric R. Miller, and Karl A. Scheidt* J. Am. Chem. Soc., 2023, ASAP. doi: 10.1021/jacs.3c12556”
正文
Corynantheine型生物碱是从Mitragyna speciosa (又称kratom)中分离获得的一种四环单萜类天然产物[1](Figure 1),其对μ型阿片受体(MORs)具有较高的g蛋白选择性作用[2]进而引起了众多研究者的关注。目前,此类生物碱中的许多成员尚未对经典MOR激动剂产生不良的副作用[3],如过度运动、呼吸抑制和成瘾等。因此,科学家研究corynantheine型生物碱的药理特性对发现无副作用的新型镇痛药具有重要的价值[4]。迄今为止,大多数的药理研究主要依赖于一些主要生物碱的天然丰度[5],进而对此类骨架的生物潜力的更广泛研究受到了极大的限制。
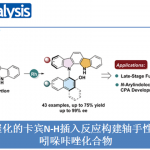
近些年来 ,corynantheine型生物碱由于其结构复杂性而引起合成界的兴趣,如corynantheidol (1) and corynantheidine (2)的全合成[6]。然而,除Meyer的(−)-corynantheidine(1)的对映选择性合成之外,2000年之前大部分工作仅报道了外消旋或部分全合成。直到2000年,Cook及其同事以D-色氨酸作为手性起始原料完成了(−)-corynantheidine(2)的首次对映选择性全合成[7]。自此之后,科学家报道了更多对映选择性合成(−)-corynantheidol(1)和(−)-corynantheidine(2)的工作,但这些研究仅限于结构相差不大的吲哚类生物碱。特别的是,仅有很少的研究小组开发此类天然产物的多样化杂环系列的统一途径,从而能够更广泛地探索其未开发的药用潜力。目前为止,科学家仅报道了两种外消旋corynoxine (3) 和corynoxine B (4)的全合成[8-9]。最近报道了(−)-mitragynine pseudoindoxyl (从(−)-香芹酮合成11步)以及11-methoxy mitragynine pseudoindoxyl的全合成[10]。同样,(−)-corynantheidine pseudoindoxyl (5)仅通过一种半合成就避开了合成群落[11]。受不对称NHC催化(Scheme 1A)简明合成yohimbine型 corynanthe生物碱工作的启发,Karl A. Scheidt教授团队,开发了一种快速合成corynantheine型生物碱的不对称催化平台,实现了(−)-corynantheidine pseudoindoxyl、(+)-corynoxine、(−)-corynoxine B首次不对称合成以及(−)-corynantheidol和 (−)-corynantheidine的全合成。该合成具有高度区域选择性、化学选择性和非对映选择性反应,并且整个步骤无需保护基团。并发表于J. Am. Chem. Soc.上。
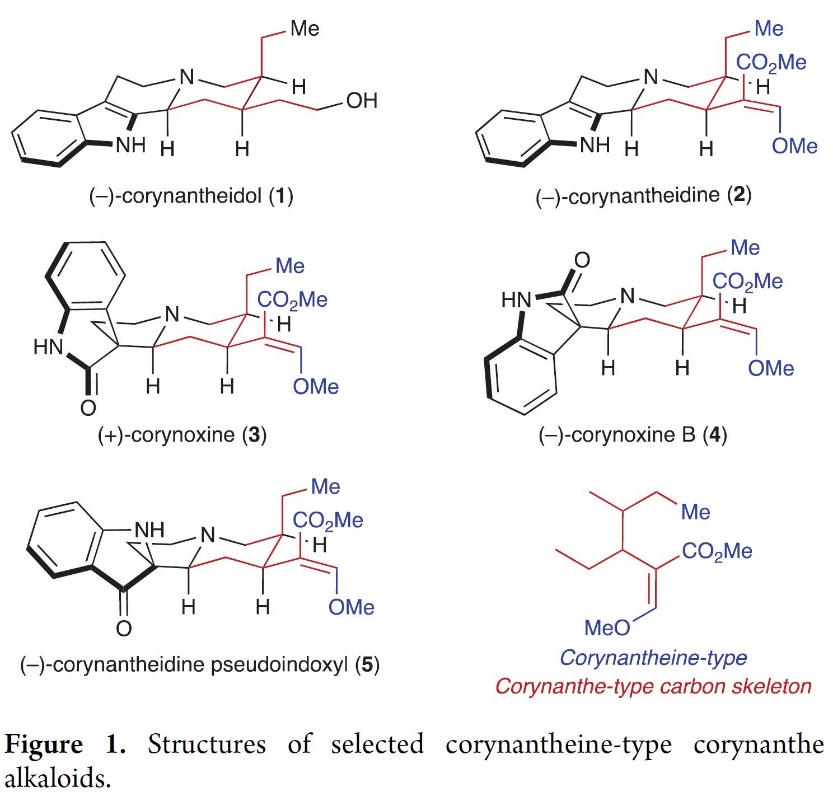
Corynantheine 型生物碱是一类四环单萜天然产物,其与吲哚或吲哚衍生的杂环核稠合的secologanin碳骨架。基于上述结构,作者进行了相关的逆合成分析(Scheme 1B), 即以市售的不饱和醛(6)为原料通过NHC催化的不对称二聚化合成中间体(7);(7)经一锅酰胺化/环化反应来构建内酰胺(8)。随后,(8)经化学和区域选择性还原获得中间体(11),(11)经同系化获得前体(13),(13)通过O-甲基化和Claisen 反应合成(−)-corynantheidine (2)。最后,(−)-corynantheidine (2)的α-iminol部分发生重排反应即可完成(−)-corynantheidine pseudoindoxyl (5)的全合成。
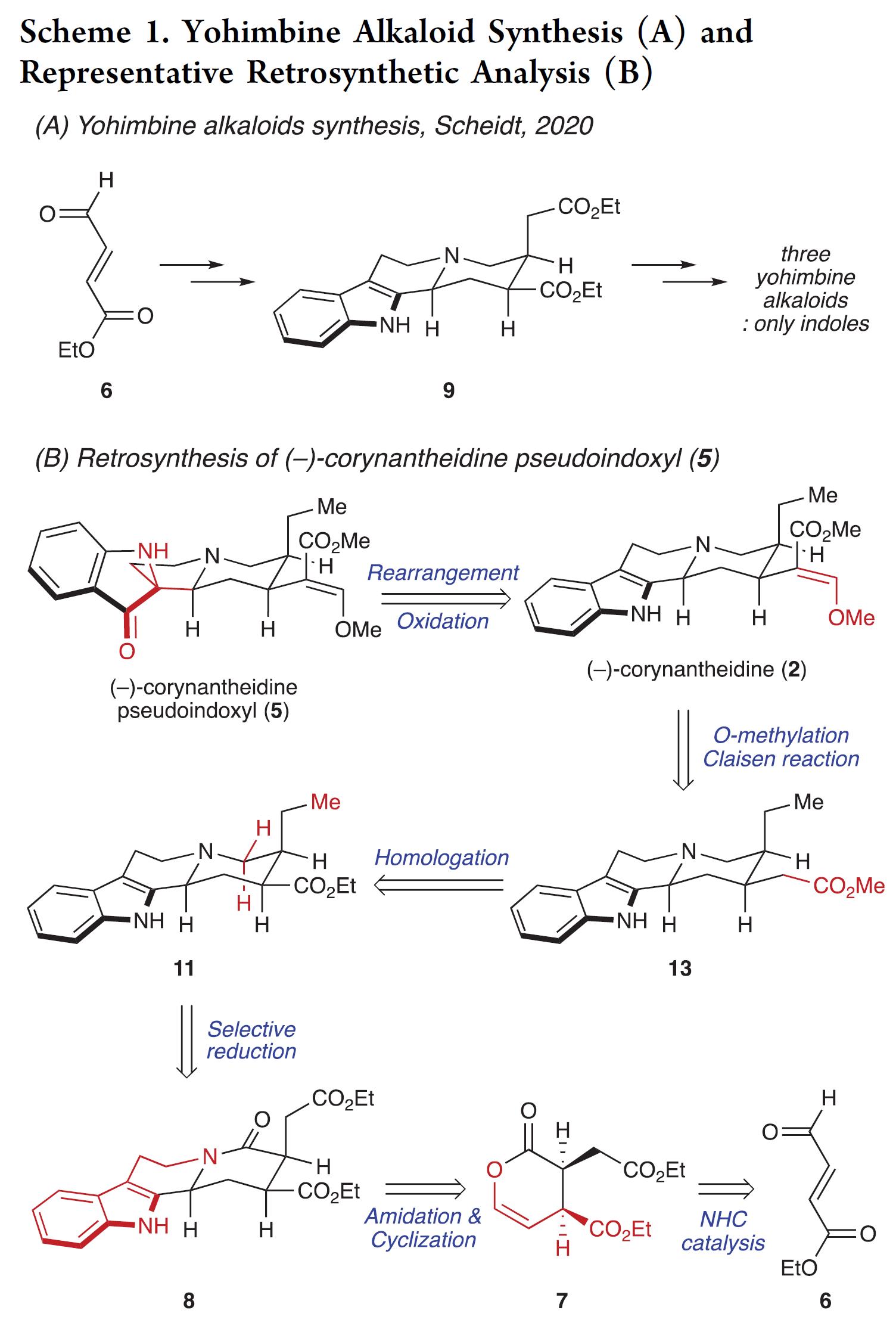
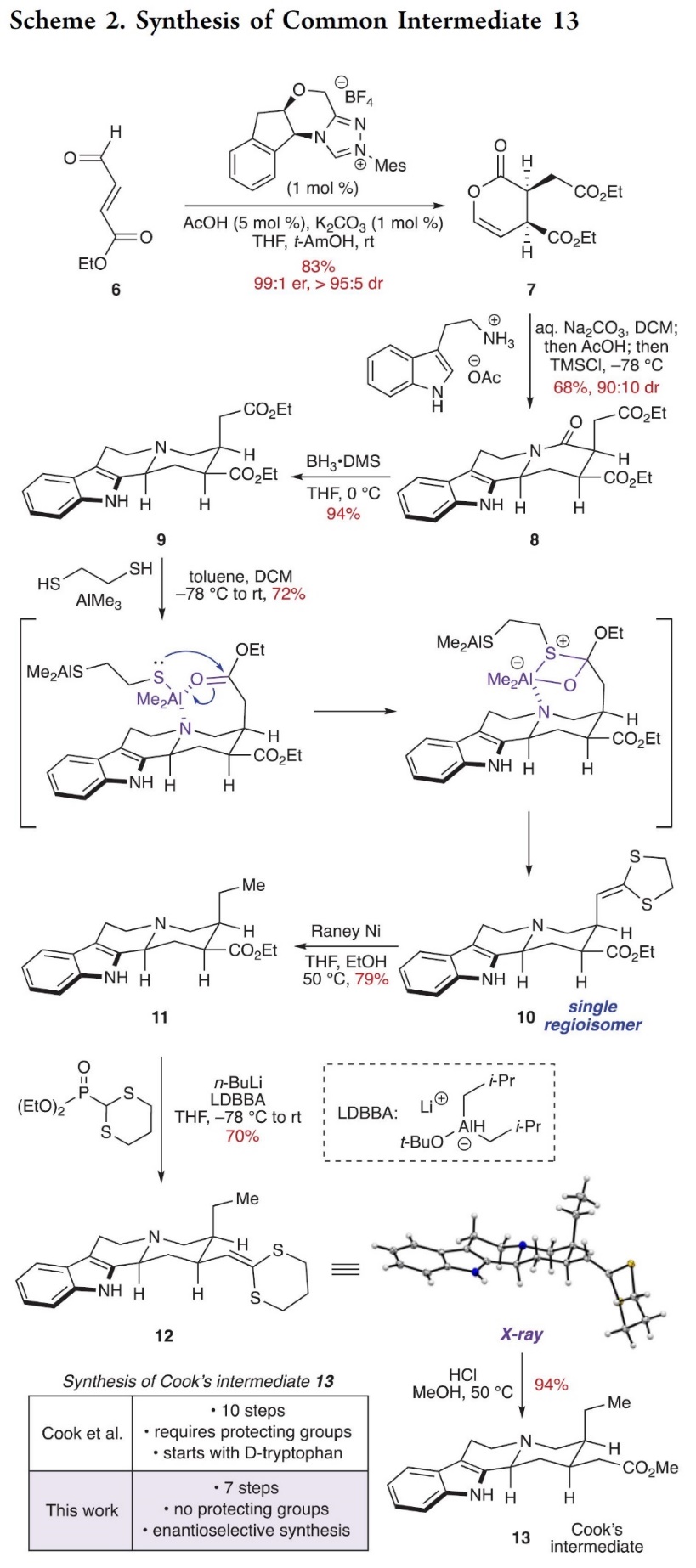
首先,作者对中间体13进行了相关的合成分析,如Scheme 2所示。

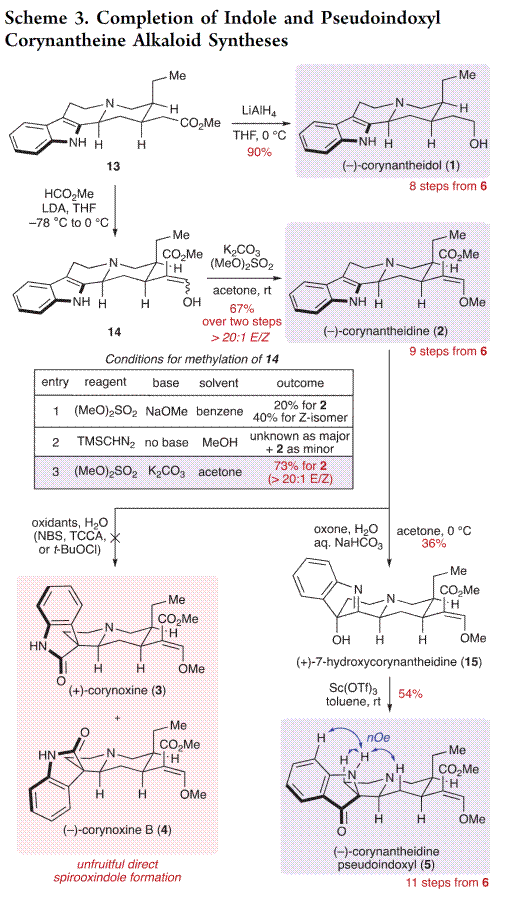
随后,作者对Corynantheine型生物碱(1, 2, 5)进行了合成,如Scheme 3所示。

接下来,作者对(+)-corynoxine (3) 和(−)-corynoxine B (4)合成中关键的氧化重排反应进行了尝试,如图Scheme 4所示。即TCCA促进(8)进行氧化重排反应获得单一非对映异构体(16),(16)在硼氢化钠和碘的组合下实现化学选择性还原获得关键中间体(17)。值得注意的是,DFT计算表明,TCCA促进进行氧化重排反应时,(9)的椅式构象几乎没有面选择性,而(8)的碗式构象可以单一构型得到C3螺环骨架。
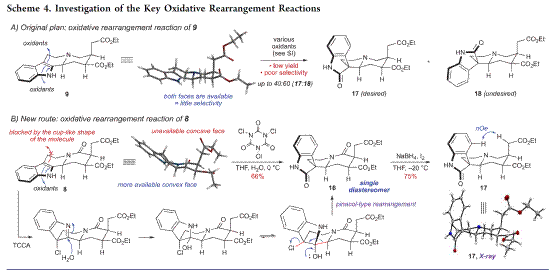
最后,作者对天然产物(+)-corynoxine (3) 和(−)-corynoxine B (4)进行了全合成,如Scheme 5所示。
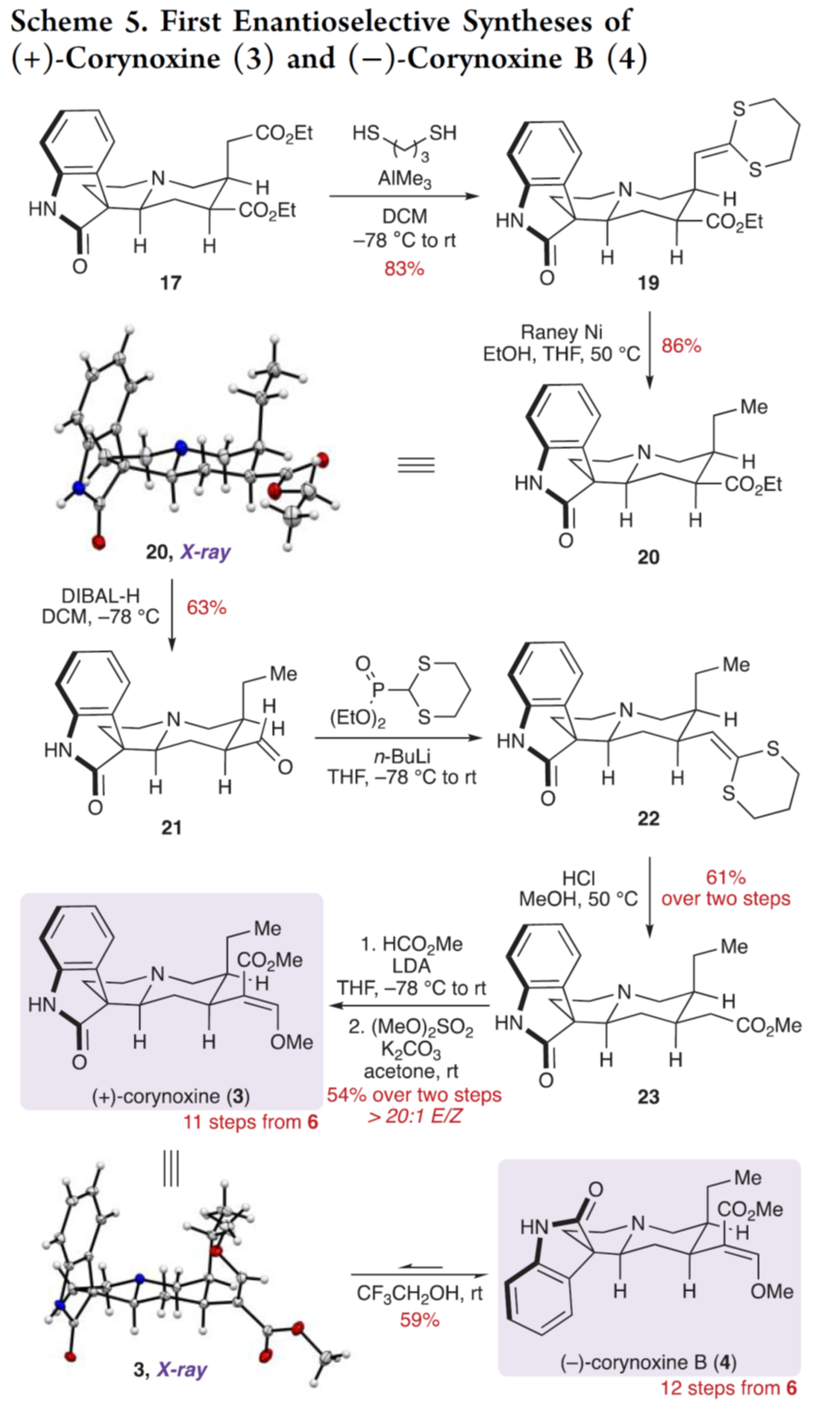

总结, Karl A. Scheidt教授团队,开发了一种快速合成corynantheine 型生物碱的不对称催化平台,实现了(−)-corynantheidine pseudoindoxyl、(+)-corynoxine、(−)-corynoxine B首次不对称合成以及(−)-corynantheidol和 (−)-corynantheidine的全合成。该合成具有高度区域选择性、化学选择性和非对映选择性反应,并且整个步骤无需保护基团。
参考文献:
- [1] E. R. Miller, K. A. Scheidt, Synthesis 2022, 54, 1217. doi:10.1055/a-1684-2942.
- [2] H. Takayama, H. Ishikawa, M. Kurihara, M. Kitajima, N. Aimi, D. Ponglux, F. Koyama, K. Matsumoto, T. Moriyama, L. T. Yamamoto, K. Watanabe, T. Murayama, S. Horie, J. Med. Chem. 2002, 45, 1949. doi:10.1021/jm010576e.
- [3] N. J.-Y. Chear, F. León, A. Sharma, S. R. R. Kanumuri, G. Zwolinski, K. A. Abboud, D. Singh, L. F. Restrepo, A. Patel, T. Hiranita, S. Ramanathan, A. J. Hampson, L. R. McMahon, C. R. McCurdy, J. Nat. Prod. 2021, 84, 1034. doi:10.1021/acs.jnatprod.0c01055.
- [4] S. Chakraborty, J. F. DiBerto, A. Faouzi, S. M. Bernhard, A. M. Gutridge, S. Ramsey, Y. Zhou, D. Provasi, N. Nuthikattu, R. Jilakara, M. N. F. Nelson, W. B. Asher, S. O. Eans, L. L. Wilson, S. M. Chintala, M. Filizola, R. M. van Rijn, E. B. Margolis, B. L. Roth, J. P. McLaughlin, T. Che, D. Sames, J. A. Javitch, S. Majumdar, J. Med. Chem. 2021, 64, 13873. doi:10.1021/acs.jmedchem.1c01273.
- [5] S. E. Hemby, S. McIntosh, F. Leon, S. J. Cutler, C. R. McCurdy, Addict. Biol. 2019, 24, 874. doi:10.1111/adb.12639.
- [6] J. A. Weisbach, J. L. Kirkpatrick, K. R. Williams, E. L. Anderson, N. C. Yim, B. Douglas, Tetrahedron Lett. 1965, 6, 3457. doi:10.1016/S0040-4039(01)89328-X.
- [7] S. Yu, O. M. Berner, J. M. Cook, J. Am. Chem. Soc. 2000, 122, 7827. doi:10.1021/ja0016553.
- [8] M. J. Wanner, S. Ingemann, J. H. van Maarseveen, H. Hiemstra, Eur. J. Org. Chem. 2013, 2013, 1100. doi:https://doi.org/10.1002/ejoc.201201505.
- [9] J. Xu, L.-D. Shao, D. Li, X. Deng, Y.-C. Liu, Q.-S. Zhao, C. Xia, J. Am. Chem. Soc. 2014, 136, 17962. doi:10.1021/ja5121343.
- [10] P. Angyal, K. Hegedüs, B. B. Mészáros, J. Daru, Á. Dudás, A. R. Galambos, N. Essmat, M. Al-Khrasani, S. Varga, T. Soós, Angewandte Chemie International Edition 2023, 62, e202303700. doi:10.1002/anie.202303700.
- [11] A. Váradi, G. F. Marrone, T. C. Palmer, A. Narayan, M. R. Szabó, V. Le Rouzic, S. G. Grinnell, J. J. Subrath, E. Warner, S. Kalra, A. Hunkele, J. Pagirsky, S. O. Eans, J. M. Medina, J. Xu, Y.-X. Pan, A. Borics, G. W. Pasternak, J. P. McLaughlin, S. Majumdar, J. Med. Chem. 2016, 59, 8381. doi:10.1021/acs.jmedchem.6b00748.
- [12] M. Mikołajczyk, S. Grzejszczak, A. Zatorski, B. Mlotkowska, H. Gross, B. Costisella, Tetrahedron 1978, 34, 3081. doi:https://doi.org/10.1016/0040-4020(78)87003-3.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.


















No comments yet.