本文作者:Duece
导读
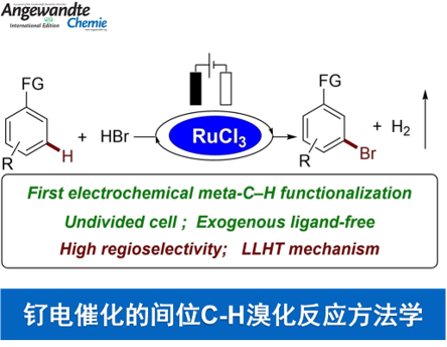
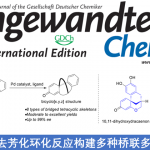
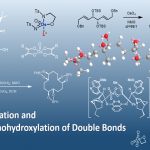
近日,德国Göttingen大学的Ackermann小组在Angew. Chem. Int. Ed.中发表论文,报道首例通过钌催化剂促进的电化学远程C-H溴化反应方法学。这一全新的钌电催化 (ruthenaelectro-Catalyzed) C-H官能团化策略具有无需采用相应的配体与支持电解质、良好的反应收率、高度的间位区域选择性与实验操作安全性以及广泛的底物应用范围等优势。
Wang, H. Simon, X. Chen, Z. Lin, S. Chen, L. Ackermann, Angew. Chem. Int. Ed. 2022, e202201595. doi: 10.1002/anie.202201595.
正文
目前,有机电合成化学 (electro-organic synthesis)已经成为当代有机合成化学研究中的热门领域[1]-[2]。尤其近年来,对于Pd电催化的邻位C-H卤化 (palladaelectro-catalyzed ortho-C-H halogenation)反应方法学的相关研究,已经逐渐受到有机合成化学家的广泛关注[3]-[5] (Scheme 1)。然而,对于金属电催化的远程C-H键官能团化策略的研究,尚未有相关的文献报道。近日,德国Göttingen大学的Ackermann研究团队报道首例通过钌催化剂促进的电化学远程间位C-H溴化反应方法学。
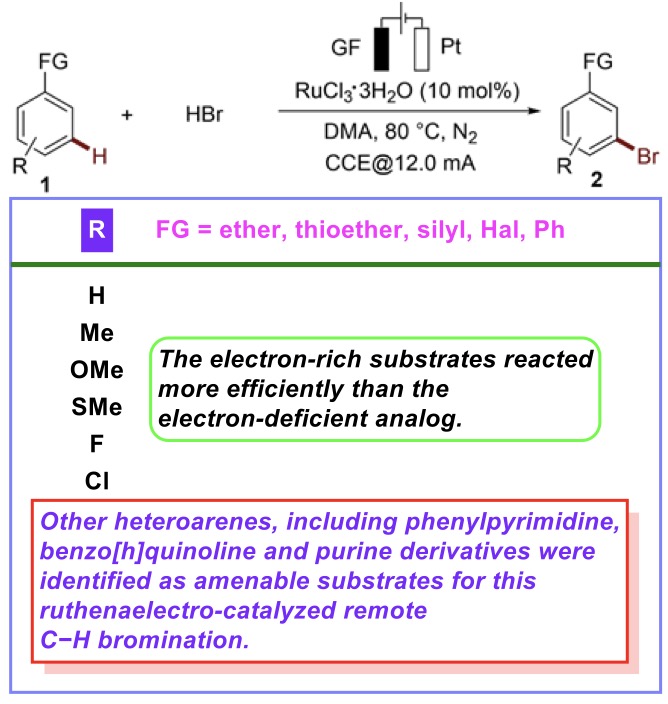
首先,作者采用2-苯基吡啶作为模型底物,进行相关反应条件的优化筛选,进而确定最佳的反应条件为:在无隔膜电解槽 (undivided cell)以及氮气气氛下,采用RuCl3·3H2O作为催化剂,氢溴酸作为溴化试剂,DMA作为反应溶剂,GF (graphite felt)与Pt板分别作为阳极与阴极,CCE (constant current electrolysis)=12.0 mA,反应温度为80 °C,最终获得87%分离收率的间位溴化产物2a (Table 1)。
在上述的最佳反应条件下,作者首先对一系列杂环芳基底物的应用范围进行如下研究 (Scheme 2)。
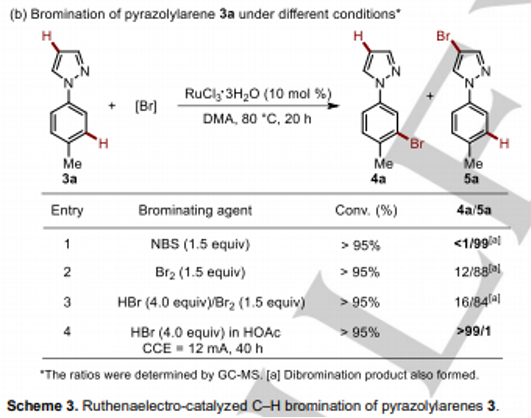
同时,该小组进一步发现,这一全新的钌电催化C-H官能团化策略同样能够有效地应用于一系列吡唑基芳香底物(pyrazolylarene, Scheme 3)。
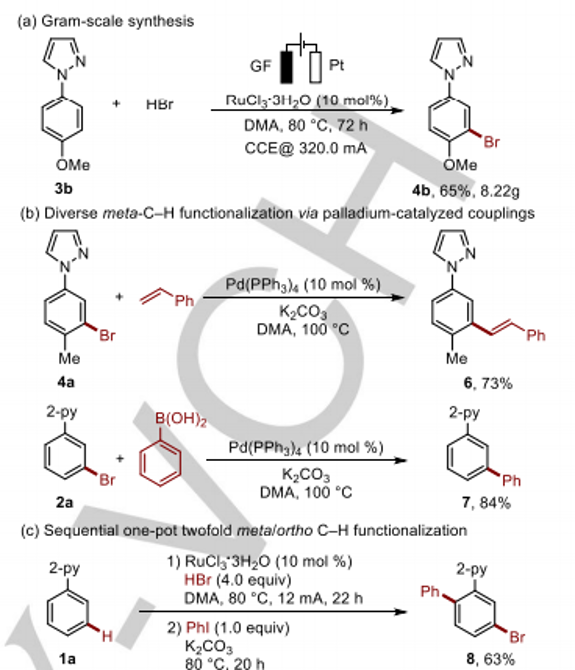
之后,该小组通过如下的一系列研究进一步表明,这一全新的钌电催化C-H官能团化策略具有良好的合成应用价值 (Scheme 4)。
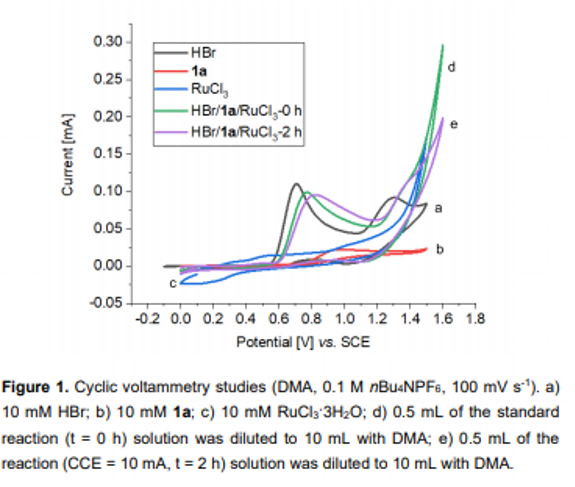
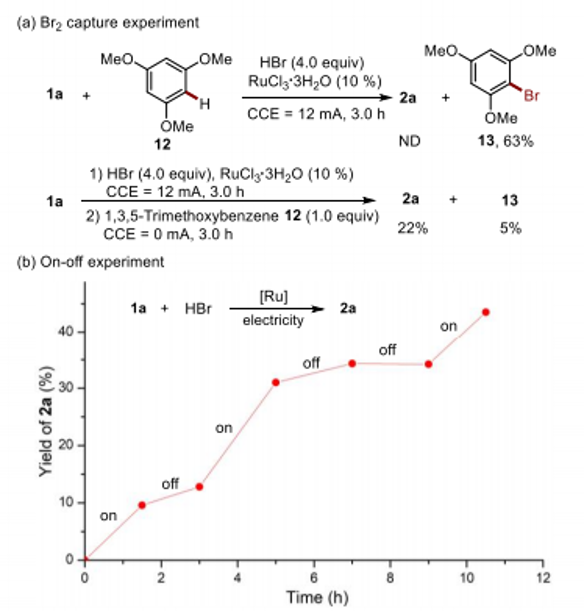
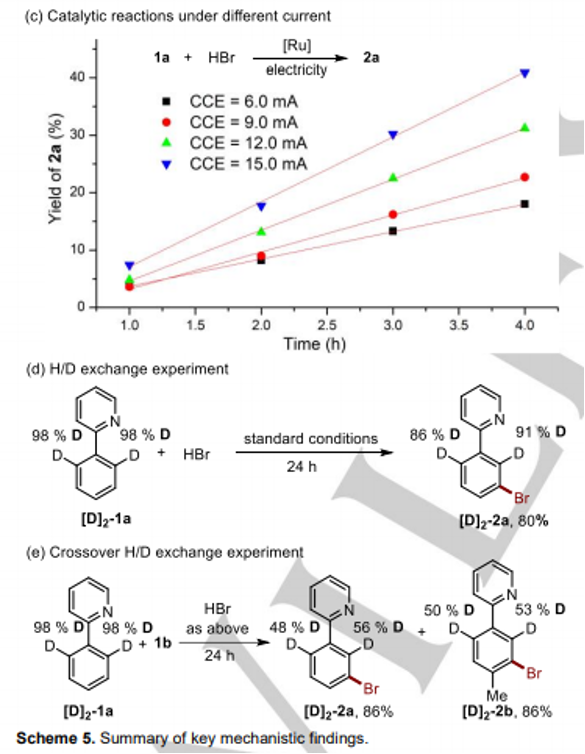
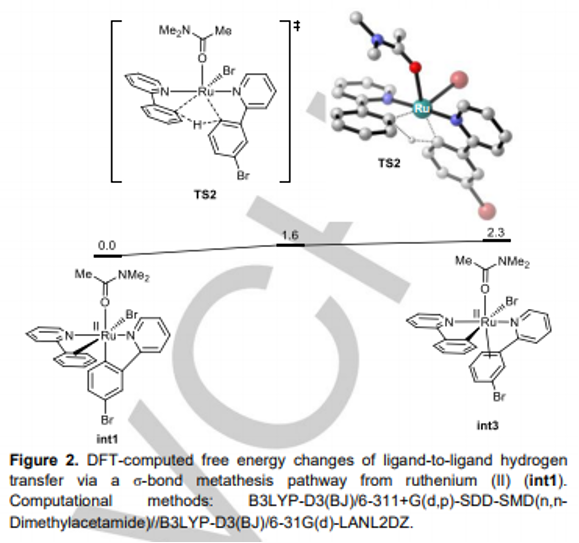
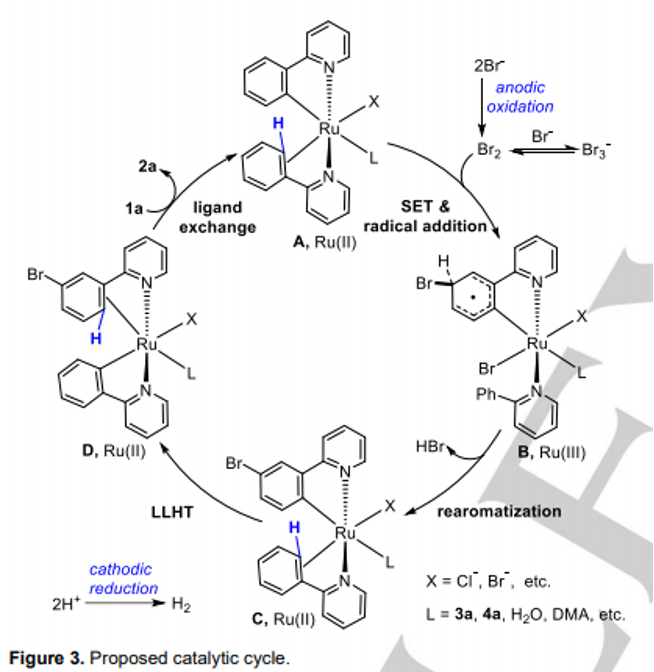
接下来,作者通过CV (cyclic voltammetry, Figure 1)与Br2捕获实验 (Scheme 5a)以及on-off实验 (Scheme 5b)的相关研究表明,溴离子极易通过阳极氧化过程,形成相应的Br2 ,并且与Br3−存在平衡。同时,Br2极易在阴极进行还原,并且在反应过程中,Br2/Br3−能够始终维持较低的浓度,进而使上述的钌电催化C-H溴化过程表现出高度的区域选择性。之后,该小组在通过控制不同电流条件下进行的钌电催化C-H溴化反应的相关研究表明,溴化过程为上述钌电催化反应过程中的决速步骤 (Scheme 5c)。同时,作者通过H/D交换实验 (Scheme 5d)与交叉H/D交换实验 (Scheme 5e)的一系列研究,进一步表明,上述的电催化过程中涉及环钌配合物 (ruthenacycle complex)的参与。其中,环钌配合物的质子解 (protonolysis)过程即使在酸性条件下,反应速率同样较为缓慢。接下来,该小组通过DFT计算发现,反应过程中较为关键的LLHT (ligand to ligand hydrogen transfer)反应过程,则需要通过σ键复分解途径进行 (Figure 2)。
基于上述实验以及DFT计算的相关研究,作者提出如下合理的反应机理 (Figure 3)。其中,较为关键的机理步骤则涉及通过中间体C进行的LLHT (ligand to ligand hydrogen transfer)过程以及后续通过中间体D与1a之间进行的配体交换过程。
总结
Göttingen大学的Ackermann研究团队报道首例通过钌催化剂促进的电化学远程C-H溴化反应方法学。这一全新的钌电催化 (ruthenaelectro-catalyzed) C-H官能团化策略无需采用相应的配体与支持电解质,并表现出良好的反应收率、高度的区域选择性与实验操作安全性以及广泛的底物应用范围等优势。
参考文献
- [1] J. Siu, N. Fu, S. Lin, Acc. Chem. Res. 2020, 53, 547.
- doi: 10.1021/acs.accounts.9b00529.
- [2] X. Dong, J. Roeckl, S. Waldvogel, B. Morandi, Science. 2021, 371, 507.
- doi: 10.1126/science.abf2974.
- [3] Q. Yang, X. Wang, X. Weng, X. Yang, X. Xu, X. Tong, P. Fang, X. Wu, T. Mei. Acta. Chim. Sinica. 2019, 77, 866. doi: 10.6023/A19040135.
- [4] Q. Yang, Y. Li, C. Ma, P. Fang, X. Zhang, T. Mei, J. Am. Chem. Soc. 2017, 139, 3293. doi: 10.1021/jacs.7b01232.
- [5] (a) F. Kakiuchi, T. Kochi, H. Mutsutani, N. Kobayashi, S. Urano, M. Sato,
- Nishiyama, T. Tanabe, J. Am. Chem. Soc. 2009, 131, 11310. doi: 10.1021/ja9049228.
- (b) M. Konishi, K. Tsuchida, K. Sano, T. Kochi, F. Kakiuchi, J. Org. Chem.
- 2017, 82, 8716. doi:10.1021/acs.joc.7b01137.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载





















No comments yet.