本文作者:杉杉
导读
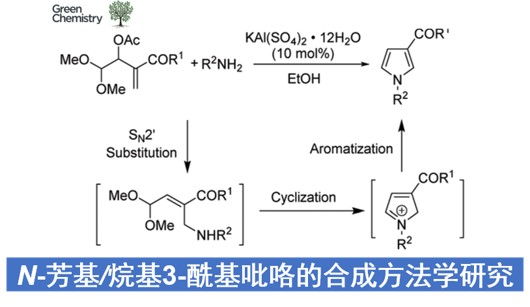
近日,华中科技大学的顾彦龙与李明浩课题组在Green Chem.中发表论文,报道一种采用明矾 (kalinite)催化的Morita-Baylis-Hillman乙酸酯衍生物与一级胺之间的[4+1]环化反应方法学,进而成功完成一系列N-取代3-酰基吡咯分子的一步高效构建。同时,作者通过克级规模的实验研究以及这一全新的[4+1]环化策略在各类生物活性化合物合成中的应用,进一步阐明这一全新的[4+1]环化策略具有潜在的合成应用价值。
Direct synthesis of N-aryl/alkyl 3-carbonylpyrroles from the Morita-Baylis-Hillman acetate of 2,2-dimethoxyacetaldehyde and a primary amine
L. Guo, J. Li, L. Vaccaro, M. Li, Y. Gu, Green Chem. 2021, ASAP. Doi:10.1039/D1GC03635A.
正文
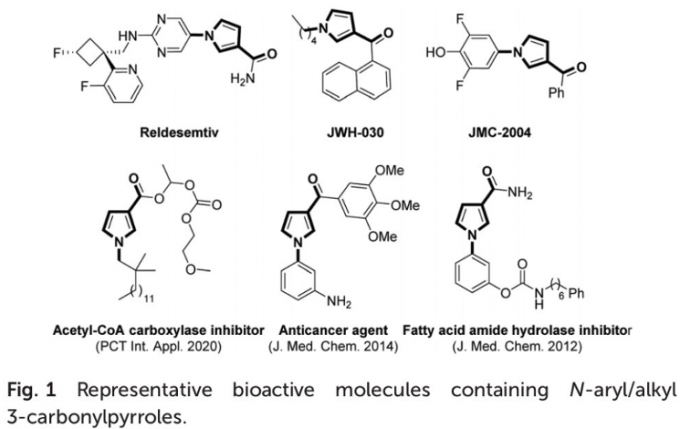
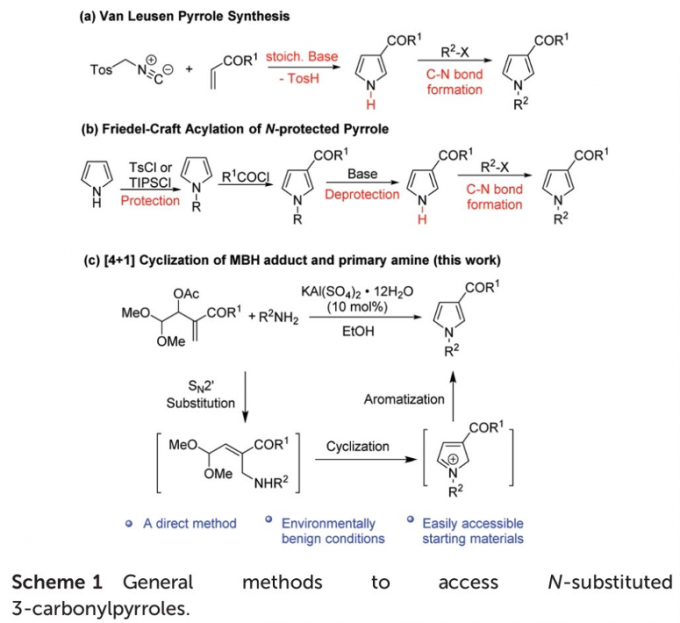
N-芳基/烷基3-酰基吡咯已经广泛应用于导电聚合物的制备以及诸多生物活性分子的合成 (Fig. 1)。因此,3-酰基吡咯类化合物的合成方法学研究备受有机合成化学家的广泛关注 (Scheme 1a-1b) [1]-[6]。然而,上述的反应策略中,通常涉及预先的官能团化步骤,缺乏良好的步骤经济性。因此,仍然需要开发一种更为有效的合成转化策略,进而实现各类N-芳基/烷基3-酰基吡咯分子的构建。
这里,受到将Morita-Baylis-Hillman加合物应用于杂环分子构建的相关研究报道[7]-[8]的启发,作者设想,MBH加合物可能具有良好的双重亲电反应活性,进而能够与各类一级胺分子进行相关的串联SN2’取代-环化-芳构化反应过程,并获得一系列N-取代3-酰基吡咯类化合物 (Scheme 1c)。
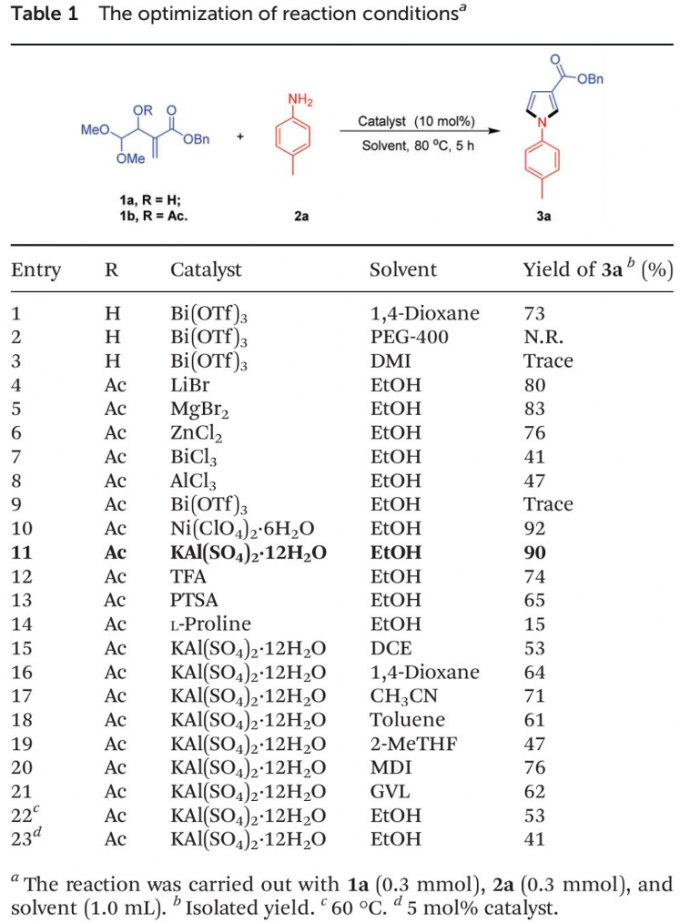
首先,作者采用1a/1b与对甲苯胺2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用KAl(SO4)2•12H2O作为催化剂,乙醇作为反应溶剂,反应温度为80 oC,并获得90%收率的吡咯产物3a。
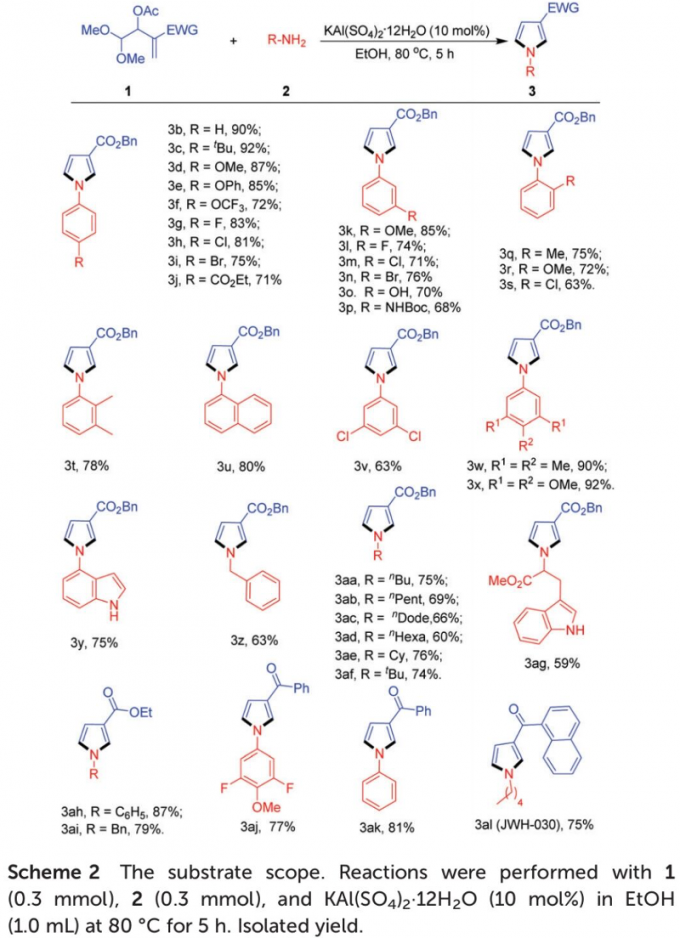
在上述的最佳反应条件下,作者首先对各类苯胺底物的应用范围进行考察 (Scheme 2)。研究表明,一系列带有供电子与吸电子基团取代的苯胺底物均能较好地与上述的标准反应条件兼容,并获得相应的吡咯产物3b–3s (63-92% 收率)。同时,该小组发现,各类二取代以及三取代苯胺、1H–吲哚-4-胺以及苄胺底物,同样能够有效地参与上述的合成转化过程,并获得预期的目标产物3t–3z (63-92% 收率)。然而,上述的标准反应体系对于2-氨基吡啶以及4-氨基吡啶底物,则无法有效地参与上述的[4+1]环化过程。之后,作者发现,各类脂肪胺底物同样能够与上述的标准反应体系良好地兼容,并获得相应的环化产物3aa–3ai (59-87%收率)。接下来,作者进一步对一系列MBH乙酸酯底物的应用范围进行深入研究。该小组观察到,在上述的标准反应体系中,各类具有丙烯酸酯以及丙烯酮结构单元的MBH乙酸酯底物同样能够顺利地完成上述的[4+1]环化过程,并获得相应的吡咯产物3aj–3al(75-81% 收率)。
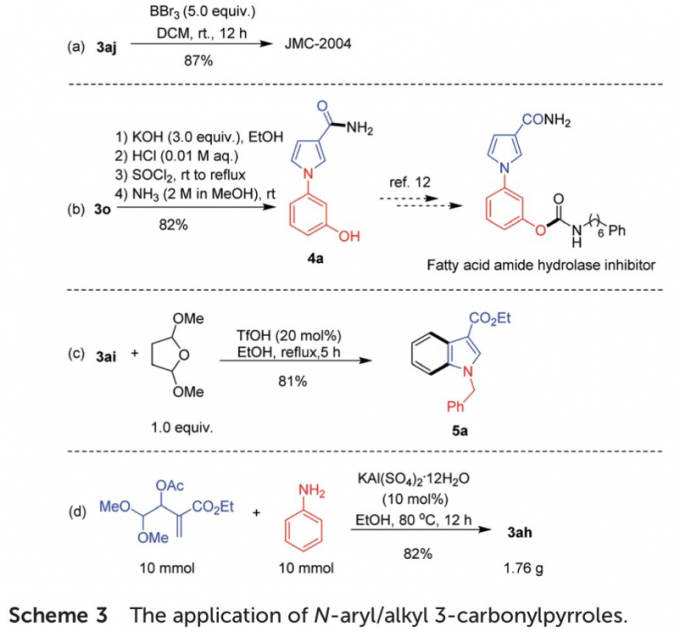
之后,该小组研究发现,通过这一全新的[4+1]环化策略,能够成功完成一系列重要生物活性分子等构建(Scheme 3)。同时,作者观察到,将底物用量扩大至10 mmol时,同样能够获得良好的反应收率,进而表明这一全新的[4+1]环化策略具有良好的合成应用价值。
总结:华中科技大学顾彦龙与李明浩课题组报道一种采用明矾催化的MBH乙酸酯与一级胺之间的[4+1]环化反应方法学,进而以良好的反应收率,成功完成一系列N-取代3-酰基吡咯分子的一步高效构建。这一全新的[4+1]环化方法学具有环境友好、起始原料与催化剂廉价易得以及良好的官能团兼容性等优势。
参考文献
[1] (a) Z. Ma, Z. Ma, D. Zhang, Molecules, 2018, 23, 2666. doi: 10.3390/molecules23102666.(b) C. Schmuck, D. Rupprecht, Synthesis, 2007, 3095. doi: 10.1055/s-2007-990783.
[2] M. Kakushima, P. Hamel, R. Frenette, J. Rokach, J. Org. Chem. 1983, 48, 3214. doi: 10.1021/jo00167a014. [3] B. L. Bray, P. H. Mathies, R. Naef, D. R. Solas, T. T. Tidwell, D. R. Artis, J. M. Muchowski, J. Org. Chem. 1990, 55, 6317. doi: 10.1021/jo00313a019. [4] G. Singh, M. Kumar, V. Bhalla, Green Chem. 2018, 20, 5346. doi: 10.1039/C8GC02527D. [5] Y. R. Jorapur, J. M. Jeong, D. Y. Chi, Tetrahedron Lett. 2006, 47, 2435. doi: 10.1016/j.tetlet.2006.01.129. [6] (a) X. Shi, X. Chen, M. Wang, X. Zhang, X. Fan, J. Org. Chem. 2018, 83, 6524. doi: 10.1021/acs.joc.8b00805.(b) Y. He, F. Wang, X. Zhang, X. Fan, Chem. Commun. 2017, 53, 4002. doi: 10.1039/C6CC10227A.
[7] (a) C. R. Reddy, M. D. Reddy, B. Srikanth, Org. Biomol. Chem. 2012, 10, 4280. doi: 10.1039/C2OB25272D.(b) C. R. Reddy, S. A. Panda, A. Ramaraju, J. Org. Chem. 2017, 82, 944. doi: 10.1021/acs.joc.6b02468.
(c) D. Basavaiah, B. S. Reddy, S. S. Badsara, Chem. Rev. 2010, 110, 5447. doi: 10.1021/cr900291g.
(d) P. T. Kaye, Adv. Heterocycl. Chem. 2019, 127, 101. doi: 10.1016/bs.aihch.2018.09.003.
(e) Y. Huang, J. Liao, W. Wang, H. Liu, H. Guo, Chem. Commun. 2020, 56, 15235. doi: 10.1039/D0CC05699E.
(f) C. R. Reddy, M. D. Reddy, B. Srikanth, K. R. Prasad, Org. Biomol. Chem. 2011, 9, 6027. doi: 10.1039/C1OB05402C.
[8] R. C. Gomes, R. C. Barcelos, M. T. Rodrigues Jr., H. Santos, F. Coelho, Chemistry Select 2017, 2, 926. doi: 10.1002/slct.201602059.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.