本文作者:杉杉
导读
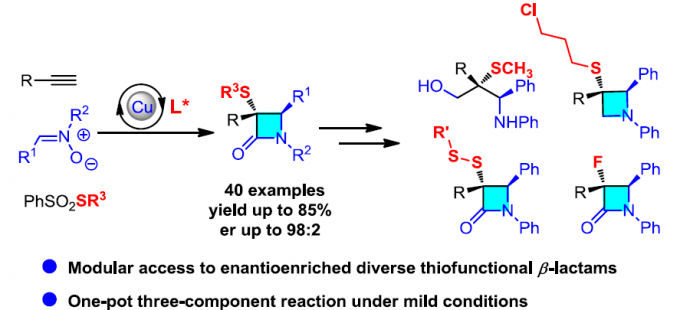
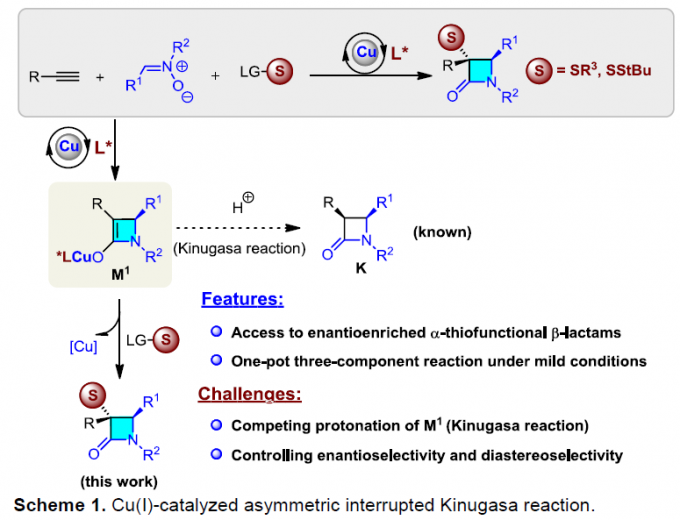
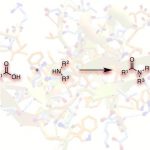
近日,山东大学徐政虎课题组在Angew. Chem. Int. Ed.上发表论文,报道了铜(I)催化不对称三组分Kinugasa反应,获得各种具有两个连续立体生成中心的含硫手性β-内酰胺衍生物,反应过程具有较高的产率与(非)对映选择性。此外,该反应设计的关键在于采用硫亲电试剂,捕获原位形成的烯醇铜(I)中间体(M1),从而实现此类转化。
Copper(I)-Catalyzed Asymmetric Interrupted Kinugasa Reaction: Synthesis of α-Thiofunctional Chiral β-Lactams
Z. Xu, J. Qi, F. Wei, S. Huang, C. Tung,
Angew. Chem. Int. Ed. ASAP. DOI: 10.1002/anie.202013450.
正文
自1928年Fleming发现青霉素(penicillin)以来,β-内酰胺已广泛应用于化学、生物学与医学领域。如临床使用的抗生素青霉素与头孢菌素(cephalosporin),而且,一些β-内酰胺类化合物还具有抗真菌与抗炎活性,并作为降血脂药。在合成化学中,β-内酰胺是一种非常重要的合成子,可用于合成β-氨基酸以及taxo侧链等。同时,在临床选用的抗生素(如青霉素、舒巴坦、头孢菌素等)中,各种含硫基团起着非常重要的作用。因此,将硫原子引入四元环骨架至关重要。1972年,Kinugasa等[1a]报道了通过乙炔铜(I)与硝酮在吡啶中直接进行的偶联反应,获得β-内酰胺化合物。然而,由于反应机理不够明确,且反应有效性较低,致使该方法学的进一步发展面临较大挑战。1995年,Miura等[1b]报道了首例端炔与硝酮之间的催化Kinugasa反应。近期,Fu与其他课题组[1c-j]发展了催化不对称形式的Kinugasa反应,成功实现了通过易得的原料,对映选择性地合成β-内酰胺类化合物,然而,上述方法仅能够获得3,4-二取代产物(K)。之后,Fu课题组[1d]报道了首例采用烯丙基碘捕获烯醇铜(I)中间体的分子内Kinugasa反应。最近,Enders等[1j]开发出通过分子间的Kinugasa反应以及随后的分子内的去对称化Michael加成反应,获得各种螺多环β-内酰胺化合物。迄今为止,尚未报道涉及基于Kinugasa反应的分子间三组分反应方法学。这里,山东大学徐政虎课题组首次报道了在铜(I)催化剂存在下,通过端炔、硝酮与硫亲电体作为反应底物参与的三组分中断型 Kinugasa反应(interrupted Kinugasa reaction),进而合成多种具有α-硫代官能团的手性β-内酰胺衍生物(Scheme 1)。其中,通过四元环烯醇铜(I)中间体(M1)的质子化,将获得正常的Kinugasa反应产物,即3,4-二取代的内酰胺。而本文中,作者引入硫亲电试剂,捕捉中间体M1,从而获得一系列具有α-硫代官能团的多取代β-内酰胺。然而,要实现催化循环,则存在巨大的挑战,1)为抑制能量上更加有利的质子转移反应,需要具有较高反应活性的含硫亲电试剂,然而这类反应活性较高的含硫亲电试剂能够与乙炔铜中间体反应,形成内炔副产物。2)需要寻找一种适宜的催化体系,能够使该反应最终获得优良的化学选择性、对映选择性与非对映选择性。由于S-S键弱,并且断裂该键形成的苯亚磺酸负离子具有良好的离去性能。因此,该小组选择S-甲基苯磺酸酯(3a)作为亲电试剂。同时,本研究是将亲电硫烷基化试剂应用于不对称催化反应中的首次尝试。
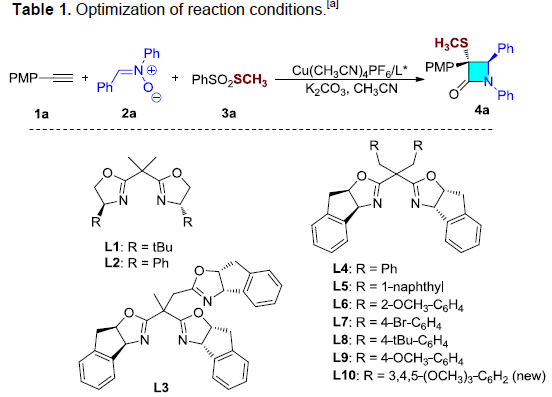
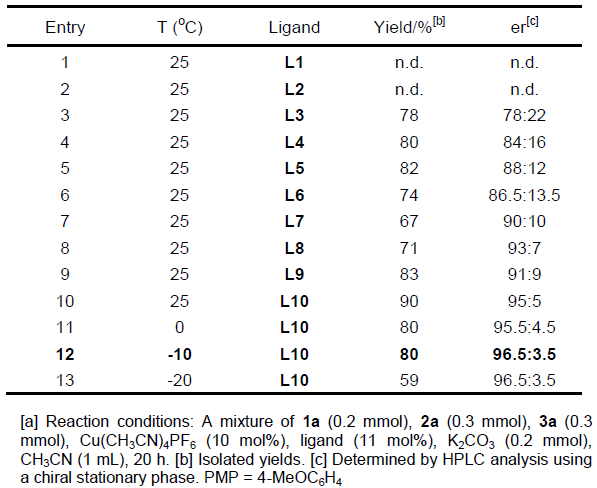
首先,作者以端炔1a、硝酮2a与S-甲基苯磺酸酯3a作为模型底物,进行相关反应条件的筛选(Table 1)。最终,筛选出最佳的反应条件为采用Cu(CH3CN)4PF6为催化剂,L10配体,K2CO3作为碱,CH3CN作为反应溶剂,在-10 ℃反应。最终获得目标产物4a的收率为80%,er为96.5:3.5。
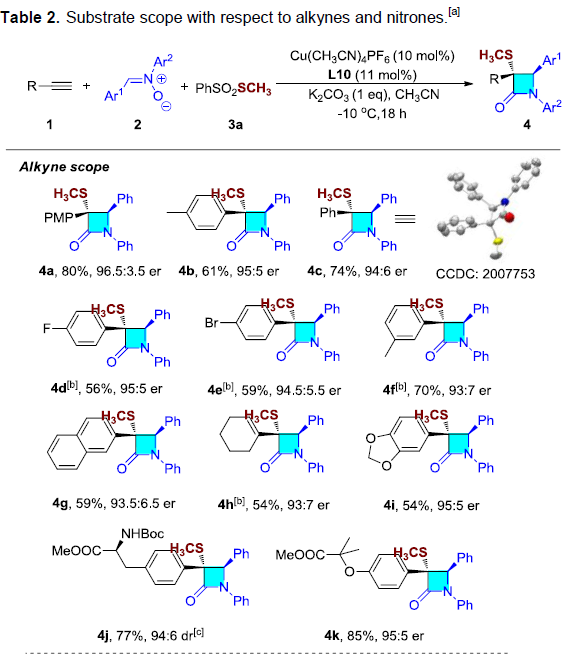
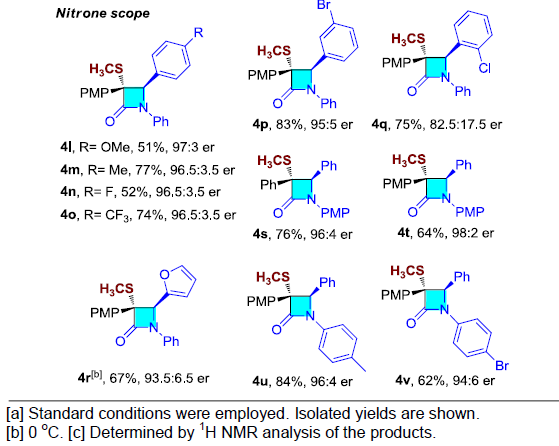
在获得上述最佳反应条件后,作者开始对端炔1与硝酮2的底物适用范围进行进一步研究(Table 2)。研究表明,各类芳基取代的端炔底物,均能够顺利进行上述反应,并以较高收率与良好的对映选择性获得相应的内酰胺产物4a–4g以及4i–4k。通常,具有供电子基团的炔烃,能够获得较高的产率与对映选择性。脂肪族的1-环己烯基乙炔同样可以较好地适用于上述反应(4h)。同时,作者发现,酪氨酸衍生的端炔同样能够有效地完成上述转化,并获得77%的收率与94:6 er的预期产物 (4j),这表明远程手性中心对上述反应无显著影响。接下来,作者研究发现,上述反应受硝酮底物中的芳基取代基的影响较小,并获得相应的产物4l–4v。由于立体排斥效应的存在,上述反应条件应用于邻位芳基取代的硝酮(4q)时,观察到产物的对映选择性出现显著下降。
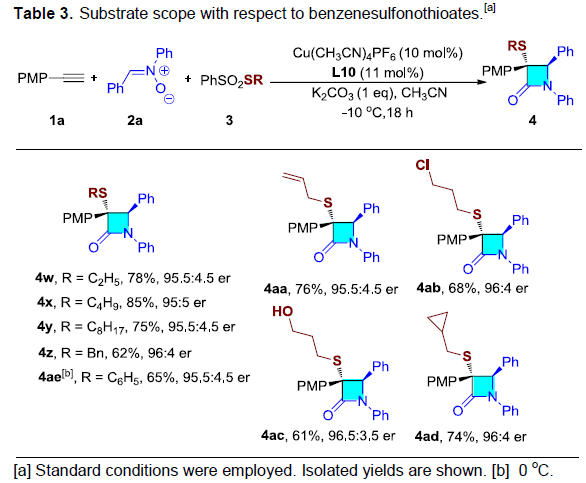
随后,作者对硫亲电试剂3的应用范围进行进一步研究(Table 3)。含有各种烷基与芳族的硫亲电试剂,均能够以良好的收率与优良的对映选择获得相应的产物4w–4z和4ae。同时,烯丙基(4aa)、氯(4ab)以及环丙基(4ad)等官能团均能够较好地与上述反应体系兼容。值得注意的是,具有游离羟基的对硫亲电试剂同样能够有效地参与上述反应,获得相应内酰胺4ac。
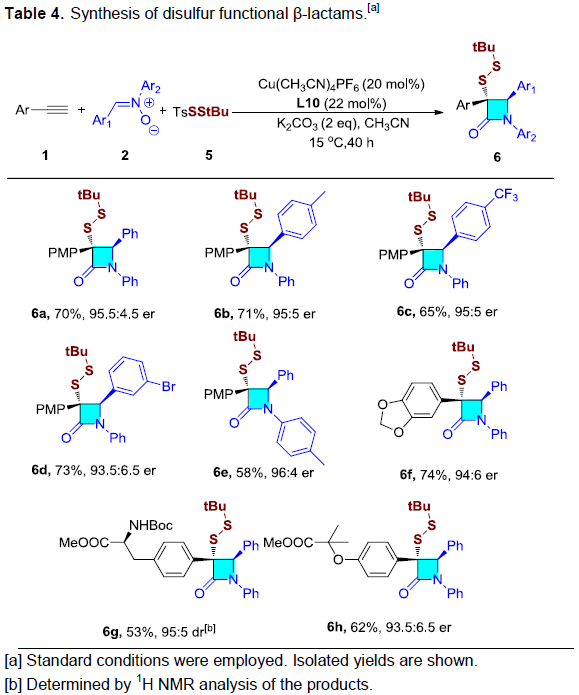
此外,二硫醚化合物广泛存在于天然产物与生物活性分子中。并且,由于其独特的结构与生物学特性,二硫醚类分子同样广泛用于食品化学、化学生物学与制药工业。对称的二硫醚可以通过硫醇的氧化偶联获得,然而,不对称二硫醚的合成仍然存在挑战。并且,迄今为止尚未实现带有β-内酰胺骨架的不对称二硫化物的合成。这里,作者通过选择适宜的二硫醚试剂5,首次实现手性β-内酰胺二硫醚的合成(Table 4)。作者进一步对之前的反应条件进行仔细优化,最终发现将催化剂与配体的用量提高一倍,并将反应温度提升至15 ℃,最终成功获得一系列β-内酰胺二硫醚类化合物6a–6h。
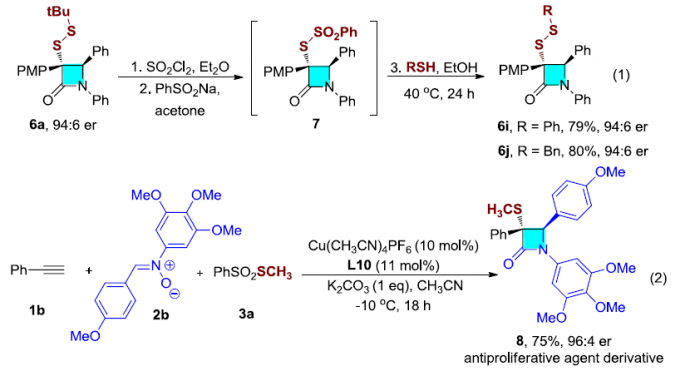
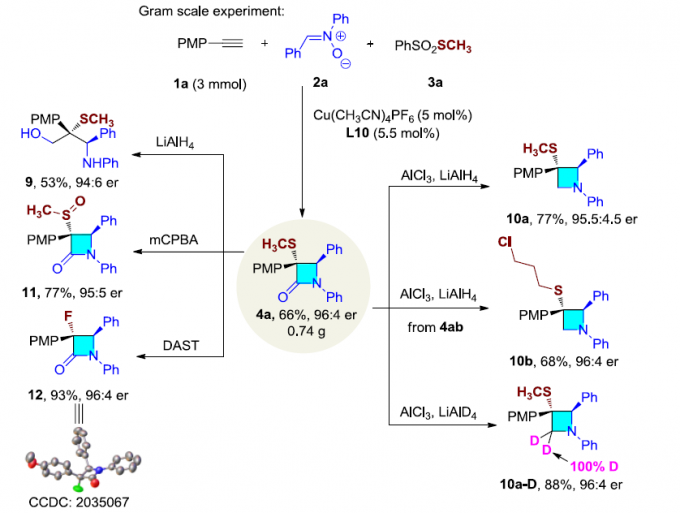
接下来,作者考察硫代官能团取代的β-内酰胺在有机合成中的进一步应用(Scheme 2)。首先,作者将二硫醚(6a)与SO2Cl2以及PhSO2Na反应形成的亲电硫内酰胺试剂(7),再与一系列硫醇反应,进而获得其它结构的的二硫醚,如6i和6j。之后,作者选用2b底物,合成出具有β-内酰胺8。此外,作者发现在克级规模的实验中,仅采用0.05 eq. 的催化剂与配体,便可获得66%收率的4a。随后,作者通过LiAlH4将4a还原,以53%的产率获得手性硫氨基醇(9)。然而,在LiAlH4还原剂中加入AlCl3,则获得手性氮杂环丁烷(10a,10b)。如果采用LiAlD4,则形成氘代手性氮杂环丁烷(10a–D)。同时,作者进一步将4a通过mCPBA氧化,则观察到生成亚砜(11);将4a加入三氟二乙氨基硫磺(DAST)处理,则形成手性α-氟代-β-内酰胺(12)。值得注意的是,在上述各类转化中,基本上未观察到对映纯度的丧失。
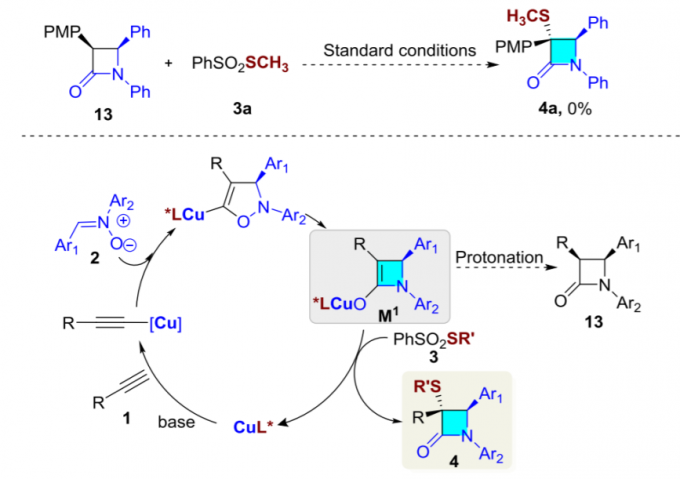
最后,作者提出可能的反应机理。首先,乙炔铜(I)与硝酮(2)经不对称环加成反应与后续的重排过程,形成关键的烯醇铜(I)中间体(M1)。加下来,与硫亲电试剂(3)进一步反应,形成产物(4),同时,使Cu(I)催化剂再生。
总结
山东大学徐政虎课题组报道了在铜(I)催化条件下,端炔、硝酮与硫亲电试剂之间的不对称三组分Kinugasa反应,获得一系列具有两个连续立体生成中心的含硫手性β-内酰胺衍生物。同时,作者通过进一步对目标产物的合成应用研究,进而证实该反应具有较高的合成应用价值。此外,该反应成功设计的关键在于采用硫亲电试剂,捕捉原位形成的烯醇铜(I)中间体(M1),进而实现上述合成转化。






















No comments yet.