本文作者:杉杉
导读
近日,北京大学深圳研究生院周建荣教授课题组在Angew. Chem. Int. Ed.上发表论文,报道了炔丙基乙酸酯、环烯烃和富电子的杂芳烃(如吲哚、吡咯、呋喃、噻吩等)的分子间三组分不对称偶联反应,获得相应的反式构型2,3-二取代的四氢呋喃和吡咯化合物,具有出色的对映选择性。
Enantioselective Three-Component Coupling of Heteroarenes, Cycloalkenes and Propargylic Acetates
ShenghanTeng, Yonggui Robin Chi, and Jianrong Steve Zhou
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202014781
正文:
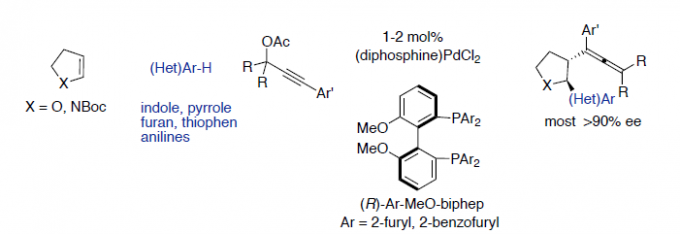
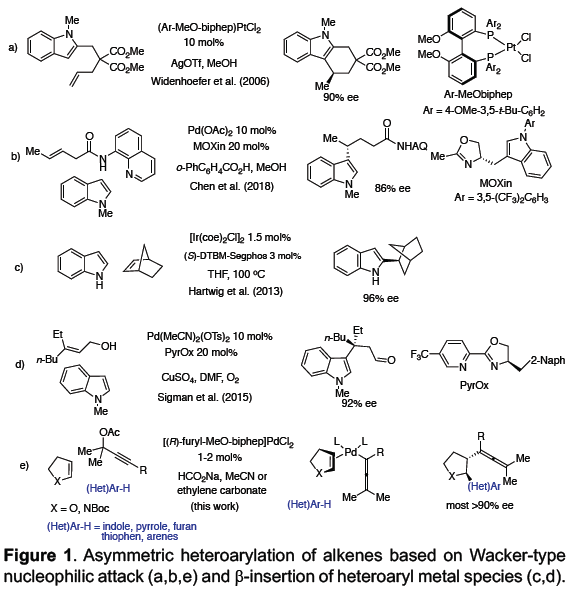
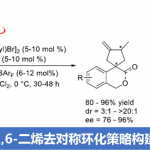
不对称Friedel-Crafts烷基化可将杂芳烃(如吲哚、吡咯等)直接引入具有价值的手性化合物中。在此类反应中,可使用多种类型的烷基化试剂(具有固有性极键),如羰基化合物、亚胺、环氧化物、烯丙基亲电子试剂和Michael受体等[1],其中一些已被用于生物活性天然产物的全合成[2]。同时,未活化烯烃也作为具有吸引力的烷基化试剂。如烯烃易被亲电金属配合物(Pt,Pd和Au)活化,引起吲哚和吡咯侧基的亲核进攻,形成5或6元环化合物(Fig 1a)[3]。但对于分子间的反应则更具挑战。最近,Chen等[4] 报道了吲哚向由N-8-喹啉基-酰胺衍生烯烃(原位钯环活化)的γ-选择性加成(Fig 1b)。若不借助导向基团或与金属中心的共价键,烯烃的不对称杂芳基化将具有难度,因为在键形成过程中控制烯烃的构象存在固有的困难。此外,低价后金属(Ni[5],Rh[6]和Ir[7])可以裂解杂芳基C-H键,然后促进侧链烯烃的不对称插入。然而,这种类型的分子间插入更具挑战性,并且例子有限。在Fe-或Co-催化的吲哚直接烷基化中,虽然实现苯乙烯的插入,但是原位生成活性低价金属催化剂需要化学计量的格氏试剂[8]。如Hartwig等[9]报道了在铱催化下,实现吲哚和杂芳烃的对映选择性烷基化,其中插入仅限于反应性双环降冰片烯等(Fig 1c)。最近,Sigman等[10]报道了在氧化Heck反应中,原位生成的吲哚基Pd配合物以良好的对映选择性进行了无环烯醇的β-插入(Fig 1d)。此外,Zhu等[11]报道了由不对称的Heck型环化反应产生的碱基和烷基钯配合物,使恶二唑和其他含有酸化C-H键的杂芳烃原位去质子化。前期,本课题组(周建荣教授课题组)[12]报道了Pd催化炔丙基乙酸酯、环烯和弱O和N亲核试剂(如醇、水和(杂)芳基胺)的对映选择性Wacker型偶联反应。在此, 作者将Wacker反应性扩展到吲哚、吡咯和一些活化的呋喃,噻吩以及一些苯胺的亲核杂芳基中,同时该三组分偶联反应无需借助导向基团,即可获得相应的反式构型2,3-二取代的四氢呋喃和吡咯化合物,具有良好的对映选择性(Fig 1e)。
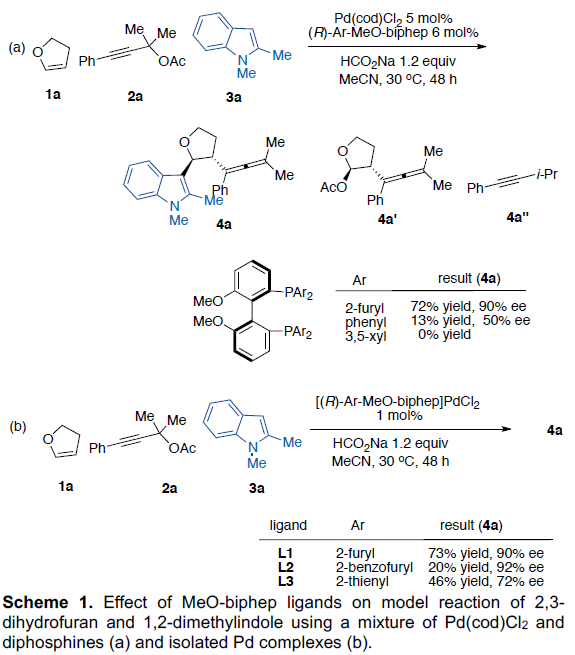
首先,作者以2,3-二氢呋喃1a,乙酸炔丙酯2a和1,2-二甲基吲哚3a作为模型反应,对常见二膦配体进行了筛选(Scheme 1)。当以Pd(cod)Cl2为催化剂,使用带有P-呋喃取代基的配体L1时,可获得72%收率和90%ee的目标产物4a。值得注意的是,当使用Pd(cod)Cl2和L1生成的配合物(L1)PdCl2时,可将催化剂的负载量降至1%,获得73%收率和90%ee的目标产物4a。
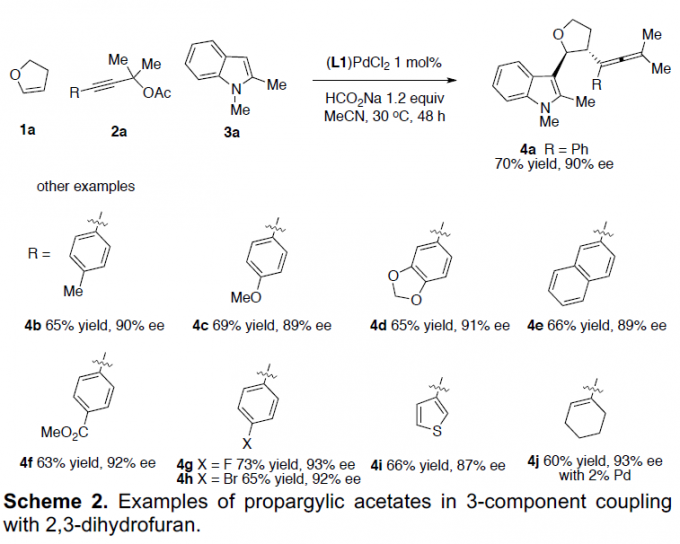
在获得上述最佳反应条件后,作者开始对不同的炔丙基乙酸酯底物1进行了扩展(Scheme 2)。反应结果表明,在乙腈溶剂中,芳环上具有给电子基(4b和4c)、吸电子基(4f)、卤素(4g和4h)以及萘基(4e)、噻吩基(4i)和环烯基环(4j),均与体系兼容。值得注意的是,若炔丙基底物中缺失两个甲基,则不能进行反应。
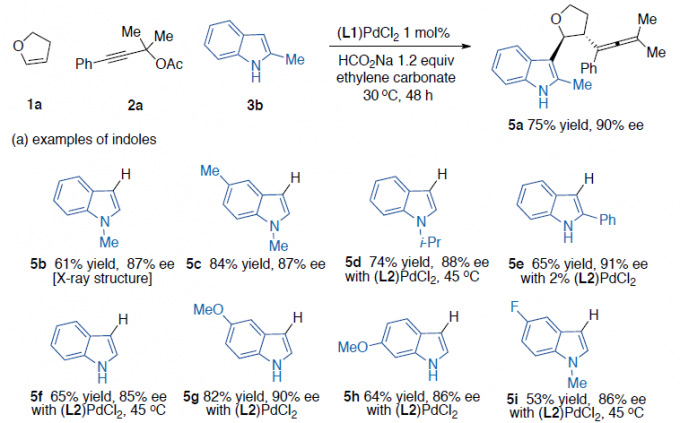
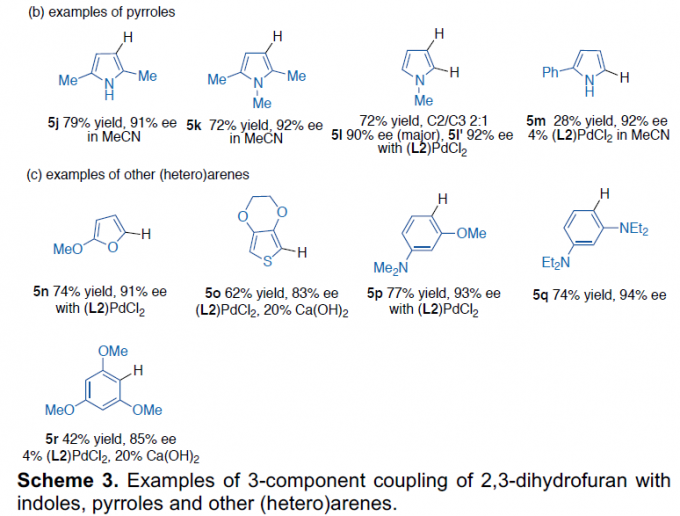
随后,作者对底物3的范围进行了扩展(Scheme 3)。反应结果表明,在碳酸亚乙酯溶剂中,具有不同N-取代以及各种芳基取代的吲哚底物,均能顺利进行反应,获得产物5b–5i。同样,对于不同取代的吡咯底物,也与体系兼容,获得产物5j–5m。值得注意的是,N-甲基吡咯的反应获得两个异构体5l和5l’(比例为2:1,ee > 90%)。然而,对于2,5-二苯基吡咯底物未能进行反应。此外,一些呋喃、噻吩、苯胺以及位阻更大的1,3,5-三甲氧基苯的底物,均可顺利反应,获得产物5n–5r。
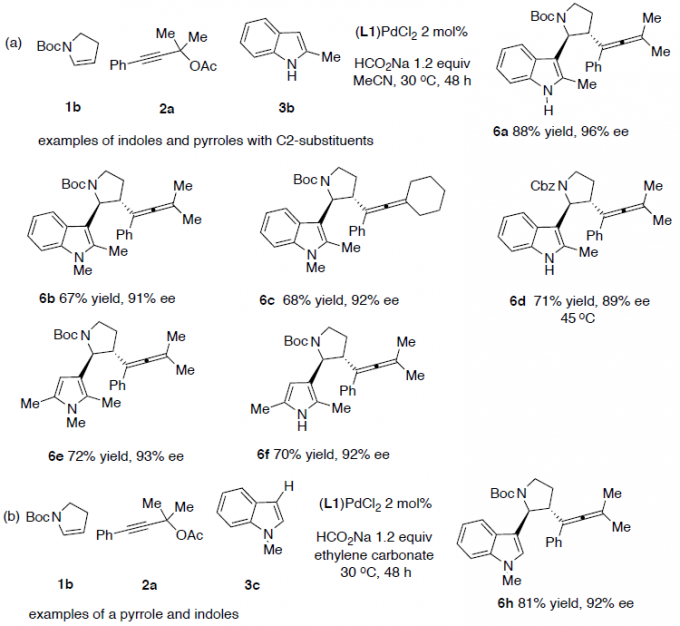
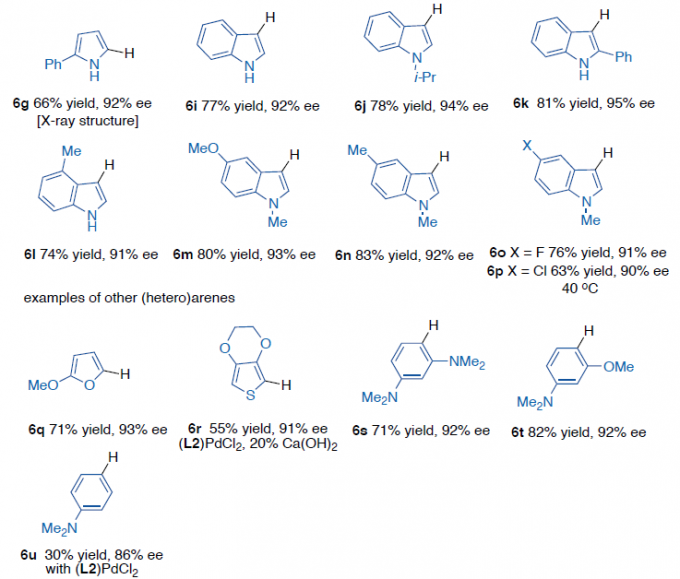
紧接着,当在乙腈溶剂中,带有C2-取代基的吲哚和吡咯均能有效地反应,生成产物6a–6f(Scheme 4a)。而对于大多数没有C2-取代基的吲哚,在碳酸亚乙酯中收率更高(Scheme 4b)。同时,2-苯基吡咯(6g)、各种取代的吲哚(6l–6p)、呋喃(6q)、噻吩(6r)、苯胺(6s–6u)也是合适的底物,均具有良好的收率。

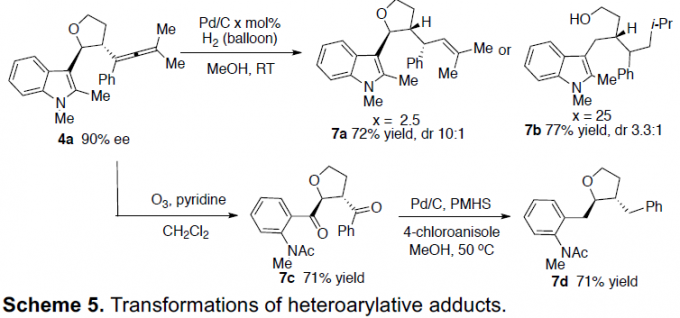
此外,作者也对产物进行了相关的后期修饰(Scheme 5)。如4a在Pd/C负载量为2.5mol%进行氢化反应时,获得产物7a,dr为10:1。若Pd/C负载量为25mol%时,不仅烯丙基被完全氢化,而且四氢呋喃环在苄基位点也被选择性裂解,得到7b。此外,4a中的烯丙基和杂环均可被臭氧裂解,得到二酮7c,再经Pd/C还原反应,可获得7d。
总结
北京大学深圳研究生院周建荣教授课题组报道了一种钯催化体系,可实现炔丙基亲电试剂、杂芳烃(如吲哚、吡咯、呋喃和噻吩等)和环烯烃的分子间三组分不对称偶联反应,获得相应的反式构型2,3-二取代的四氢呋喃和吡咯化合物,具有出色的对映选择性。值得注意的是,在无导向基团的情况下,亲核(杂)芳烃在环烯烃上的不对称Wacker型进攻可实现立体选择性的控制。
参考文献
[1] Reviews: a) M. Bandini, A. Melloni, A. Umani-Ronchi,
Angew. Chem., Int.Ed. 2004,
43, 550;
Angew. Chem. 2004,
116, 560; b) A. Erkkil, I.Majander, P. M. Pihko,
Chem. Rev. 2007,
107, 5416; c) D. W. C.MacMillan,
Nature 2008,
455, 304; d) T. B. Poulsen, K. A. Jrgensen,
Chem. Rev. 2008,
108, 2903; e) M. Terada,
Chem. Commun. 2008, 4097;f) M. Bandini, A. Eichholzer,
Angew.Chem., Int. Ed. 2009,
48, 9608;
Angew.Chem. 2009,
121, 9786; g) S.-L. You, Q. Cai, M. Zeng,
Chem.Soc. Rev. 2009,
38, 2190; h) V. Terrasson, R. Marcia de Figueiredo, J. M.Campagne,
Eur. J. Org. Chem. 2010,
2010, 2635; i) Q. Yin, Y. Shi, J.Wang, X. Zhang,
Chem. Soc. Rev. 2020,
49, 6141.
[2] a) M. M. Heravi, V. Zadsirjan, P. Saedi, T. Momeni,
RSC Adv. 2018,
8,40061; b) Z. Wang,
Molecules 2019,
24, 3412.
[3] Examples: a) X. Han, R. A. Widenhoefer,
Org. Lett. 2006,
8, 3801; b) A.R. Chianese, S. J. Lee, M. R. Gagn,
Angew.Chem., Int. Ed. 2007,
46,4042;
Angew.Chem. 2007,
119, 4118; c) C. Liu, R. A. Widenhoefer,
Org.Lett.2007,
9, 1935; d) M. Bandini, A. Eichholzer,
Angew.Chem., Int. Ed.2009,
48, 9533;
Angew.Chem. 2009,
121, 9697; e) H. Huang, R. Peters,
Angew.Chem., Int. Ed. 2009,
48, 604;
Angew.Chem. 2009,
121, 612.
[4] a) H. Wang, Z. Bai, T. Jiao, Z. Deng, H. Tong, G. He, Q. Peng, G. Chen,
J. Am. Chem. Soc. 2018,
140, 3542; b) Z. Bai, S. Zheng, Z. Bai, F. Song,H. Wang, Q. Peng, G. Chen, G. He,
ACS Catal.2019,
9, 6502.
[5] Examples: a) Y. Schramm, M. Takeuchi, K. Semba, Y. Nakao, J. F.Hartwig,
J. Am. Chem. Soc. 2015,
137, 12215; b) Y.-X. Wang, S.-L.Qi,Y.-X.Luan, X.-W. Han, S. Wang, H. Chen, M. Ye,
J. Am. Chem. Soc. 2018,
140, 5360; c) Y. Cai, X. Ye, S. Liu, S.-L. Shi,
Angew. Chem., Int. Ed. 2019,
58, 13433;
Angew.Chem. 2019,
131, 13567; d) J. Diesel, D. Grosheva,S. Kodama, N. Cramer,
Angew.Chem., Int. Ed. 2019,
58, 11044;
Angew.Chem. 2019,
131, 11160; e) J. Loup, V. Mⁿller, D. Ghorai, L. Ackermann,
Angew.Chem., Int. Ed. 2019,
58, 1749;
Angew. Chem. 2019,
131, 1763;f) N. I. Saper, A. Ohgi, D. W. Small, K. Semba, Y. Nakao, J. F. Hartwig,
Nat. Chem. 2020,
12, 276.
[6] a) R. K. Thalji, J. A. Ellman, R. G. Bergman,
J. Am. Chem. Soc. 2004,
126,7192; b) R. M. Wilson, R. K. Thalji, R. G. Bergman, J. A. Ellman,
Org. Lett.2006,
8, 1745.
[7] T. Shibata, N. Ryu, H. Takano,
Adv. Synth. Catal.2015,
357, 1131.
[8] a) P.-S. Lee, N. Yoshikai,
Org. Lett. 2015,
17, 22; b) J. Loup, D. Zell, J. C.A. Oliveira, H. Keil, D. Stalke, L. Ackermann,
Angew. Chem., Int. Ed. 2017,
56, 14197;
Angew.Chem. 2017,
129, 14385.
[9] a) C. S. Sevov, J. F. Hartwig,
J. Am. Chem. Soc. 2013,
135, 2116; b) T.Shirai, Y. Yamamoto,
Angew. Chem., Int. Ed. 2015,
54, 9894;
Angew.Chem. 2015,
127, 10032.
[10] C. Zhang, C. B. Santiago, J. M. Crawford, M. S. Sigman,
J. Am. Chem.Soc. 2015,
137, 15668.
[11] a) W. Kong, Q. Wang, J. Zhu,
J. Am. Chem. Soc. 2015,
137, 16028; b) X.Bao, Q. Wang, J. Zhu,
Angew. Chem., Int. Ed. 2017,
56, 9577;
Angew.Chem. 2017,
129, 9705; c) S. Tong, A. Limouni, Q. Wang, M.-X. Wang, J.Zhu,
Angew. Chem., Int. Ed. 2017,
56, 14192;
Angew. Chem. 2017,
129,14380.
[12] S. Teng, Z. Jiao, Y. R. Chi, J. S. Zhou,
Angew. Chem., Int. Ed. 2020,
59,2246;
Angew.Chem. 2020,
132, 2266.

































No comments yet.