本文投稿作者 alberto-caeiro
“Unified Total Synthesis of Madangamines A, C, and E”
Suto, T.; Yanagita, Y.; Nagashima, Y.; Takikawa, S.; Kurosu, Y.; Matsuo, N.; Sato, T.; Chida,
J.Am. Chem. Soc. 2017, 139, 2952.DOI: 10.1021/jacs.7b00807
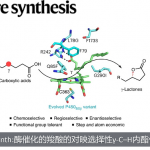
在此工作中,作者完成了Madangamine类生物碱A, C, E的全合成,并开发了二烯烃的硼氢化反应与stille偶联反应的联用合成skipped dienes的新型方法。
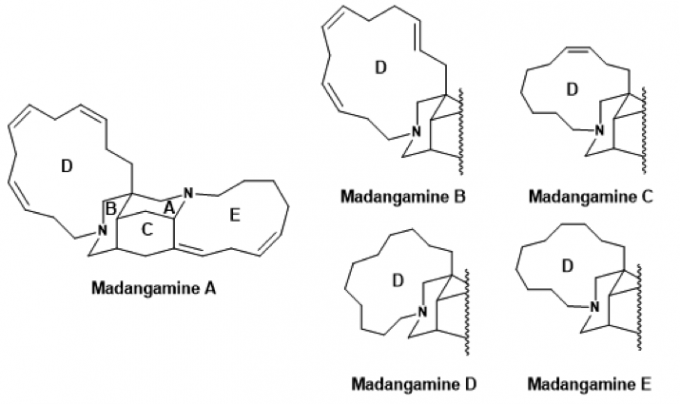
1994年Andersen课题组报道了第一例Madangamine类生物碱并成功分离[1]。这类生物碱是由巴布亚新几内亚的马当省(Madang, Papua New Guinea)一处海滩的海绵中提取出来,它们有共同的ABCE四环,但其D环有一定差异。Andersen也报道了Madangamine A对癌细胞有一定的细胞毒性,而在近期,首例人工全合成得到的Madangamine D也被测得有一定的抗癌作用[2]。
在之前的工作中,针对ABCE四环的合成工作有很多的报道,并且形成了一整套有效的合成方法。但如何立体选择性的合成skipped dienes一直有效的解决。作者通过Z-选择性的硼氢化反应和Z-烯丙基锡烷的stille偶联反应,高效的合成了需要的skipped diene,这也是本篇全合成工作中的一大亮点。
本篇全合成工作是由庆应义塾大学的千田教授课题组完成,以下为千田教授的介绍:
研究者:千田憲孝
个人经历:
1979 研究生, 庆应义塾大学(須網 哲夫教授)
1984 博士, 东北大学 (吉越 昭教授)
1984–1987 中央研究所研究員
1987 助教, 庆应义塾大学
1988–1989 博士研究員, 宾西法尼亚大学(Amos B. Smith教授)
1992 讲师, 庆应义塾大学
1995 副教授, 庆应义塾大学
2003– 教授, 庆应义塾大学
研究内容:天然物的全合成研究(照片引自实验室主页)
论文概要
- 合成分析
观察Madangamine类生物碱,作者发现它们可以由共同的前体17得到。前体17可以由前体12先经过N-阳离子环化反应得到前体13,再经过硼氢化反应和stille偶联反应得到含有skipped diene的前体16,16再脱Boc后,经分子内酰胺化反应和脱TIPS保护基后得到前体17。其中前体12的合成,作者在2015年有过关于此的工作[3]。
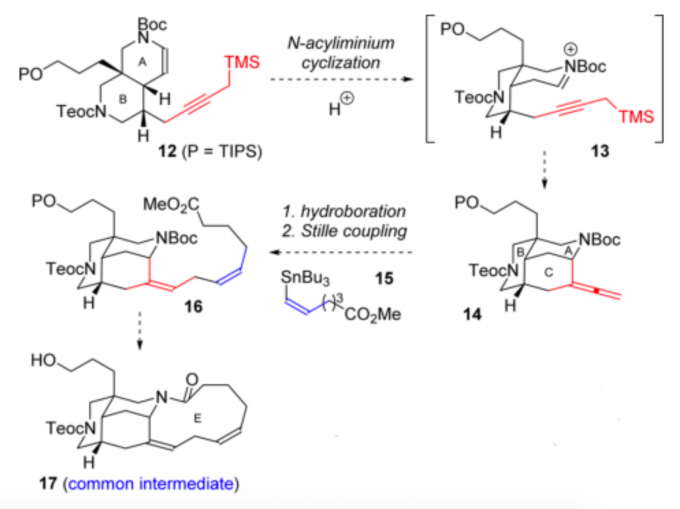
图2:前体17合成分析
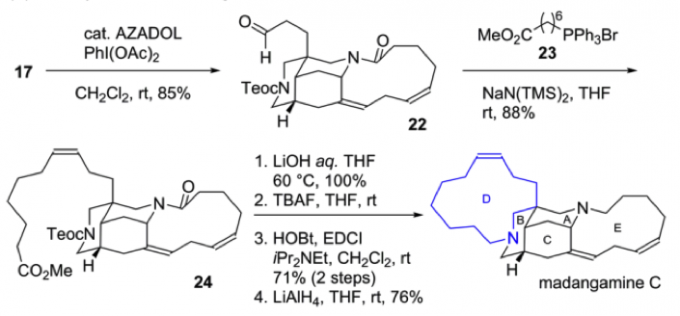
在Madangamine C的全合成中,前体17首先发生Iwabuchi oxidation将羟基氧化成醛基得前体18;接着与中间物23发生Witting反应生成顺式烯烃24;再经酯水解和脱Teoc保护基后,发生分子内的大环内酰胺化反应,最后在LiAlH4的作用下,还原分子内的两个内酰胺键得到天然产物Madangamine C。
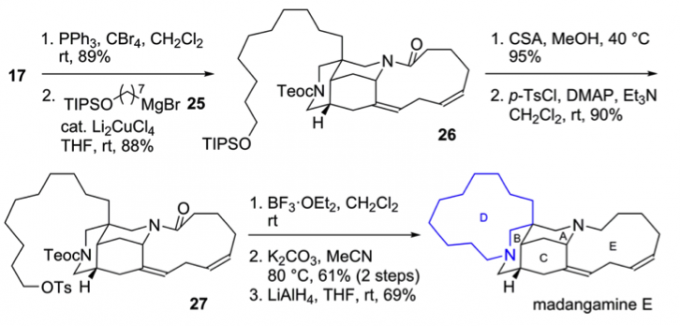
在Madangamine E的全合成中,因其饱和的D环没有功能导向基如Madangamine C中的顺式烯烃,在Madangamine C的条件下发生大环化反应时,主要生成分子间的环化反应。于是,作者直接经过大环烷基化反应,7步实现了Madangamine E的合成。首先用溴取代羟与格式试剂发生SN2反应得前体26,再将TIPS保护基换成Ts保护基,后脱Boc保护基发生大环内烷基化反应,最后还原酰胺键得Madangamine E。
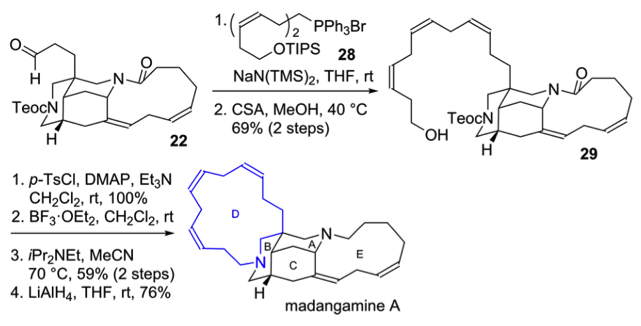
在Madangamine A的全合成中,前体22先与28发生Witting反应生成前体29。但在之前,并没有关于skipped dienes大环化反应的报道,而一般的大环内酰胺化反应中,在将羟基氧化成羧基时,会使skipped dienes化合物29发生大量的分解。作者随后发现大环烷基化对在这里也能够有很好的应用。先将羟基转化为磺酸基保护,后经脱Boc保护基和大环化反应,共两步以59%的产率得到环化产物,随后得到天然产物Madangamine A。
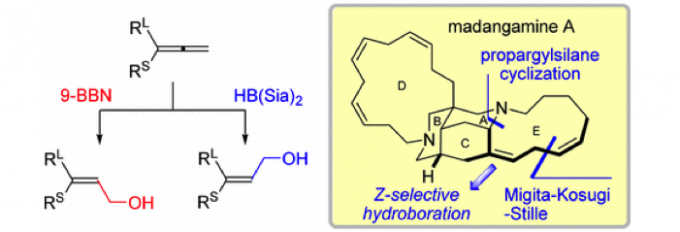
- Skipped dienes的合成
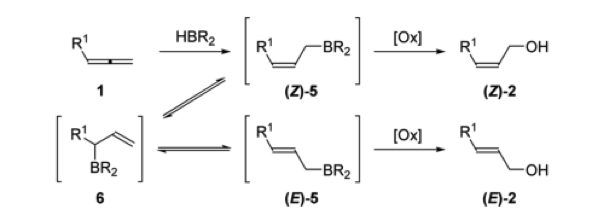
在Brown的报道中,在9-BBN的存在下,丙二烯的硼氢化氧化会得到热力学稳定的E-烯丙基醇[4];而Roush课题组随后报道了,通过调节硼试剂,可得到动力学稳定的Z-烯丙基醇[5]。于是,作者通过丙二烯硼氢化氧化后得到的立体特异的烯丙基醇和烯丙基锡烷试剂发生stille反应[6],高选择性高收率的得到skipped dienes。
总结
综上所述,作者通过硼氢化反应和stille偶联反应的联用,简单高效的合成了四种skipped diene;通过15步转化率高于80%的反应,合成了环骨架前体18;再结合后续的大环烷基化反应,首次合成了Madangamine A, C, E,各10.3,6.3,3.9mg,以用于生物活性研究。
这是小编第一次介绍全合成工作,学习之余也不禁感叹化学的神奇,简单的反应,也能发挥出神奇的作用。没有做不出的反应,只有做不出反应的人。抖机灵一句,送给从事有机合成的各位及自己,也希望各位都能做出高水平的工作!
参考文献
[1]: Kong, F.; Andersen, R. J.; Allen, T. M. J. Am. Chem. Soc. 1994,116,6007. DOI: 10.1021/ja00092a077 [2]: Ballette,R.; Pérez,M.; Proto,S.; Amat,M.; Bosch, J. Angew. Chem., Int. Ed. 2014, 53, 6202. DOI: 10.1002/anie.201402263 [3]: Yanagita, Y.; Suto, T.; Matsuo, N.; Kurosu, Y.; Sato, T.; Chida, N. Org. Lett. 2015, 17, 1946. DOI: 10.1021/acs.orglett.5b00661 [4]: Brown, H. C.; Liotta, R.; Kramer, G. W. J. Am. Chem. Soc. 1979, 101, 2966. DOI: 10.1021/ja00505a025 [5]: Kister, J.; DeBaillie, A. C.; Lira, R.; Roush, W. R. J. Am. Chem. Soc. 2009, 131, 14174. DOI: 10.1021/ja905494c [6]: Castaño, A. M.; Echavarren, A. M. Tetrahedron Lett. 1996, 37, 6587. DOI: 1016/0040-4039(96)01406-2
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.