本文投稿作者 孙苏赟
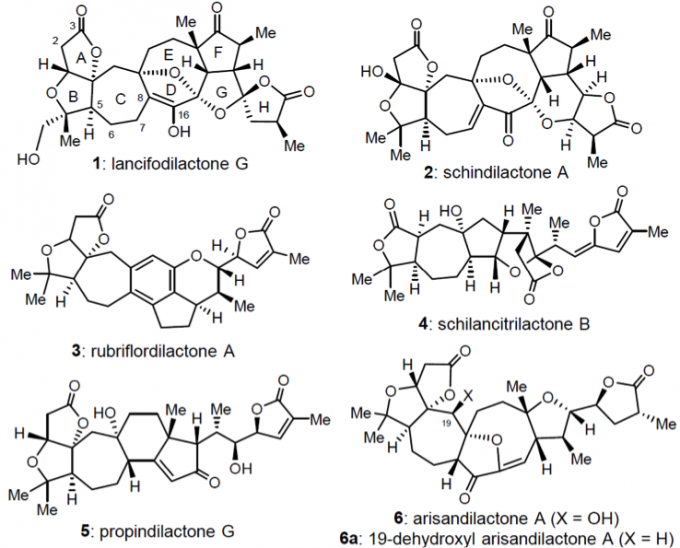
Lancifodilacton G是2005年从狭叶五味子中提取出来的三萜类化合物,之后通过X-光晶体衍射确定了其结构。五味子萜类化合物有很多种,如图1中1-6所示,他们具有抗肝炎、抗癌和抗艾滋病等生物特性,因此这类化合物的合成吸引了有机合成化学家的注意力。在这里插一句题外话,前些年李昂课题组完成了其中rubriflordilactone A(3)/B的全合成工作,也是小编我非常喜欢的全合成工作之一,其中的6π-电环化/芳香化是合成工作的亮点。
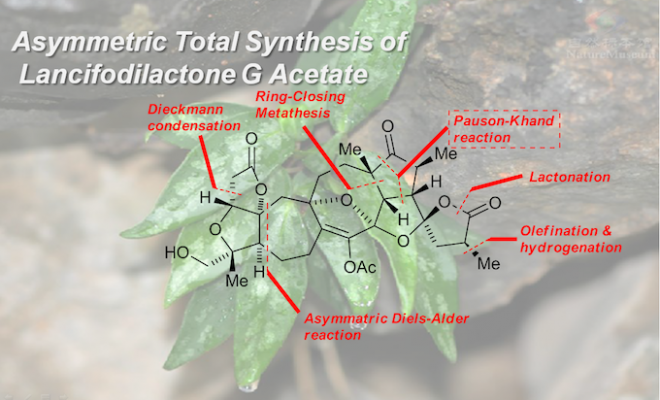
近期,北京大学/北京大学深圳研究生院的杨震教授团队发表了一篇JACS,报道了对三萜类化合物lancifodilacton G的醋酸酯的全合成工作。
Asymmetric Total Synthesis of Lancifodilactone G Acetate
Dong-Dong Liu, Tian-Wen Sun, Kuang-Yu Wang, Yong Lu, Su-Lei Zhang, Yuan-He Li, Yan-Long Jiang, Jia-Hua Chen, and Zhen Yang, J. Am. Chem. Soc., Articles ASAP (As Soon As Publishable), DOI: 10.1021/jacs.7b02561
其分子结构非常有特点:
(1) CD环之间有很罕见的非共振致稳定的脂肪族烯醇结构片段;
(2) 高度紧密的FGH三环结构,并且在FGH三个环中有6个连续的手性中心(三个环中共7个手性中心);
(3) 不常见的稳定的异端双螺环结构。
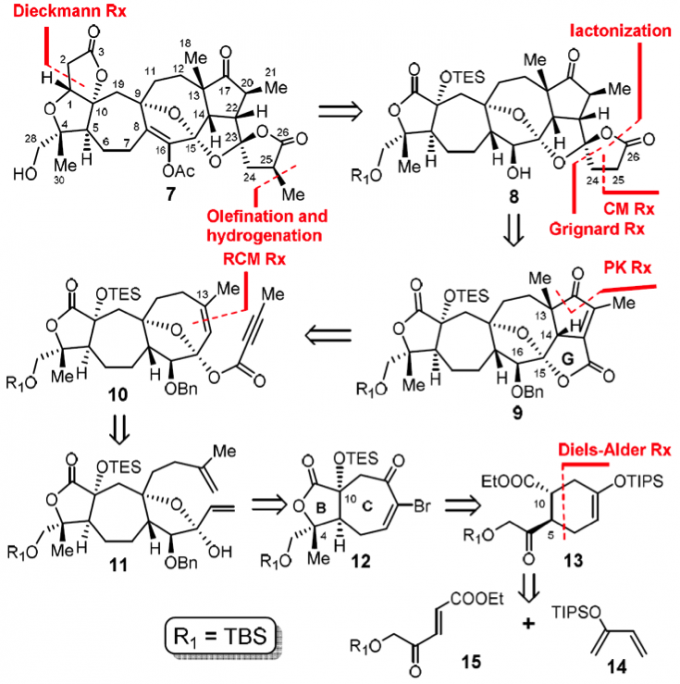
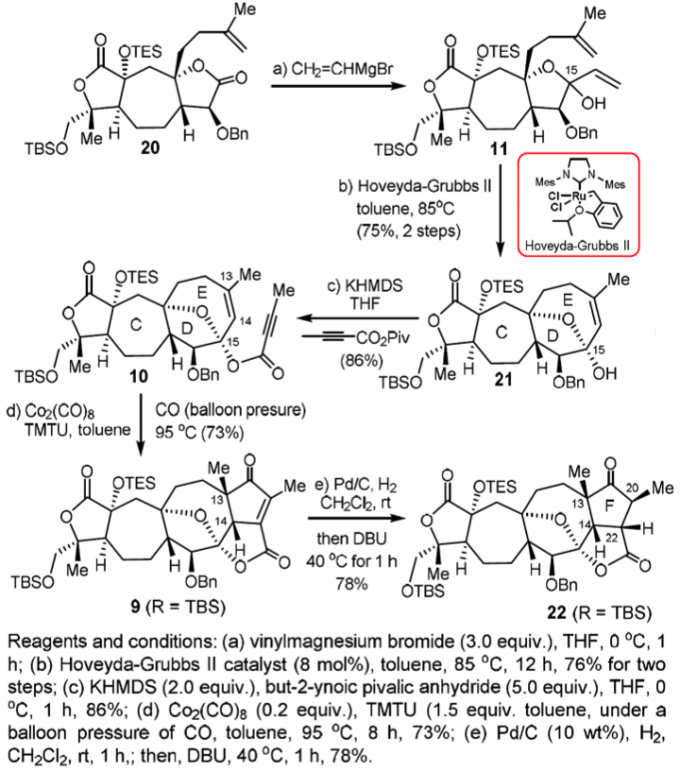
在合成中,因为一些原因而难以得到C16的烯醇化合物,进而考虑将其形成醋酸烯醇酯7,其原因在稍后有描述,逆合成分析如Scheme 1所示,其中构筑高度紧密的FGH三环和CDE三环是合成的主要难点。合成中的关键步骤是烯烃复分解反应(Ring-Closing Metathesis, RCM)和Pauson-Khaud(P-K)反应,用这个方法他们分别构筑了D、E环和H、G环。
合成线路:
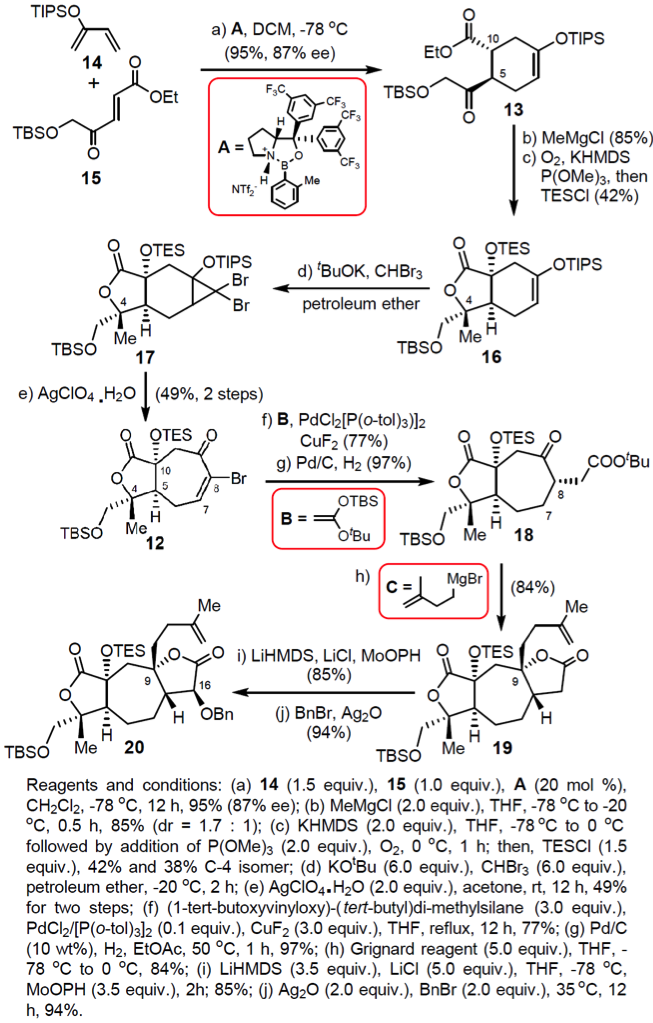
合成的第一步就是一个非常精彩的由恶唑硼烷催化的高立体选择性的(e.e.=87%)不对称Diels-Alder,这一步可以得到约100 g的产物,这为接下来的合成工作打下了坚实的基础。作者为了这个选择性的D-A反应开发了一个方法学,起初这个方法学是由MacMillan团队之前的一例不对称D-A环加成开发2,杨震教授团队的这个方法学是受这个工作启发的。之后从13出发利用KHMDS形成烯醇盐,O2/P(OMe)3进行氧化3,在酯羰基的α-位得到了硅醇酯化合物16。之后强碱tBuOK和CHBr3生成卡宾和六元环上双键发生[2+1]生成二溴取代的三元环并六元环,在银盐的作用下脱溴扩环得到具有七元C环的化合物12。在Pd络合物作用下和烯醇硅醇醚B发生类似Heck反应,加氢还原之后得18;其中CuF2有利于脱去TBS而生成烯醇进行交叉偶联反应。之后18和Grignard试剂进行加成得到立体专一的19,这其中Grignard试剂和羰基加成正常氧负离子,进而进攻ester形成lactone,这是一个串联反应;之后19在LiHMDS烯醇化和MoOPH的氧化下得到了D环上酯的α-醇4,这样在Ag2O的作用下和BnBr和刚刚生成的醇发生SN2形成苄醚,这样重要中间体之一的20即得到了。
这里说明一下18和19的烯醇盐两个化合物的立体结构导致的较高的选择性,构型分析如Fig 2所示:
如Schm 3所示,得到20后继续使用Grignard试剂再次利用分子结构本身的选择性得到立体专一行较高的11(两个异构体比例5:1),这样接下来就利用Hoveyda-Grubbs II催化剂进行烯烃复分解反应得到E环(21)了。其中Grubbs I/II催化剂都不能发生关环反应,只有Hoveyda-Grubbs II催化剂可以。
接下来就是为整个合成路线的重头戏P-K反应做准备了,为了使底物具有三键,在碱的处理下使得C15-醇形成醇盐进而和混酐反应得到10,这样在TMTU和Co2(CO)8、CO的条件下即可以发生P-K反应生成F、G环,也就是六环化合物9。之后在Pd/C的作用下进行加氢反应,因为位阻的原因可以得到C20正确的构形,但是产物中的C22的构形是不正确的,因此使用DBU使得这个酯的α-位的碳的构形达到热力学平衡,也就是正确的C22的构形。至此,又一重要中间体22也得到了。
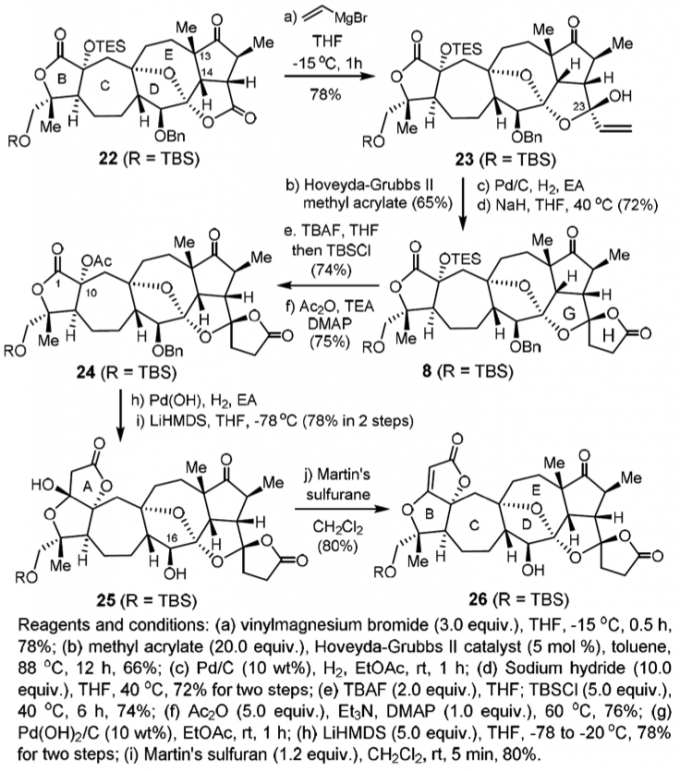
为了构筑二螺环体系,需要进行以下三部来得到H环:选择性的乙烯基化;分子间的和MMA的烯烃复分解反应和Pd催化的氢化和串联的内酯化反应,这样即可以得到8,用TBAF对8进行选择性脱保护基再进行酯化,脱去C10上的保护剂有利于接下来的酯化反应。之后加氢脱去苄醚保护基,再用碱催化进行Dieckmann缩合得到A环,此时利用脱水剂进行脱水化得到26。
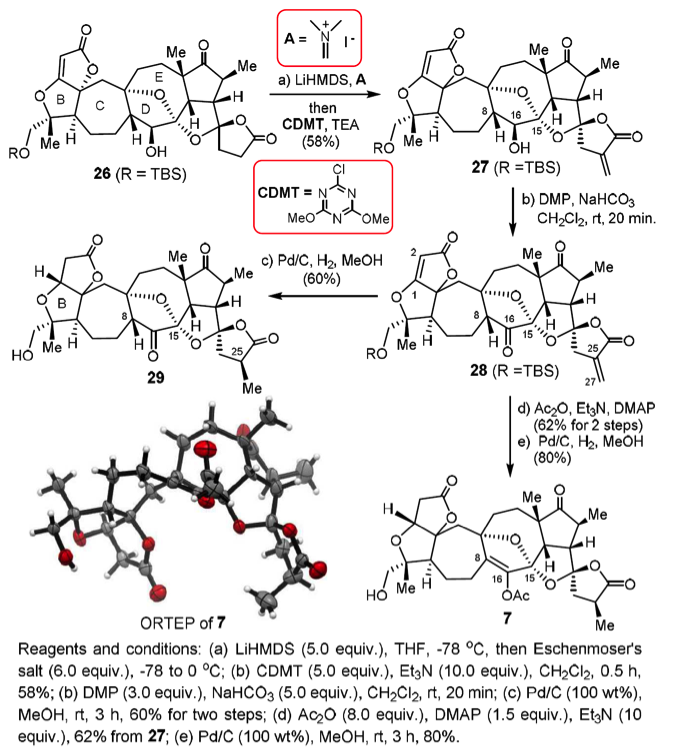
至此,关键中间体26已经得到了,再利用Eschenmoser试剂配合CDMT使用可在H环羰基的α-位添加一个环外双键5。
在完成了这么复杂的分子骨架的构建之后,剩下最后一步就是是引入烯醇片段了。杨震教授团队发现,在有水存在时,烯醇上的氢原子可能和G环中的氧形成氢键,这样是有利于酮向戏醇的转变和稳定的。于是利用DMP对27进行氧化得到了不稳定的中间体28,将28进行氢化即可得到29,但是尝试将29转化为烯醇时却屡次不成功,结果通常是直接发生了分解。于是他们便考虑先将28转化成烯醇酯之后再将H环上的双键加氢催化得到甲基,这样Lancifodilacton G的醋酸酯7的全合成就完成了。
总的来看,着个全合成路线中使用的反应大多数是非常简单初级的反应,但是大牛还是可以把简单的反应玩出花。合成中的亮点有:
- 多次使用Grignard试剂/RCM来构筑分子中的大环的结构
- 巧妙地利用分子本身结构的性质实现Grignard试剂和羰基发生加成时较好的立体选择性;
突然忆起,杨震教授曾经在有机合成大牛K.C.Nicolaou的实验室工作过,小编看来这个合成工作还有K.C.Nicolaou教授的影子呢。
这是小编第一次写稿,也是第一次介绍全合成工作,学习之余也不禁感叹化学的神奇,有机化学的千变万化可能就是是热爱有机的人对她如此痴迷的原因吧。简单的反应,也能发挥出神奇的作用,也能在创造性思维下玩出花来。化学的发展、科学的发展是无止境的,是需要一代又一代化学人的无私的奉献的。
参考文献
- Dong-Dong Liu, Tian-Wen Sun, Kuang-Yu Wang, Yong Lu, Su-Lei Zhang, Yuan-He Li, Yan-Long Jiang, Jia-Hua Chen, and Zhen Yang, Am. Chem. Soc., Articles ASAP (As Soon As Publishable), DOI: 10.1021/jacs.7b02561
- B. Northrup, D. W. C. MacMillan, J. Am. Chem. Soc. 2002, 124, 2458,
- Corey, E.; Ensley, H. E. Am. Chem. Soc. 1975, 97, 6908
- Vedejs, E.; Engler, D. A.; Telschow, J. E. Org. Chem. 1978, 43, 188
- Yamada, K.; Masaki, K.; Hagimoto, Y.; Kamiya, S.; Kunishima, M. Tetrahedron Lett. 2013, 54, 1758
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.