具有梯形骨架的脂质人们称为梯状磷脂Ladderane Phospholipid,最近有化学家报道了利用双环己烷bicyclohex[2.2.0]ene 骨架在光环化反应条件下发生二聚成键,这一反应可以作为一种高效人工合成方法。
连续的环丁烷环的构建方法
梯状脂质(Ladderane Lipid)是一类由环丁烷的环结构呈梯状“堆积”而得的化合物群,它们是在厌氧氨氧化(Anamox)细菌的膜脂质中发现的一类分子,也因其功能、独特的化学结构而受到生物学家和化学家的关注。
关于该分子群的生物合成,虽然已经提出了一些可能的生物合成路线方案,但是目前还没有被确证。通过培养细菌来制备的话,由于和其它酯类分离比较困难,该研究一直停滞不前,人们一直在期待能得到纯的梯状脂质。
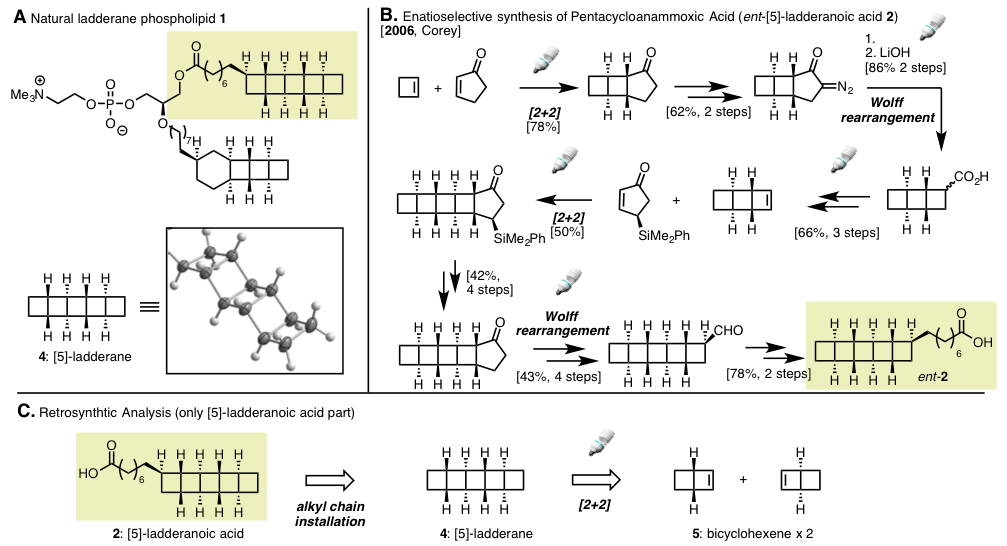
具有膦酸部分的梯状磷脂Ladderane Phospholipid1类化合物是这类分子群中最复杂的分子之一(Scheme 1A)。迄今为止,Corey等人是唯一报道过化合物1的局部结构[5]-ladderanoic acid (2)的优化合成方法 (Scheme 1B)[1]。
Corey等人通过环丁烷和环戊烯酮的[2+2]光环化反应,加筑一个环丁烷环之后,在环戊酮一侧导入重氮基,通过Wolff重排得到缩环产物,从而得到3个连续的环丁烷环。之后,再重复这几步过程,最后通过侧链的延长成功完成不对称合成,得到化合物2。
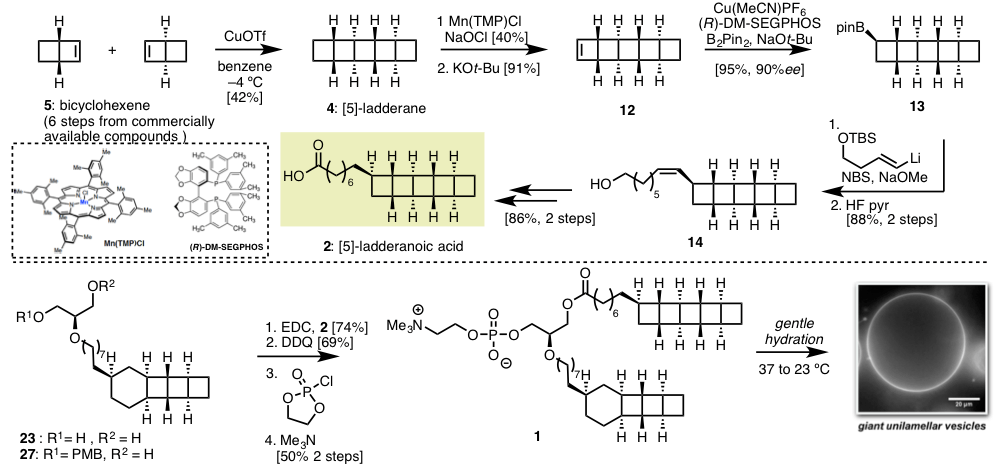
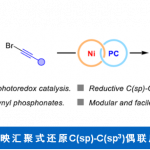
最近、由美国斯坦福大学的Burns助教等人,开发了相比2更为高效的合成方法,尝试了化合物Ladderane Phospholipid1的不对称合成(Scheme 1C)。关键反应是以化合物 5 bicyclohex[2.2.0]ene 作为最小单元在光照条件下发生[2+2]环化反应。
“Chemical Synthesis and Self-Assembly of a Ladderane Phospholipid”
A. M. Mercer, C. M. Cohen, S. R. Shuken, A. M. Wagner, M. W. Smith, F. R. Moss III, M. D. Smith, R. Vahala, A. Gonzalez-Martinez, S. G. Boxer and N. Z. Burns, J. Am. Chem. Soc. 2016, ASAP DOI: 10.1021/jacs.6b10706
论文作者的介绍

研究者:Noah Z. Burns
研究者的经历:
2004 B.A. Columbia University
2009 Ph.D. The Scripps Research Institute (Prof. Phil S. Baran)
2009 NIH postdoctoral fellow, Harvard University, USA (Professor Eric Jacobsen)
2012- Assistant Professor at Stanford University
研究内容:卤化反应的开发・生物活性物质的全合成
论文的概要
由上所述,由最小单元的双环己烷环的二聚,一举轻松构建[5]-ladarane骨架结构(Scheme 2)。这样的合成的关键点:
- 发现了最小单元的二聚反应的最佳反应条件
- 对于构筑所得的梯状结构4,导入了烷基链(去对称化)
这两个关键点中,第一点,铜催化剂催化的[2+2]光环化反应[2],能够以42%的收率得到二聚体4,反应在-4℃进行,比溶剂苯的熔点还低,却能使反应收率大幅增加这一点很值得大家思索。
第二点,用锰催化的C-H键卤化反应,消去反应得到环丁烯后,不对称硼氢化、串联的偶联反应,能够以很高的光学活性导入侧链。直接通过不对称碳碳键反应导侧链虽然更简便, 但通过巧妙运用C-H键活化反应和不对称硼氢化条件,也是很好的而一个反应实例。
合成的详细步骤请参见论文,作者们最终成功实现了化合物1的不对称合成,并利用1来形成单层囊泡膜,由于合成了纯的梯状脂质,该类物质在生物学中研究进展也指日可待。
参考文献
- (a) Mascitti, V.; Corey, E. J. Am. Chem. Soc. 2004, 126, 15664. DOI: 10.1021/ja044089a (b) Mascitti, V.; Corey, E. J. J. Am. Chem. Soc. 2006, 128, 3118. DOI: 10.1021/ja058370g
- Salomon, R. G.; Kochi, J. K. Am. Chem. Soc. 1974, 96, 1137. DOI: 10.1021/ja00811a030
- Liu, W.; Groves, J. T. Am. Chem. Soc. 2010, 132, 12847. DOI: 10.1021/ja105548x
- Guisań-Ceinos, M.; Parra,A.;Martín-Heras, V.; Tortosa, M. Chem., Int. Ed.2016, 55, 6969. DOI: 10.1002/anie.201601976
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.