作者:杉杉
导读:
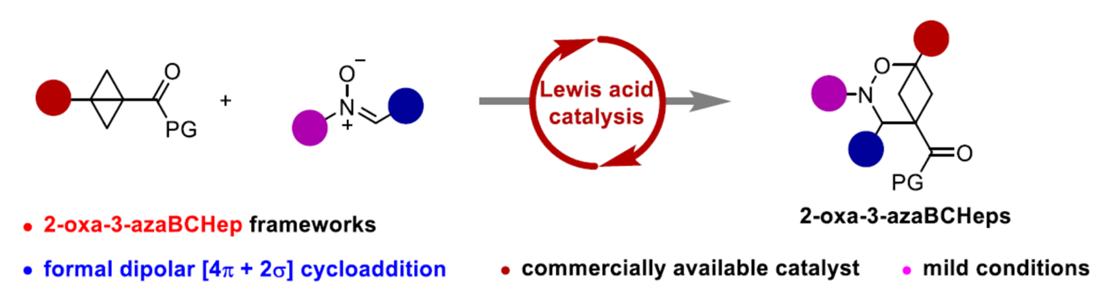
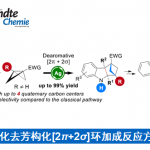
近日,浙江师范大学的邓卫平等人在Angew. Chem. Int. Ed.中发表论文,首次报道一种全新的Eu(OTf)3-催化bicyclo[1.1.0]butanes (BCBs)与硝酮的formal dipolar [4π+2σ]环加成反应方法学,进而成功完成一系列多取代的2-oxa-3-azabicyclo[3.1.1]heptanes (2-oxa-3-azaBCHeps)分子的构建。
Eu(OTf)3-Catalyzed Formal Dipolar [4π + 2σ] Cycloaddition of Bicyclo-[1.1.0]butanes with Nitrones: Access to Polysubstituted 2-Oxa-3-azabicyclo[3.1.1]heptanes
J. Zhang, J. Su, H. Zheng, H. Li, W. Deng, Angew. Chem. Int. Ed. 2024, ASAP. doi: 10.1002/anie.202318476.
正文:
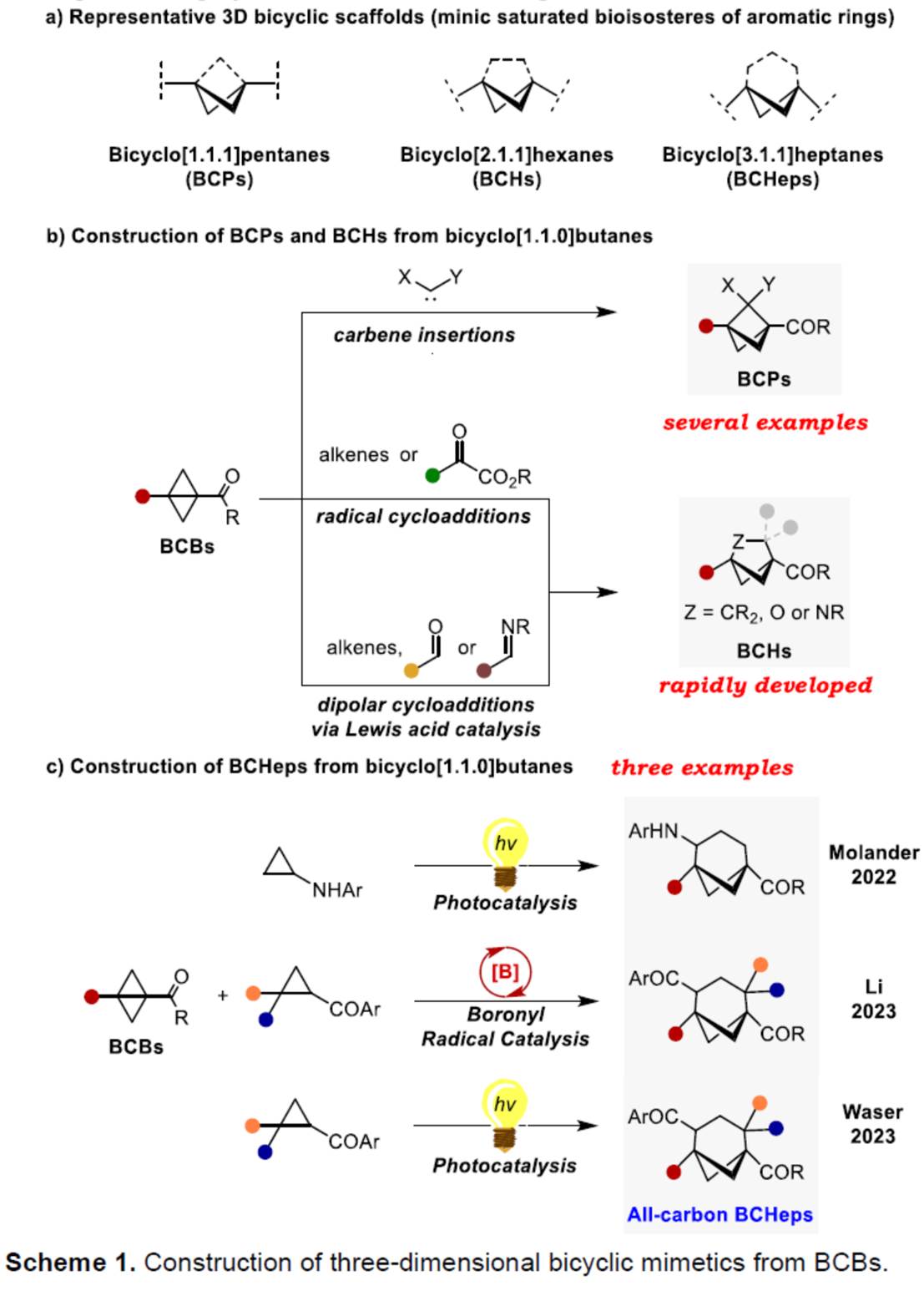
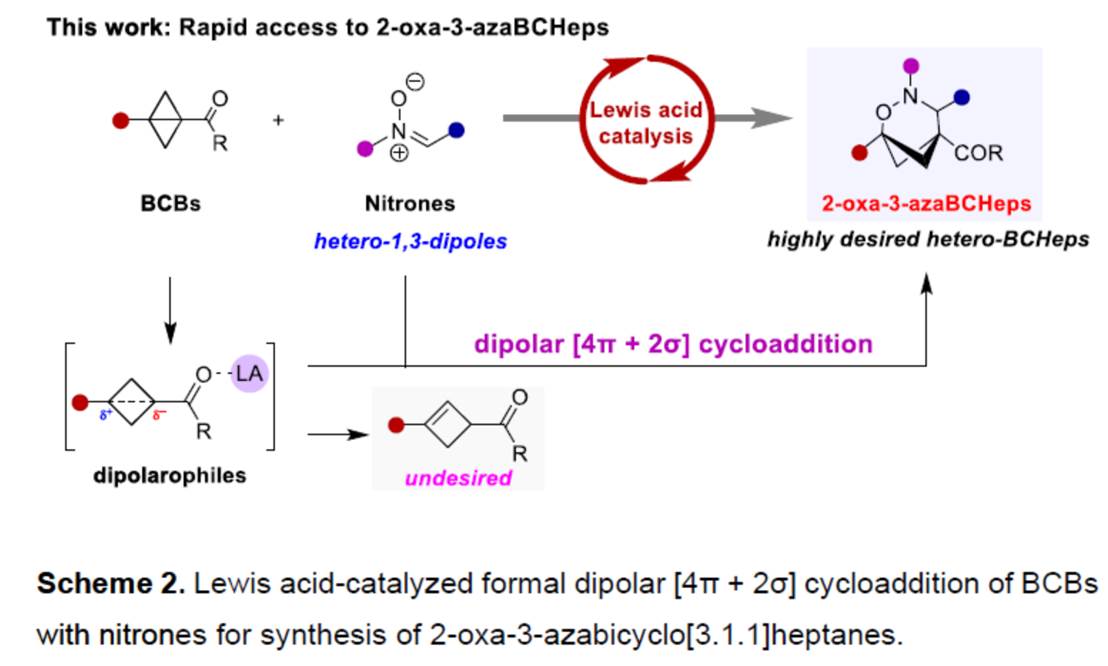
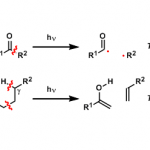
Bicyclo[1.1.1]pentanes (BCPs)、bicyclo[2.1.1]-hexanes (BCHs)与bicyclo[3.1.1]heptanes (BCHeps)骨架作为取代芳环的bioisosteric replacements,具有独特的生物活性、代谢特征和物理化学特征 (Scheme 1a)。并且,在过去的几十年里,已经成功设计出多种利用bicyclo[1.1.0]butanes (BCBs)构建BCPs与BCHs分子的合成转化策略[1] (Scheme 1b)。然而,利用BCBs构建BCHeps分子的反应方法学,目前却较少有相关的研究报道[2] (Scheme 1c)。受到近年来对于偶极环加成反应方法学[3]以及硝酮用于合成N,O-杂环分子反应方法学[4]相关研究报道的启发,这里,浙江师范大学的邓卫平等人首次报道一种全新的Eu(OTf)3-催化BCBs与硝酮的formal dipolar [4π+2σ]环加成反应方法学,进而成功完成一系列多取代的2-oxa-3-azabicyclo[3.1.1]heptanes (2-oxa-3-azaBCHep)分子的构建 (Scheme 2)。
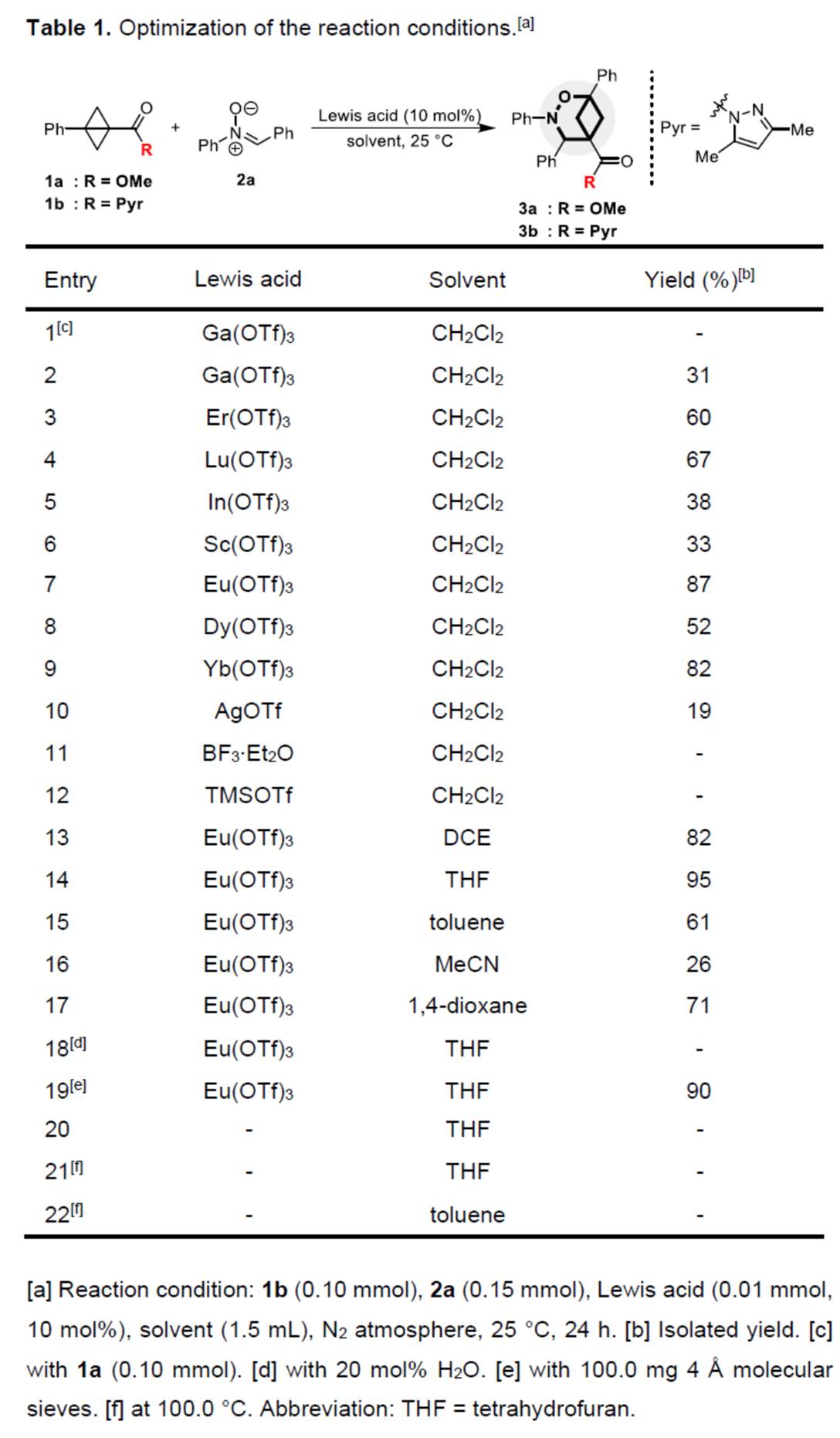
首先,作者采用BCBs 衍生物1b与硝酮衍生物2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Eu(OTf)3作为催化剂,在THF反应溶剂中,反应温度为25oC,最终获得95%收率的产物3b。
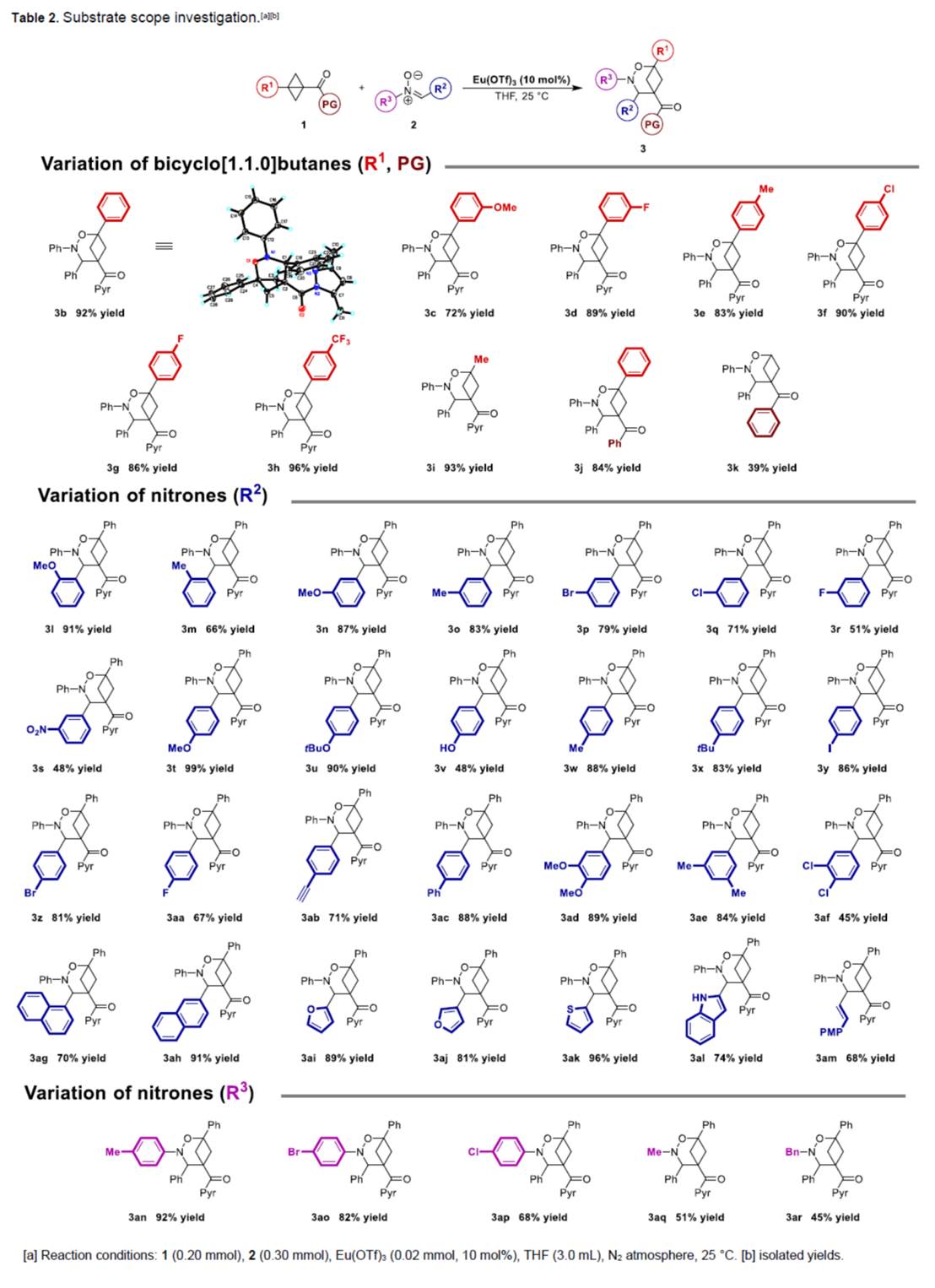
在上述的最佳反应条件下,作者分别对一系列BCBs 衍生物1与硝酮衍生物2的底物 (Table 2)应用范围进行深入研究。

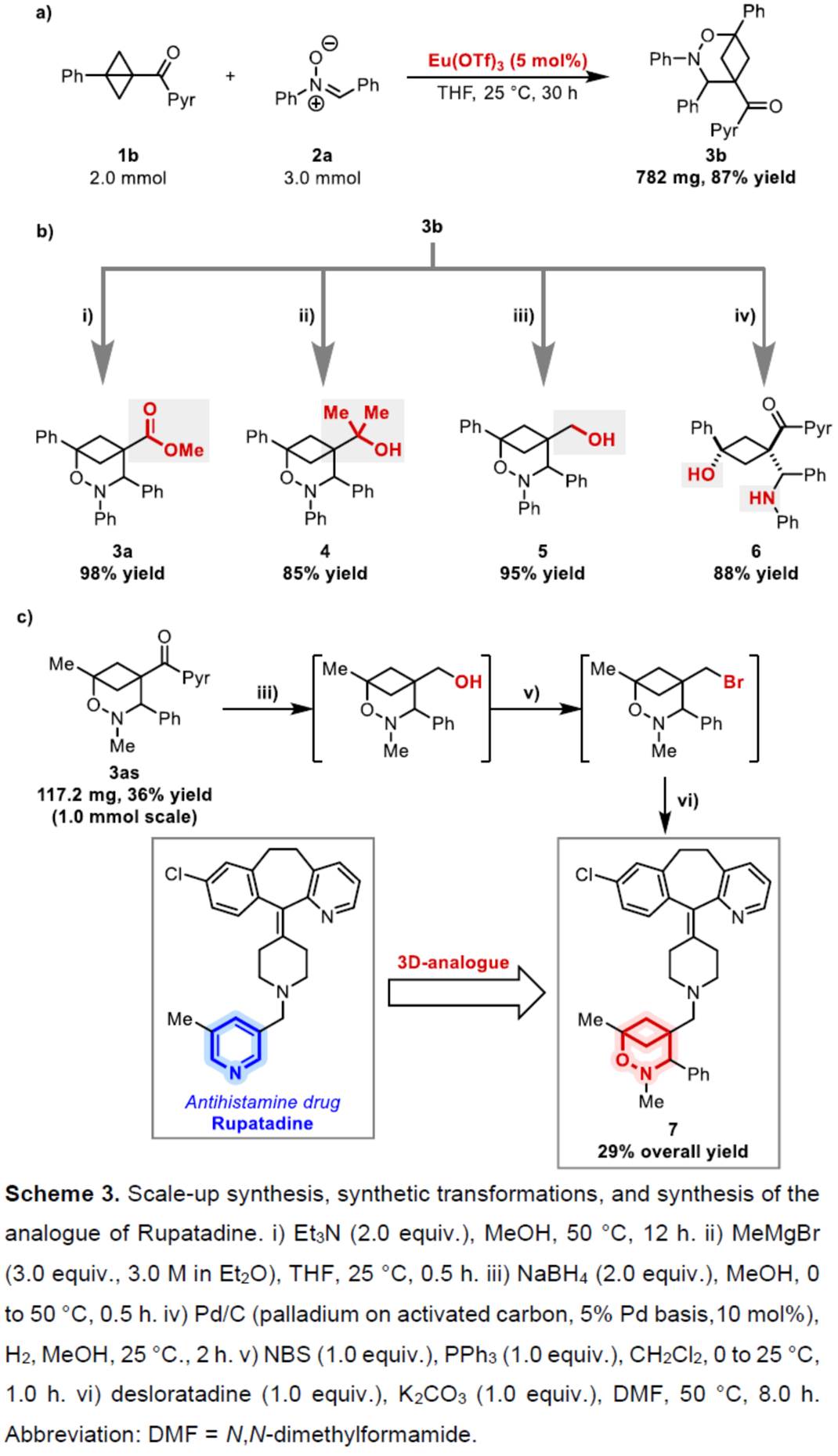
之后,该小组通过如下的一系列研究进一步表明,这一全新的环加成策略具有潜在的合成应用价值 (Scheme 3)。
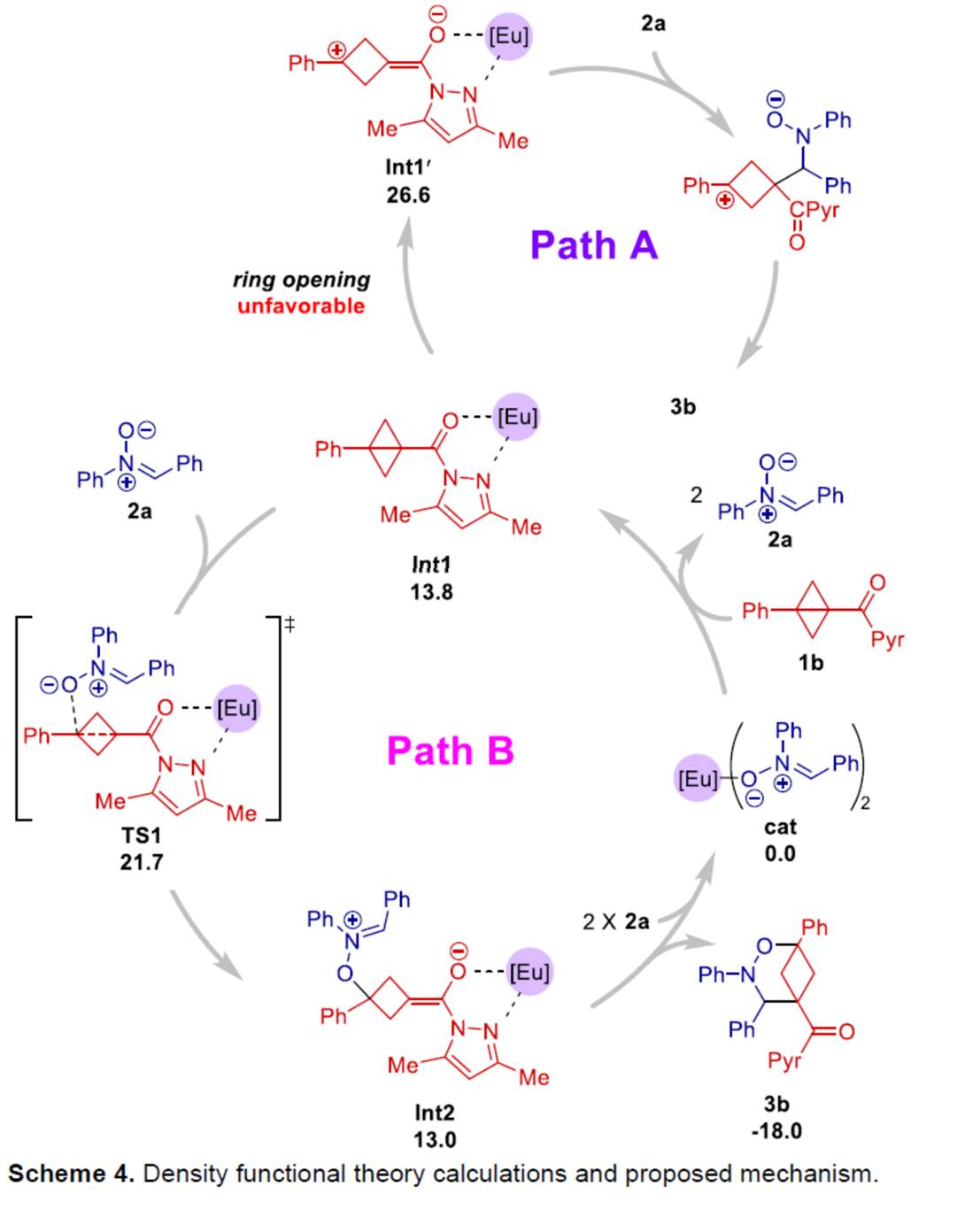
最后,作者提出如下合理的反应机理 (Scheme 4)。
总结:
浙江师范大学的邓卫平等人首次报道一种全新的Eu(OTf)3-催化BCBs与硝酮的formal dipolar [4π+2σ]环加成反应方法学,进而成功完成一系列多取代的2-oxa-3-azabicyclo[3.1.1]heptanes (2-oxa-3-azaBCHeps)分子的构建。这一全新的环加成合成转化策略具有反应条件温和、底物范围广泛以及优良的官能团兼容性等优势。
参考文献:
- [1] R. E. McNamee, A. L. Thompson, E. A. Anderson, J. Am. Chem. Soc. 2021, 143, 21246. doi:10.1021/jacs.1c11244.
- [2] T. V. T. Nguyen, A. Bossonnet, M. D. Wodrich, J. Waser, J. Am. Chem. Soc. 2023, 145, 25411. doi:10.1021/jacs.3c09789.
- [3] W. Yang, X. Shang, T. Ni, H. Yan, X. Luo, H. Zheng, Z. Li, W. Deng, Angew. Chem. Int. Ed. 2022, 61, e202210207. doi:10.1002/anie.202210207.
- [4] Y. Xu, H. Gao, C. Pan, Y. Shi, C. Zhang, G. Huang, C. Feng, Angew. Chem. Int. Ed. 2023, 62, e202310671. doi:10.1002/anie.202310671.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.















No comments yet.