本文作者:石油醚
Countless life-savingmedicines…all of these things are possible because of advances in fundamental organic chemistry. It is a field that is both an art and a science, full ofcharm and wonder, with only the most rudimentary reactions being amenable toautomation. Arguably, it is a quiet industry that makes modern-day lifepossible.——Phil S Baran
有机化学是一门既充满艺术又充满科学的基础学科,兼具艺术性和科学性,神秘而富有魅力的学科。在我们的衣食住行中,都影响这我们。在药物研发等学科领域中,有机化学更是起到了举足轻重的作用。比如:药物的设计与合成,杂质的分析与制备等,新材料的开发和制备。
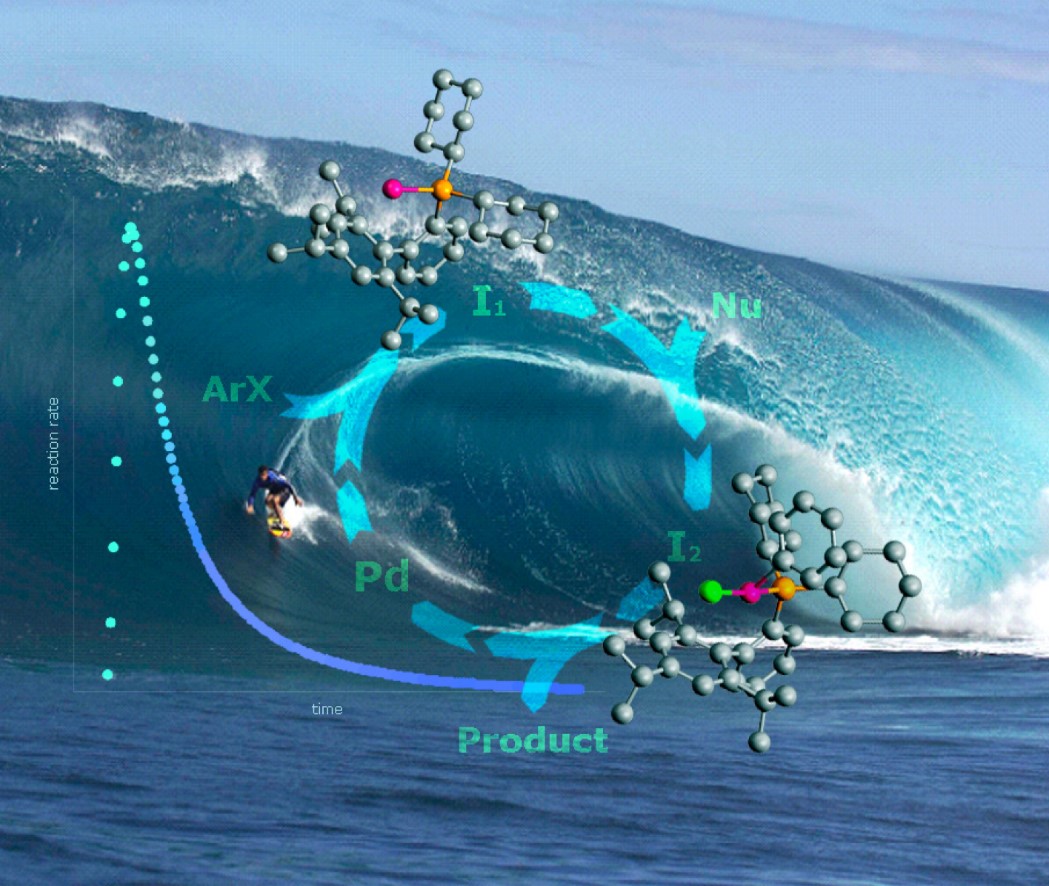
有机反应方法学和天然产物全合成是有机化学研究的两个重要方向,对于推动有机化学的应用和完善其基本理论具有重要的意义。有机反应丰富冗杂,让人眼花缭乱,以人名命名的反应多达上千个,而且随着新的方法和策略的不断发展,新的反应层出不穷。如何熟练掌握和应用这些反应对科研人员来说是巨大的挑战,决定了相关研究能否顺利开展。此时就需要我们对这些丰富繁杂,眼花缭乱的反应是如何发生,究其反应中间体?有机反应的机理(Figure 1)这方面的研究迫在眉睫。有机化学文献中的反应机理研究有那些呢?
Figure 1 RPKA研究反应机理
1.反应动力学研究反应机理
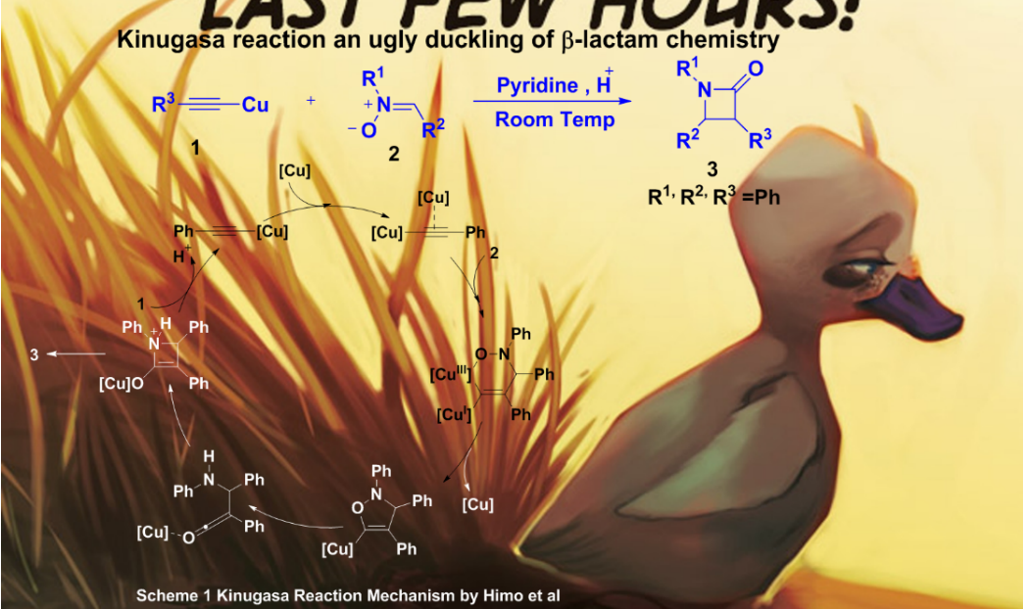
反应动力学分析(RPKA)是动力学技术中的一个子集,其主要确定化学反应的速率定律和阐明化学反应机理。 虽然反应动力学分析的概念并不是很新鲜,但该过程由Donna Blackmond教授1(目前在斯克里普斯研究所)于20世纪90年代末正式确定,并且此后得到广泛的应用。该法是使用现代实验工具(原位核磁,原位红外等)对反应进程进行原位检测使得我们可以对复杂的催化反应过程有更深层次的了解。由于该机制可以测得所涉及物种的相对和绝对浓度的变化,因此该方法获得的结果在常用条件下比传统策略更能代表反应机理。 此外,通过观察反应随时间获得的信息可以提供关于反应其他方面的见解,例如诱导期,催化剂失活或机制的变化。此方法将高度准确的原位据与严格的数学分析相结合,提供一种可视化的图形,快速确定反应物的浓度依赖关系,并且制药行业中得到了重要应用,基于Blackmond动力学分析的精简过程正在成为行业标准。例如D. G. Blackmond教授的弟子Jason E. Hein2 利用反应动力学来研究硝酮处理铜乙炔得到β-内酰胺类化合物的Kinugasa 反应3-5 (称它是丑小鸭的反应(Figure 2))的机理的修正。
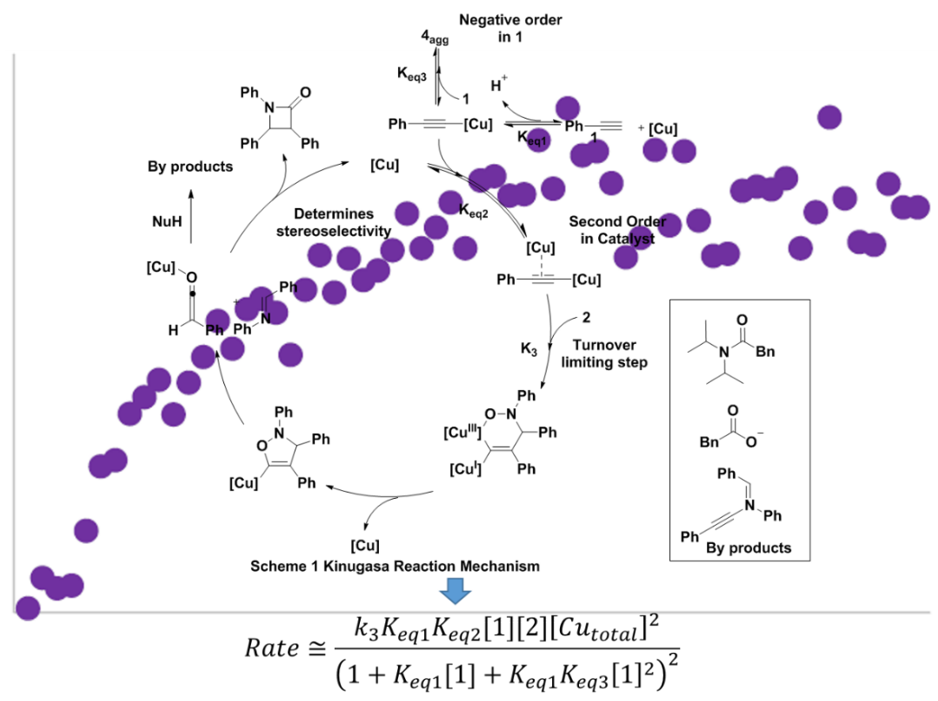
Figure 2 Kinugasa 反应及其反应机理
Hein 教授利用反应动力学技术(HPLC/MS, NMR-KIE 6Expeiment, LC)进一步通过数据来对Kinugasa 反应的机理进行研究,并提出了更加详细的反应机理和反应速率方程。(见Figure 3)。得出以下结论:
a)Kinugasa 反应的总体是零级分布,是由+1级的[硝铜]和 -1 级的[炔]影响的;b)动力学数据表明,双活化双-Cu(I)乙炔化物和硝酮之间的(3 + 2)环加成反应绝速步骤(这一结论得到 [Cu]的二级行为以及氘代硝酮KIE=0.95次级逆动力学同位素效应的支持);
c)依靠动力学和化学选择性数据,提出一种新颖的(3 + 2)开环,然后路易斯酸催化的(2 + 2)环加成的改进机理(新催化途径是通过乙烯酮中间体提出的)。d)发现乙烯酮中间体和了解环加成反应级的关键作体,Hein 教授课题组使用非亲核碱(例如DBU)推导反应条件,从而将所需β-内酰胺产物的收率提高至约80 %,对于我们修正反应机理有重要的意义。
Figure 3 修正的Kinugasa 反应机理
2.FTIR和NMR技术7
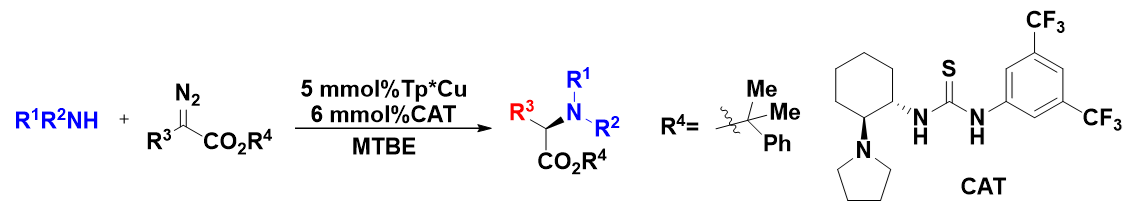
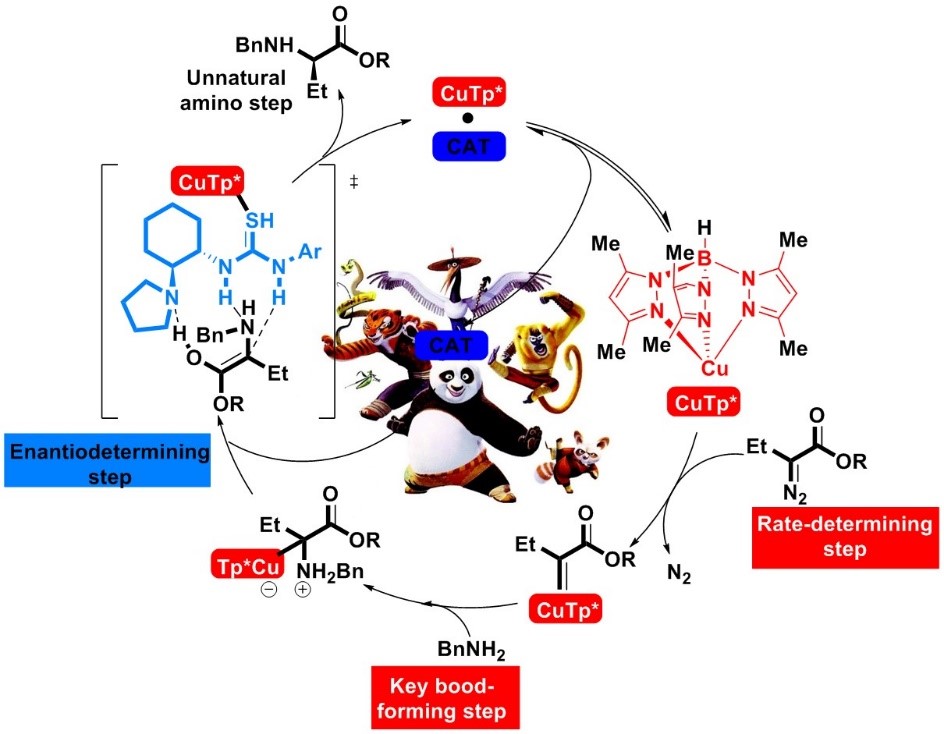
阅读有机方法学方面的文献,我们会发现使用原位红外技术和NMR技术对于反应机理的预测和判断有这很重要的作用。下面我们去看看周其林院士团队如何应用这两种技术来研究反应机理。2019年南开大学周其林和朱守非团队在《science》发表了“Highly enantioselective carbene insertion into N-H bonds of aliphatic amines”(卡宾对脂肪胺氮-氢键的高对映选择性插入反应)8的研究论文。(scheme 1)该研究利用拳击里面组合拳的策略,将两种催化剂(非手性铜络合物和手性的胺基-硫脲)协同催化的卡宾高对映选择性插入脂肪胺N-H键合成手性氨基酸的策略。此项研究不仅解决了对映选择性卡宾插入反应的长期挑战,为手性氨基酸的合成提供了高效方法,而且为涉及强配位底物的过渡金属催化的不对称转化提供了潜在的通用策略,并且还解决了半个世纪的难题。
Scheme 1卡宾对脂肪胺氮-氢键的高对映选择性插入反应
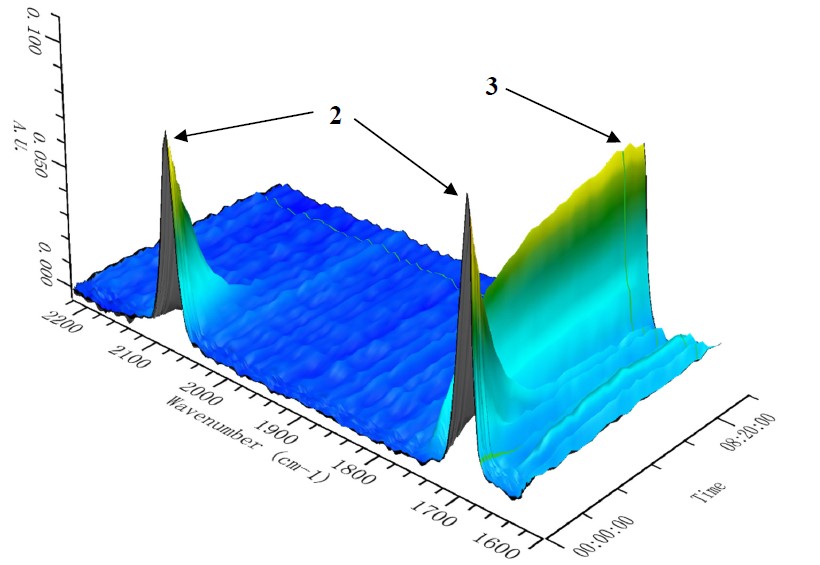
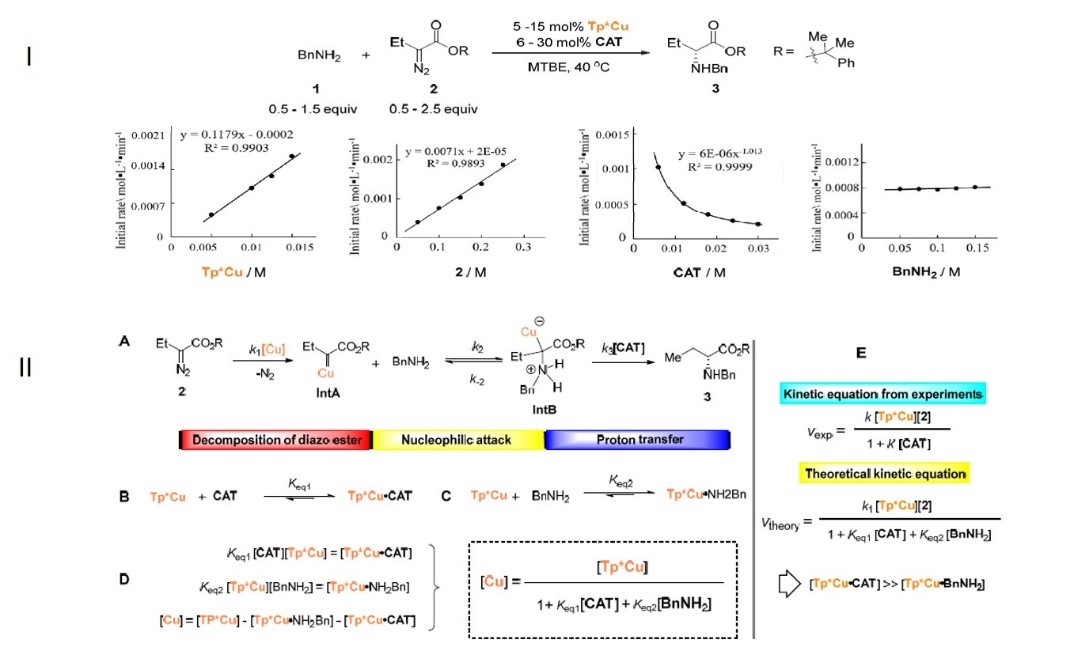
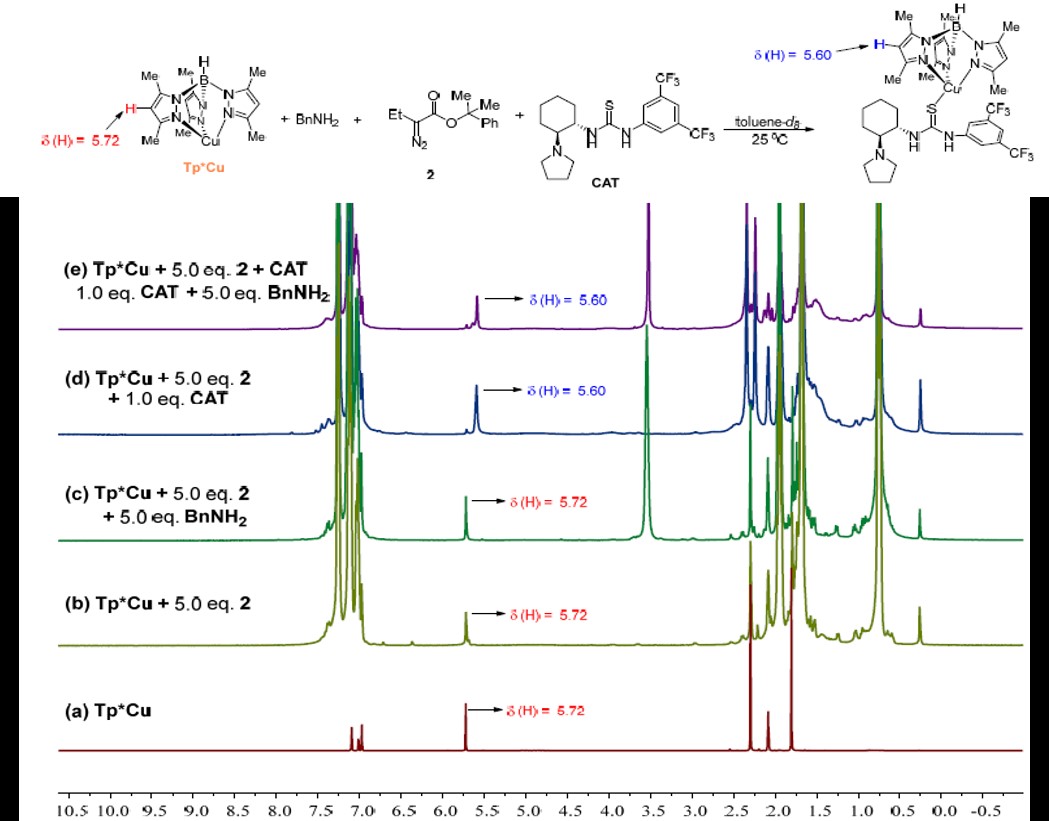
周其林院士团队使用原位红外(Figure 4)的技术对反应的动力学进行研究,速率显示对Tp*Cu和重氮化合物2浓度的一级依赖性(Figure 5I ),这表明通过Tp * Cu催化的重氮酯2分解形成金属类化合物可能是限速步骤。然,通常与金属催化剂配位并抑制金属卡宾形成的苄胺在反应中显示出零级动力学效应,这表明CAT与Tp*Cu的配位要比苄胺强得多,而苄胺的抑制作用可以忽略不计。(Figure 5II )
Figure 4 Kinetic profiles of Cu-catalyzed N−H insertion reaction of 2 and BnNH2. In situ IR spectroscopy of temporal changes in the stretching bands of 2 (2080 cm-1 and 1703 cm-1) and 3 (1737cm-1).
Figure 5 动力学分析
周院士团队采用柔克刚的策略:配体带有一个负电荷,与正一价铜结合后生成中性的铜配合物,使铜变得更“软”。根据软硬酸碱理论,它很难与较“硬”的脂肪胺作用,这是该反应能发生的关键。利用NMR和UV技术证明了金属铜配合物和脂肪胺几乎不存在相互作用,而手性硫脲催化剂的硫原子与铜有较强的配位作用。(Figure 6)由此就更容易解释了上面以柔克刚的策略是对的。
Figure 6 CAT, Tp*Cu, BnNH2 and 重氮酯的NMR光谱
基于IR,NMR,UV和DFT计算的这些技术,周院士团队提出了新的反应机制。他强调该反应的机制颠覆了手性有机催化剂常见的催化原理,使得手性氢键给体催化剂可以通过多种非共价机制促进立体选择性的控制。(Figure 7)
Figure 7 组合拳催化反应机理
除了上述几种文章中用来检测反应的方法,还有DFT计算,自由基检测方法等方法接下来进行介绍。
参考文献
- [1] Blackmond, D. G. Reaction Progress Kinetic Analysis: A Powerful Methodology for Mechanistic Studies of Complex Catalytic Reactions. Angew. Chem. Int. Ed. (2005) 44, 4302-4320, doi:10.1002/anie.200462544.
- [2] Malig, T. C., Yu, D. & Hein, J. E. A Revised Mechanism for the Kinugasa Reaction. J. Am. Chem. Soc. (2018) 140, 9167-9173, doi:10.1021/jacs.8b04635.
- [3] Kinugasa, M. & Hashimoto, S. The reactions of copper(I) phenylacetylide with nitrones. J. Chem. Soc., Chem. Commun. (1972), 466-467, doi:10.1039/C39720000466.
- [4] Stecko, S., Furman, B. & Chmielewski, M. Kinugasa reaction: an ‘ugly duckling’ of β-lactam chemistry. Tetrahedron (2014) 70, 7817-7844, doi:https://doi.org/10.1016/j.tet.2014.06.024.
- [5] Santoro, S., Liao, R.-Z., Marcelli, T., Hammar, P. & Himo, F. Theoretical Study of Mechanism and Stereoselectivity of Catalytic Kinugasa Reaction. J. Org. Chem. (2015) 80, 2649-2660, doi:10.1021/jo502838p.
- [6] Foley, D. A., Dunn, A. L. & Zell, M. T. Reaction monitoring using online vs tube NMR spectroscopy: seriously different results. Magn. Reson. Chem. (2016) 54, 451-456, doi:10.1002/mrc.4259.
- [7] Bromberg, S. E. et al. The Mechanism of a C-H Bond Activation Reaction in Room-Temperature Alkane Solution. Science (1997) 278, 260-263, doi:10.1126/science.278.5336.260
- [8] Li, M.-L., Yu, J.-H., Li, Y.-H., Zhu, S.-F. & Zhou, Q.-L. Highly enantioselective carbene insertion into N–H bonds of aliphatic amines. Science (2019) 366, 990-994, doi:10.1126/science.aaw9939
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.