作者:石油醚
导读:
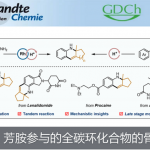
近日,华东师范大学的高栓虎教授团队在J. Am. Chem. Soc.上,以 “Asymmetric Synthesis of Cyclopamine, a Hedgehog (Hh) Signaling Pathway Inhibitor” 为题,报道了具有致畸作用的甾体生物碱环巴胺(Cyclopamine)天然产物的全合成路线。其中,关键步骤主要涉及两个阶段,即Stage-I:汇聚式合成 Veratramine,关键步骤是光促进的激发态Nazarov反应(photoinduced excited-state Nazarov reaction)用于构建C-nor-D-同型类固醇的基本骨架[6-6-5-6];Stage-II: 化学选择性氧化还原实现Veratramine向Cyclopamine的转化。
“Asymmetric Synthesis of Cyclopamine, a Hedgehog (Hh) Signaling Pathway Inhibitor
Hao Shao, Wenheng Liu, Muhan Liu, Haibing He, Qi-Lin Zhou, Shou-Fei Zhu,* and Shuanhu Gao
J. Am. Chem. Soc., 2023, ASAP. doi: 10.1021/jacs.3c10362.”
正文:
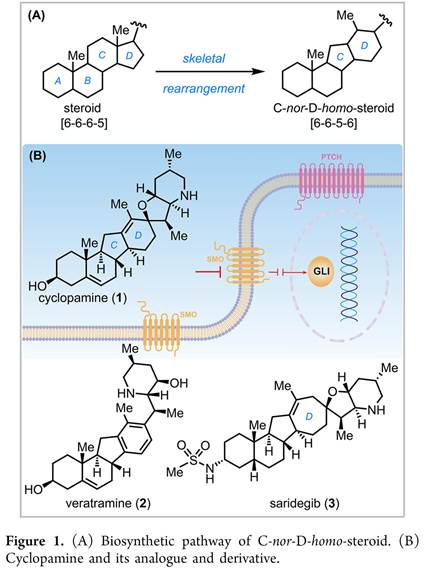
环巴胺(Cyclopamine) (1)和Veratramine(2)是C-nor-D-同型甾体生物碱,而从遗传学上将其结构可以通过骨架重排([6-6-6-5]→[6-6-5-6]环体系获得(Figure 1A)[1]。(Cyclopamine) (1)和Veratramine(2)均显示出致畸活性,但研究发现(1)导致独眼面部畸形,而 (2)导致腿部畸形[2]。此外,科学家通过生物实验确定了(1)分子靶点是一种七通跨膜蛋白的Smoothened (Smo)受体,其可调节Hedgehog (Hh)信号通路的活性(Figure 1B)。由于Hedgehog (Hh)信号在胚胎模式中起着关键作用,其不受控制的激活可导致成神经管细胞瘤、基底细胞癌和其他恶性肿瘤。基于此,科学家通过靶向过度活跃的突变体Smo来抑制Hh信号的合成小分子已被视为癌症的一类新疗法[3] (图1B)。例如,环巴胺的衍生物saridegib (3,Figure 1B)目前正准备由Sol-Gel Technologies, Ltd.进行用于治疗基底细胞nevus综合征的III期临床评估[4]。有趣的是,来自海洋来源的C-nor-D-同型类固醇,nakiterpiosin和nakiterpiosinone也被发现和探索[5]。
近些年来,Veratrum生物碱的重要性刺激了这类天然分子及其衍生物的合成和生物学研究。如Masamune[6]、Johnson[7]、Kutney[8]等分别对于jervine(4)、veratramine(2)、verarine (5)和verticine(6)的合成研究。关于环巴胺的报道有很多,如1)Masamune通过Wolff还原法将jervine转化为环巴胺[9];2)Kutney[10]、Giannis[11]、Baran[12]分别报道了环巴胺的合成研究。近日,高栓虎教授团队报道了具有致畸作用的甾体生物碱环巴胺(Cyclopamine)天然产物的全合成路线。并发表于J. Am. Chem. Soc.上。
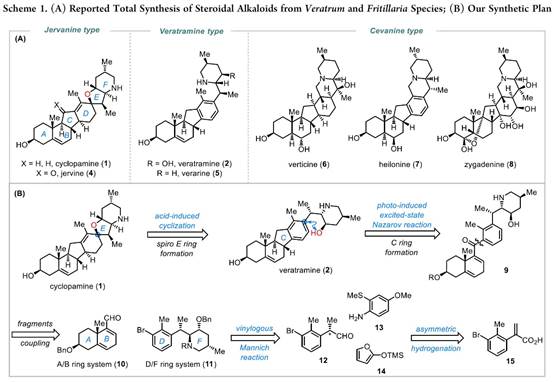
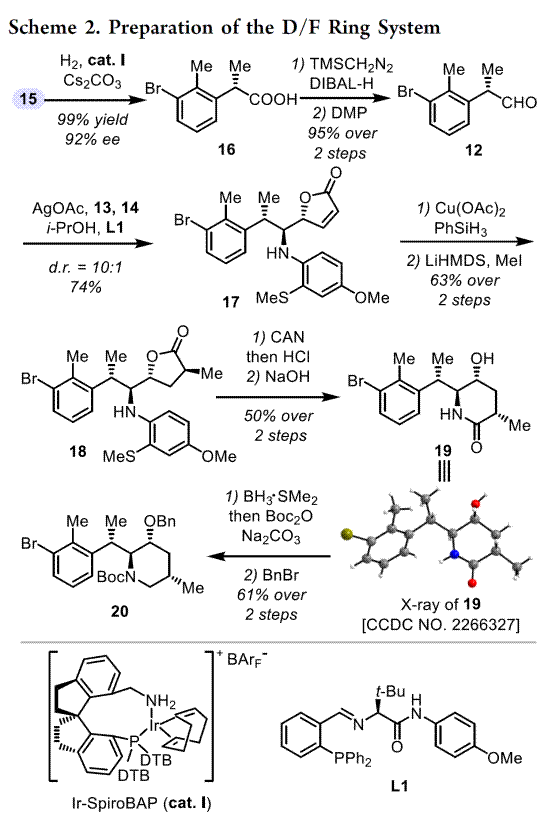
从结构上看,藜芦(Veratrum)生物碱具有共同的C-nor-D-homo甾体骨架,而根据其D环和哌啶F环之间的氧化态和键连接模式可分为三类:cevanine型、veratramine型和jervine型。综上,作者假设其中veratramine型甾体生物碱可以作为合成jervanine型甾体生物碱的前体(Scheme 1B)。据此,作者设计了两个阶段的接力策略(Schemes 2 to 4),即1)Veratramine(2)简明全合成;2)Veratramine(2)转化为cycloparamine(1)。其逆合成就提过程如下,即砌块(15)通过不对称氢化[13]获得片段(12),随后,经银催化片段(12)、(13)和(15)发生vinylogous Mannich reactionMannich反应引入(11)所需的手性中心和官能团[14]。接下来,A /B环体系(10)和D/F环体系(11)偶联生成芳基乙烯基酮(9),(9)经光诱导激化态Nazarov反应[15]构建C-nor-D-同型类固醇的基本骨架(6-6-5-6)完成Veratramine(2)的全合成。最后,Veratramine(2)经一系列化学选择性转化完成Cycloparamine(1)的全合成。

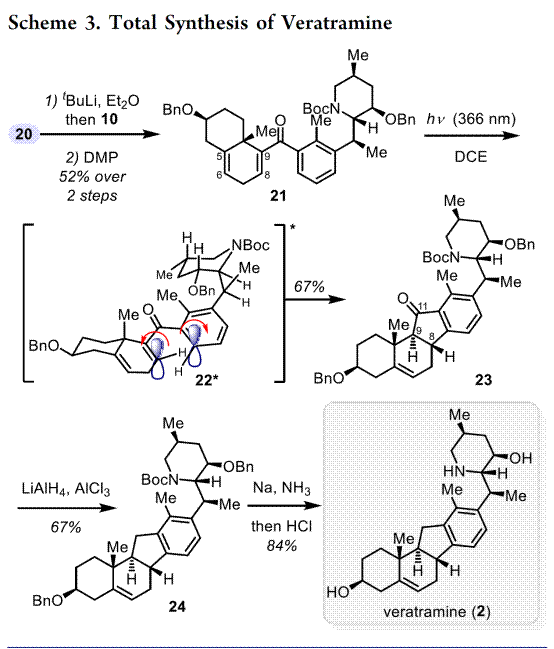

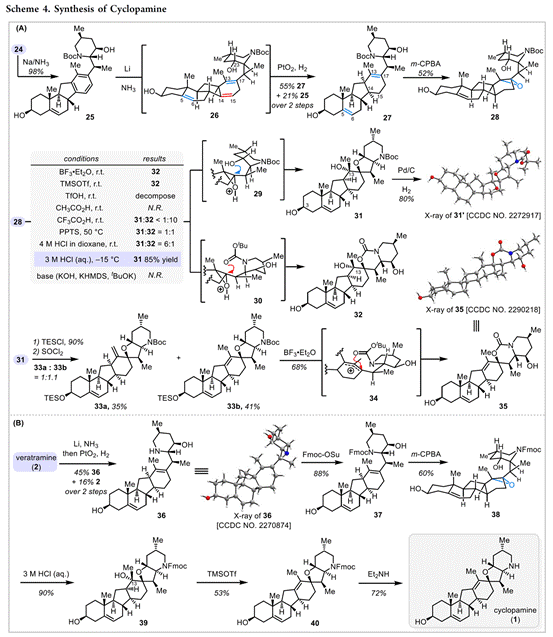

总结,高栓虎教授团队报道了具有致畸作用的甾体生物碱环巴胺(Cyclopamine)天然产物的全合成路线。其中,关键步骤主要涉及两个阶段,即Stage-I:汇聚式合成 Veratramine,关键步骤是光促进的激发态纳扎罗夫反应(photoinduced excited-state Nazarov reaction)用于构建C-nor-D-同型类固醇的基本骨架[6-6-5-6];Stage-II: 化学选择性氧化还原实现Veratramine向Cyclopamine的转化。总之,以15步LLS(2.6%总产率)实现了Veratramine的合全合成,并以8.2%的产率(23步,0.2%总产率)开发了环巴胺的全合成。
参考文献
- [1] H.-J. Li, Y. Jiang, P. Li, Nat. Prod. Rep. 2006, 23, 735. doi:10.1039/B609306J.
- [2] M. K. Cooper, J. A. Porter, K. E. Young, P. A. Beachy, Science, 1998, 280, 1603. doi:10.1126/science.280.5369.1603.
- [3] R. L. Yauch, S. E. Gould, S. J. Scales, T. Tang, H. Tian, C. P. Ahn, D. Marshall, L. Fu, T. Januario, D. Kallop, M. Nannini-Pepe, K. Kotkow, J. C. Marsters, L. L. Rubin, F. J. de Sauvage, Nature 2008, 455, 406. doi:10.1038/nature07275.
- [4] M. R. Tremblay, A. Lescarbeau, M. J. Grogan, E. Tan, G. Lin, B. C. Austad, L.-C. Yu, M. L. Behnke, S. J. Nair, M. Hagel, K. White, J. Conley, J. D. Manna, T. M. Alvarez-Diez, J. Hoyt, C. N. Woodward, J. R. Sydor, M. Pink, J. MacDougall, M. J. Campbell, J. Cushing, J. Ferguson, M. S. Curtis, K. McGovern, M. A. Read, V. J. Palombella, J. Adams, A. C. Castro, J. Med. Chem. 2009, 52, 4400. doi:10.1021/jm900305z.
- [5] T. Teruya, S. Nakagawa, T. Koyama, K. Suenaga, M. Kita, D. Uemura, Tetrahedron Lett. 2003, 44, 5171. doi:10.1016/S0040-4039(03)01267-X.
- [6] T. Masamune, M. Takasugi, A. Murai, K. Kobayashi, J. Am. Chem. Soc. 1967, 89, 4521. doi:10.1021/ja00993a048.
- [7] W. S. Johnson, H. A. P. DeJongh, C. E. Coverdale, J. W. Scott, U. Burckhardt, J. Am. Chem. Soc. 1967, 89, 4523. doi:10.1021/ja00993a049.
- [8] J. P. Kutney, J. Cable, W. A. F. Gladstone, H. W. Hanssen, E. J. Torupka, W. D. C. Warnock, J. Am. Chem. Soc. 1968, 90, 5332. doi:10.1021/ja01021a083.
- [9] T. Masamune, Y. Mori, M. Takasugi, A. Murai, S. Ohuchi, N. Sato, N. Katsui, Bull. Chem. Soc. Jpn. 1965, 38, 1374. doi:10.1246/bcsj.38.1374.
- [10] J. P. Kutney, A. By, J. Cable, W. A. F. Gladstone, T. Inaba, S. Y. Leong, P. Roller, E. J. Torupka, W. D. C. Warnock, Can. J. Chem. 1975, 53, 1775. doi:10.1139/v75-251.
- [11] A. Giannis, P. Heretsch, V. Sarli, A. Stößel, Angew. Chem. Int. Ed. 2009, 48, 7911. doi:10.1002/anie.200902520.
- [12] M. Sofiadis, D. Xu, A. J. Rodriguez, B. Nissl, S. Clementson, N. N. Petersen, P. S. Baran, J. Am. Chem. Soc. 2023, 145, 21760. doi:10.1021/jacs.3c09085.
- [13] S. Li, S.-F. Zhu, C.-M. Zhang, S. Song, Q.-L. Zhou, J. Am. Chem. Soc. 2008, 130, 8584. doi:10.1021/ja802399v.
- [14] E. L. Carswell, M. L. Snapper, A. H. Hoveyda, Angew. Chem. Int. Ed. 2006, 45, 7230. doi:10.1002/anie.200603496.
- [15] S. Cai, Z. Xiao, Y. Shi, S. Gao, Chem. Eur. J. 2014, 20, 8677. doi:10.1002/chem.201402993.
- [16] B. A. Baker, Ž. V. Bošković, B. H. Lipshutz, Org. Lett. 2008, 10, 289. doi:10.1021/ol702689v.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.



















No comments yet.