概要
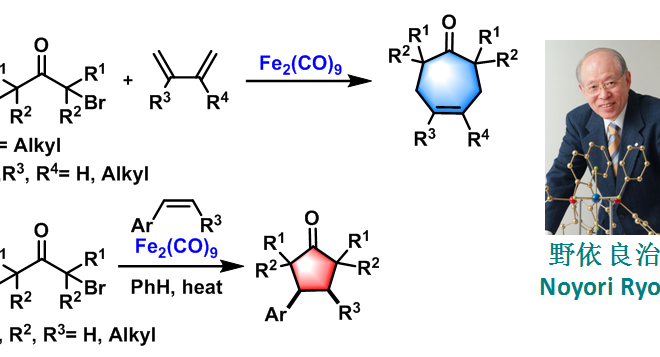
1971年,日本名古屋大学(Nagoya University)化学系的野依良治(Noyori Ryoji)研究室在首次报道了羰基铁配合物Fe2(CO)9促进的α,γ-二溴代酮与1,3-二烯之间的环化偶联反应[1]。1973年,该课题组研究发现芳基烯烃同样可以参与该反应,反应过程中芳基烯烃构型完全保持[2]-[3]。
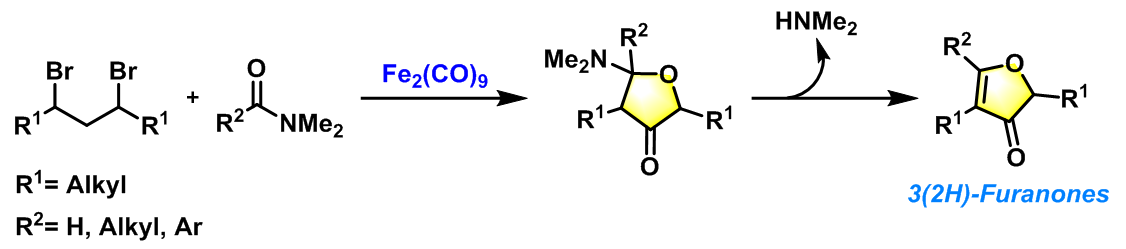
1977年,Noyori等进一步将底物扩展至酰胺类化合物,从而成功获得3-(2H)-呋喃酮类化合物[4]。
1978年,该研究组将底物范围扩展至五元芳香杂环及烯胺类化合物[5]-[6]。
上述反应统称为Noyori环化偶联反应(Noyori cyclocoupling),又称为Noyori环化反应(Noyori annulation)。该反应为环戊酮、环庚烯酮类化合物的合成提供了新的方法。现已广泛应用于各种天然产物全合成的关键步骤[7]-[10]。
基本文献
- [1] R. Noyori, S. Makino, H. Takaya, J. Am. Chem. Soc. 1971, 93, 1272. doi: 10.1021/ja00734a046.
- [2] R. Noyori, K. Yokoyama, Y. Hayakawa, J. Am. Chem. Soc. 1973, 95, 2722. doi: 10.1021/ja00789a073.
- [3] Y. Hayakawa, K. Yokoyama, and R. Noyori, J. Am. Chem. Soc., 1978,100,1791. doi: 10.1021/ja00474a022.
- [4] Y. Hayakawa, H. Takaya, S. Makino, N. Hayakawa, R. Noyori, Bull. Chem. Soc. Jpn. 1977, 50, 1990. doi: 10.1246/bcsj.50.1990.
- [5] M. Takaya, S. Makino, Y. Hayakawa, R. Noyori, J. Am. Chem. Soc. 1978, 100, 1765. doi: 10.1021/ja00474a019.
- [6] Y. Hayakawa, K. Yokoyama, R. Noyori, J Am. Chem. Soc. 1978,100, 1799. doi: 10.1021 / ja00474a023.
- [7] J. L. Paparin, C. Crévisy, Tetrahedron Lett. 2000, 41, 2343. doi: 10.1016/S0040-4039(00)00198-2.
- [8] H. Takaya, Y. Hayakawa, S. Makino, R. Noyori, J. Am. Chem. Soc., 1978,100, 1778.doi:10.1021 / ja00474a020.
- [9] Y. Hayakawa, Y. Baba, S. Makino, R. Noyori, J. Am. Chem. Soc., 1978, 100,1786. doi: 10.1021/ja00474a021.
- [10] R. Noyori, T. Souchi, Y. Hayakawa, J. Org. Chem., 1975, 40, 2681. doi: 10.1021/jo00906a024.
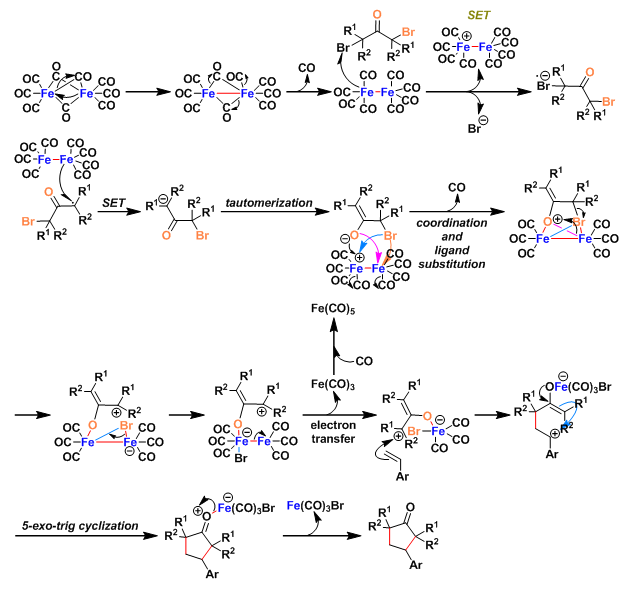
反应机理
- [1] R. Noyori, Y. Hayakawa, S. Makino, N. Hayakawa, and H. Takaya, Tetrahedron Lett. 1978,19, 2091. doi: 10.1016/S0040-4039(01)94758-6.
- [2] R. Noyori, Y. Hayakawa, M. Funakura, H. Takaya, S. Murai, R. Kobayashi, S. Tsutsumi, J. Am. Chem. Soc. 1972, 94, 7202. doi: 10.1021/ja00775a084.
- [3] R. Noyori, Y. Hayakawa, H. Takaya, S. Murai, R. Kobayashi, N. Sonoda, J. Am. Chem. Soc., 1978, 100, 1759. doi: 10.1021/ja00474a018.
- [4] H. E. Alper, C. H. Keung, J. Org. Chem 1972, 37, 2566. doi: 10.1021/jo00981a011.
- [5] B. Czauderna , K. H. Jogun, J. J. Stezow ski, B. Föhlisch, J. Am. Chem. Soc. 1976, 98, 6696. doi:10.1021/ja00437a044.
反应实例
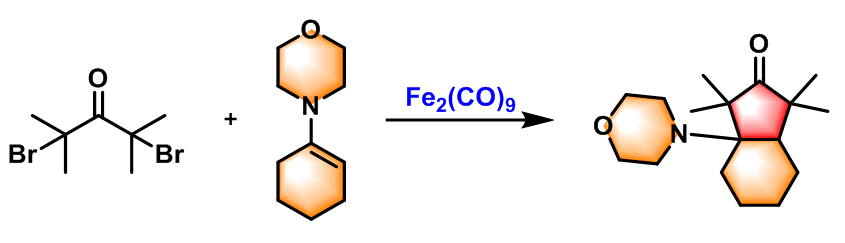
吗啉环戊酮的合成[1] [2]
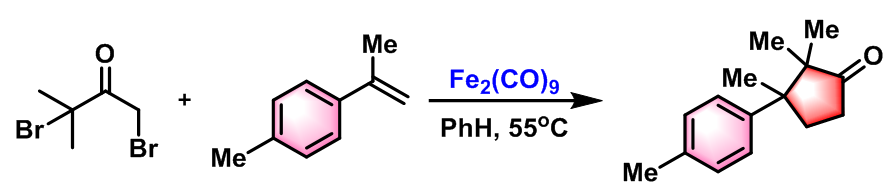
(±)-α-cuparenone型萜烯的合成[3]
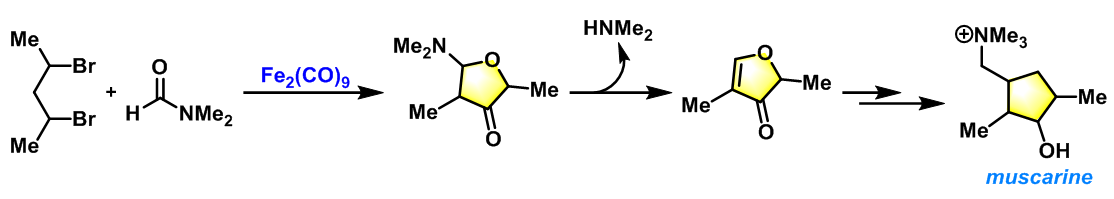
muscarine生物碱的合成[4] [5]
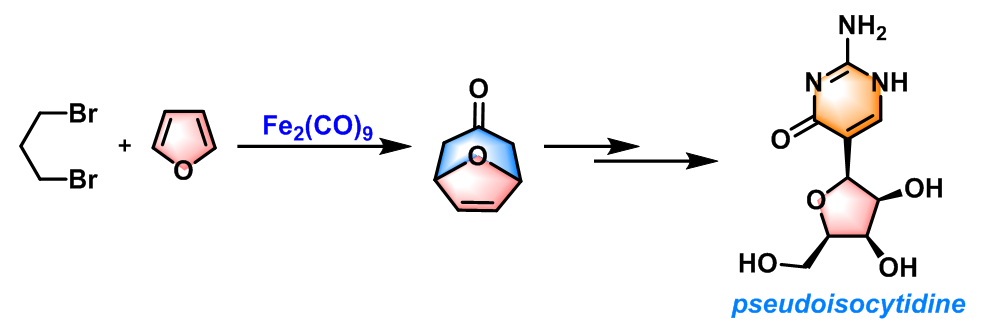
pseudoisocytidine的合成[6]
实验步骤
将Fe2(CO)9 (1.2 eq.) 装入厚壁反应安瓿中,并与固定有橡胶塞的三通活塞及氮气管线进行连接。将其反复进行抽真空-充氮气操作五次。再用注射器加入无水benzene (维持底物浓度为2M)、1,3-二烯 (10 eq.)及α,γ-二溴代酮(1 eq.) 。将上述反应混合物在60-90oC下加热搅拌,直至反应完成。反应结束后,将反应液冷却至室温。通过硅藻土过滤除去形成的沉淀,将滤液进行减压浓缩,除去溶剂。对粗产物采用制备TLC进行分离纯化后,获得相应目标产物。
实验实验安全须知
小编郑重提示:金属羰基化合物有剧毒,其毒性远大于氢氰酸及氰化物,目前尚无特效解毒剂。反应需要在通风极为优良的通风橱内小心操作,并佩戴防毒面具及SSG(silver shield gloves)防化手套。
参考文献
- [1] Y. Hayakawa, K. Yokoyama, R. Noyori, J Am. Chem. Soc. 1978,100, 1799. doi: 10.1021 / ja00474a023.
- [2] R. Noyori, Acc. Chem. Res. 1979, 12, 61. doi: 10.1021/ar50134a003.
- [3]Y. Hayakawa, F. Shimizu, R. Noyori, Tetrahedron Lett. 1978,19, 993. doi: 10.1016/S0040-4039(01)85433-2.
- [4]Y. Hayakawa, H. Takaya, S. Makino, N. Hayakawa, R. Noyori, Bull. Chem. Soc. Jpn. 1977, 50, 1990. doi: 10.1246/bcsj.50.1990.
- [5]Y. Hayakawa, H. Takaya, S. Makino, N. Hayakawa, R. Noyori, J.Am. Chem. Soc. 1973, 95, 4103. doi: 10.1021/ja00793a076.
- [6] T. Sato, R. Ito, Y. Hayakawa, R. Noyori. Tetrahedron Lett.,1978, 19, 1829.doi: 10.1016/S0040-4039(01)94682-9.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.