作者:石油醚
导读
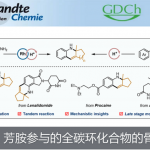
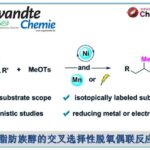
近日,上海师范大学赵宝国教授和陈雯雯教授团队在Nat Commun上发表了题为[Direct asymmetric α C(sp3)‒H alkylation of benzylamines with MBH acetates enabled by bifunctional pyridoxal catalysts.]论文。受生物体内苏氨酸醛缩酶(threonine aldolase)催化甘氨酸与醛的aldol反应启发,赵宝国教授和陈雯雯教授团队利用双功能手性吡哆醛催化剂,成功实现NH₂ 未保护的苄胺与 MBH 加合物的不对称直接α-C–H 位烯丙基烷基化反应,以良好的产率和优异的非对映选择性和对映选择性合成了具有重要生物活性的手性γ-氨基酸衍生物。陈佳瑶和杨越为本文的工作一作,赵宝国教授,陈雯雯教授为论文共同通讯作者。
“Direct asymmetric α C(sp3)‒H alkylation of benzylamines with MBH acetates enabled by bifunctional pyridoxal catalysts
Jiayao Chen, Yue Yang, Siqi Liu, Weibo Ling, Ruixin Zhang, Tongyin Chen, Wen-Wen Chen* & Baoguo Zhao*
Nat Commun, 2025, 16, 10645. Doi: 10.1038/s41467-025-65648-5
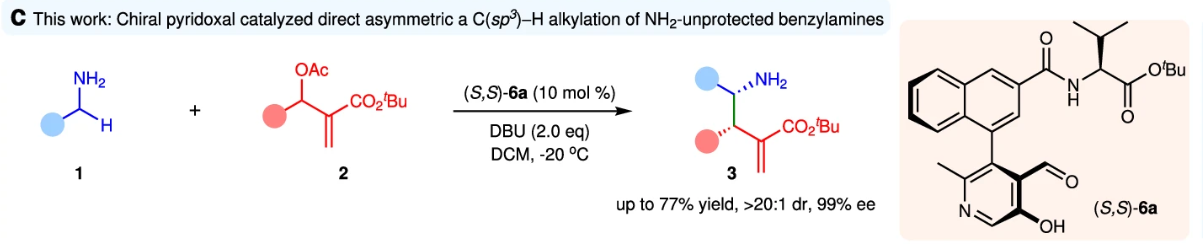
正文:
有机催化MBH加合物与亲核试剂的反应为构建复杂分子提供了一种高效且通用的方法。尽管活化碳亲核试剂已得到广泛应用,但利用惰性C–H键作为亲核试剂仍具挑战,进而限制了该反应的通用性&拓展性。苄胺是一类易得的一级胺,含有两个惰性的α-C(sp³)–H键。实现其与MBH加合物的直接不对称α-C(sp³)–H烯丙基烷基化,不仅有望同时构建C–C键和手性胺结构(图1a),还为合成具有生物活性的γ-氨基丁酸(GABA)骨架提供了高效途径(图1b)。然而,即使使用NH₂保护的苄胺实现此类转化也面临困难,如(图1a):一是α-氨基C–H键酸性极弱(pKa≈42.5),难以去质子生成活性碳负离子;二是NH₂基团亲核性强,易发生N-烷基化生成主要的副产物4和/或5。
近些年来,上海师范大学赵宝国教授团队长期从事于羰基催化未保护伯胺的不对称α-C-H键官能团化研究,成功实现了活化伯胺,如α-氨基酸酯,与不同的亲电试剂的多种不对称转化,例如甘氨酸酯的不对称仿生Mannich反应(Science. 2018, 360, 1438)、仿生Aldol反应(Angew. Chem. Int. Ed. 2021, 60, 20166)、Michael加成反应 (Angew. Chem. Int. Ed. 2021, 60, 10588)、不对称烯丙基化反应 (Angew. Chem. Int. Ed. 2022, 61, e202200850, J. Am. Chem. Soc. 2025, 147, 14945–14953) 、丙氨酸酯的不对称烷基化反应 (ACS Catal. 2023, 13, 9150-9157)以及硝基烯烃的直接不对称α-C加成反应( Angew. Chem. Int. Ed. 2025, e202506342.),得到一系列手性氨基酸衍生物。对于惰性伯胺如苄胺和炔丙基胺,也成功实现了它们对高活性亲电试剂(如醛、三氟甲基酮、α,β-不饱和酮和甘氨酸叔丁酯)的不对称加成 (Nat. Catal. 2022, 5, 1061-1068; Angew. Chem. Int. Ed. 2022, e202206111; J. Am. Chem. Soc. 2024, 146, 38, 25927–25933,Nat Catal. 2025 8, 668–677)。此外,利用光/钯/吡哆醛三重协同催化策略,成功实现氨基酸酯不对称α-烯丙基化(Angew. Chem. Int. Ed. 2025, 64, e202418910)。近日,赵宝国教授和陈雯雯教授团利用双功能手性吡哆醛催化剂,成功实现NH₂ 未保护的苄胺与 MBH 加合物的不对称直接α-C–H 位烯丙基烷基化反应,以良好的产率和优异的非对映选择性和对映选择性合成了具有重要生物活性的手性γ-氨基酸衍生物。相关工作发表于“Nat Commun ”上。
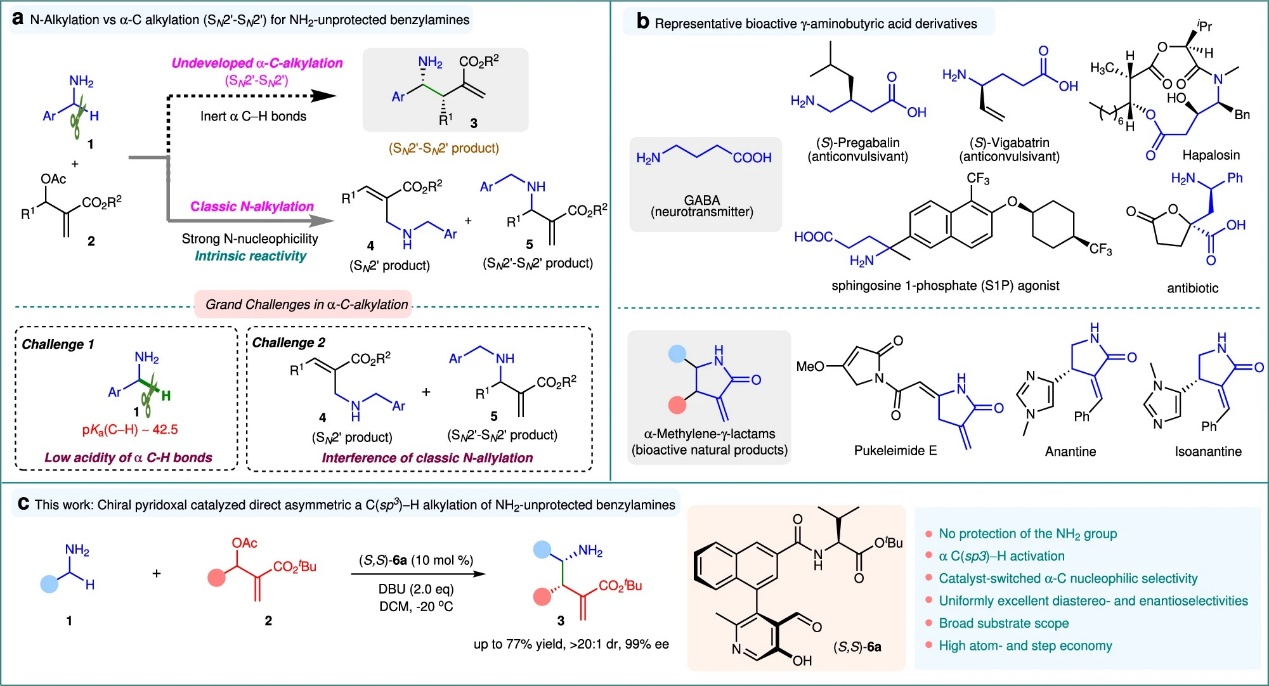
图1 前言概述
首先,作者以苄胺(1a)和MBH醋酸酯(2a)作为模型底物对直接不对称α-C−H烷基化反应进行了研究。以(S,S)-6a作为催化剂、DBU作碱、DCM作为溶剂,反应24h,以58%的产率、获得手性γ-氨基酸酯(3a),且延长反应时间(72 h),以71%的产率、>20:1 dr和99% ee获得产物(3a)。特别的是,无催化剂时仅获得副产物N-烷基化,进而表明(S,S)-6a可有效引导亲核选择性由N转向α-C,无需保护NH₂基团。此外,(R,S)-6a效果较差,产率和立体选择性均下降(图2)。进一步筛选不同侧链的催化剂6a–e,表明(S,S)-6a的催化性能最佳。
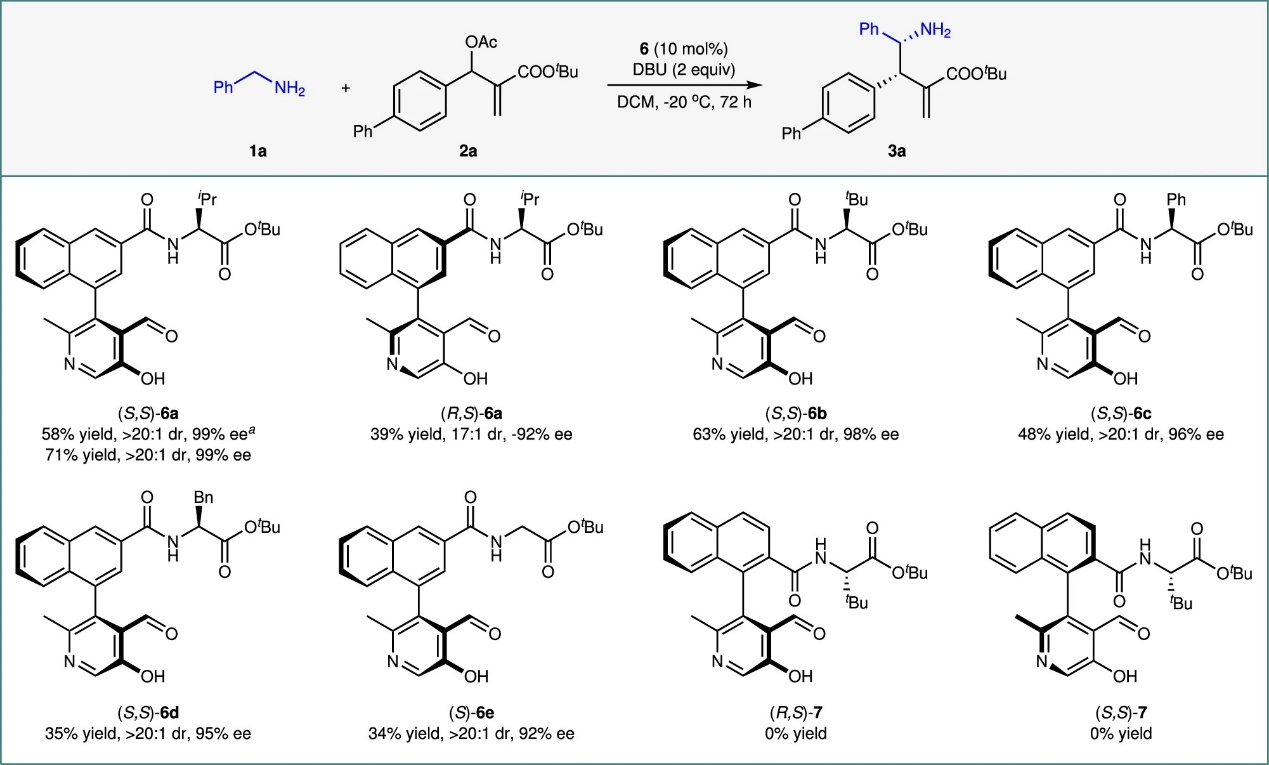
图2催化剂筛选
在最优条件下,作者对底物的兼容性进行了研究,如图3所示。一系列含有给电子或吸电子基团的o-,m-,p-苄胺(图3a)均可与MBH醋酸酯(2a)发生高效不对称α-C–H烯丙基烷基化反应,以60–77%的产率、>20:1 dr和96–99% ee获得产物(3b–m)(X射线分析确定3m主产物的绝对构型为(3S,4R)。除此之外,萘基(3n–o)及多种杂芳基甲胺(如噻吩-3-基3p、吡啶-3-基3q、4-甲氧基吡啶-2-基3r)同样适用。另外一方面,一系列不同的MBH醋酸酯也可兼容(图3b),如苯基(3s)、取代苯基(3t–ad)和杂芳基(3ae–ah)衍生物、烯基和炔基取代的MBH酯酸酯均可兼容。此外,含生物活性手性片段的底物——如源自D-葡萄糖(3ak)、睾酮(3al)或雌酮(3am)者——亦可顺利反应(图3c)。
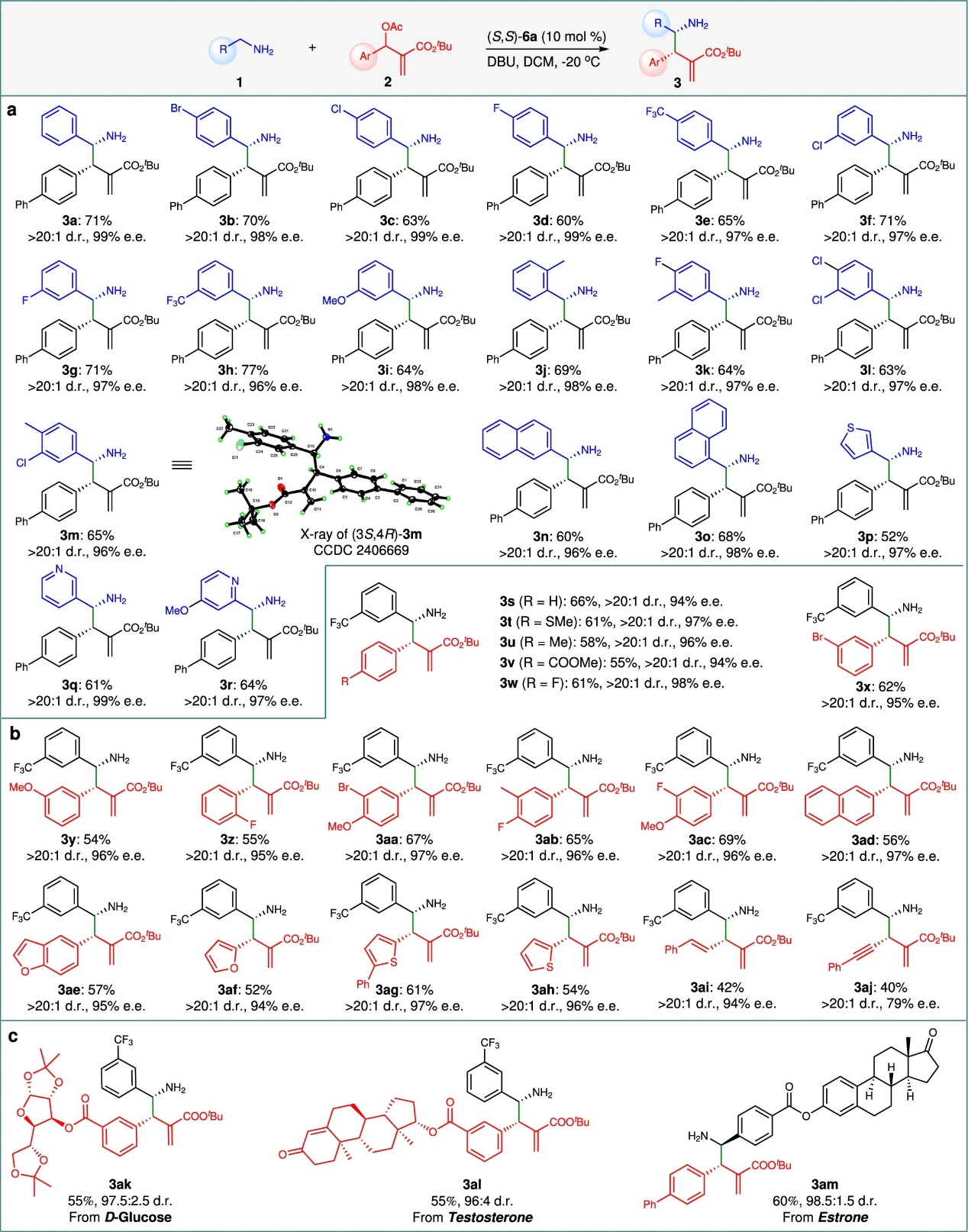
图3 底物拓展
接下来,作者通过克级规模实验和后期转化,进而证实了该方法的通用性,如图4所示。
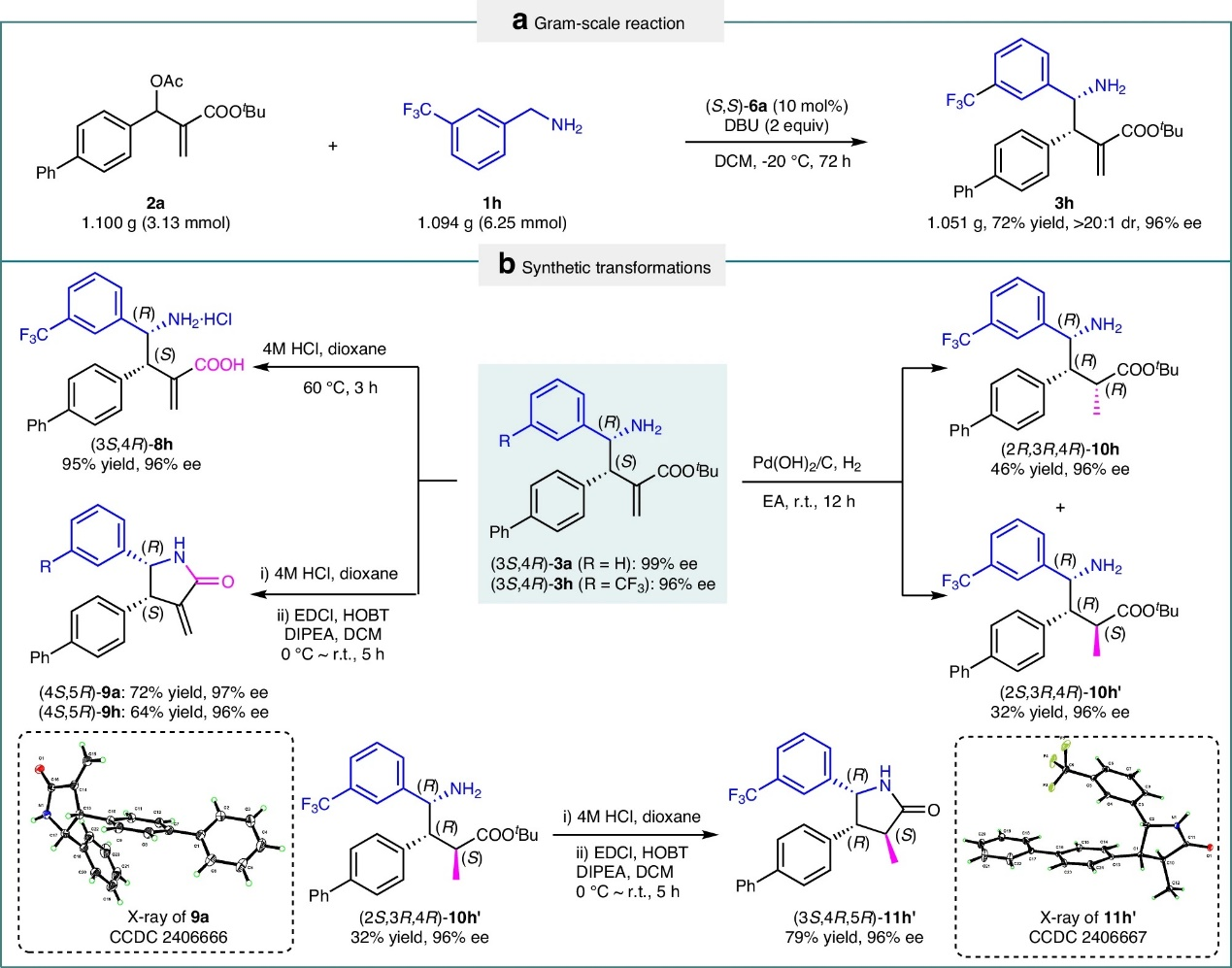
图4 衍生化
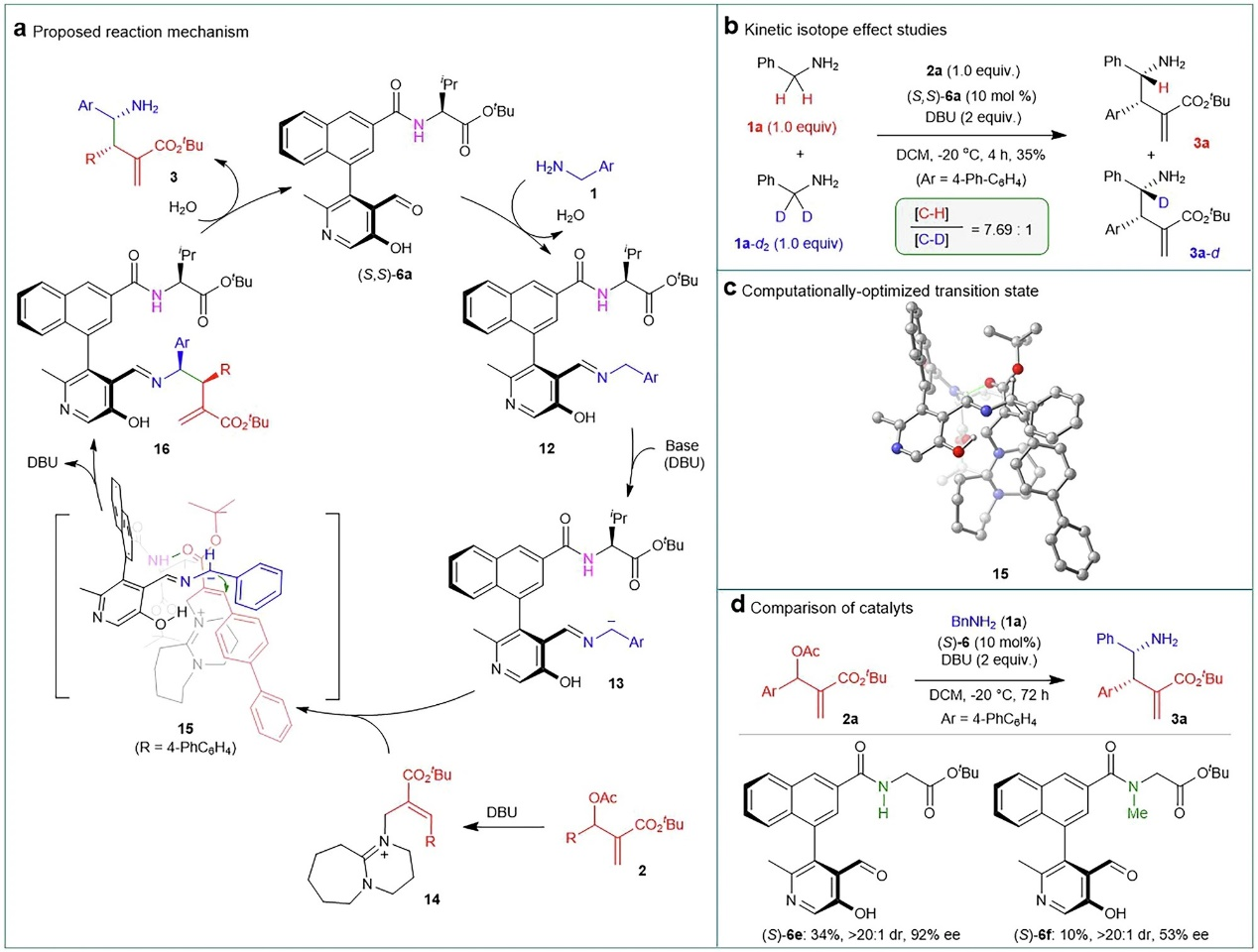
图5 机理研究
最后,作者通过一系列实验对反应的机理进行了研究,如图5所示。即1)1与1a–d动力学同位素效应(KIE=7.69:1),进而表明亚胺 12 的去质子化生成碳负离子中间体 13 是反应的决速步骤(图5b)。特别的是,亚胺12的苄位C–H酸性强于吡哆醛骨架的酚O–H和N–H,热力学上有利于选择性脱质子生成碳负离子;2)计算研究表明:苯胺 1 与吡哆醛催化剂形成亚胺实现结合,而 MBH 醋酸酯衍生的中间体 14 则通过侧链 N-H 基团与其中羰基的氢键作用被活化。其中,中间体 14 的大体积 R 基和 DBU 部分远离催化剂的联芳基骨架来降低空间位阻,苄胺的碳负离子从上方进攻,生成具有 (3S,4R) 构型的手性 γ-氨基酸酯 3;3)控制实验表明(图5c),N–H 基团可能通过氢键参与催化,验证了过渡态 15 中的双功能的活化机制。综上所述,作者提出了合理的反应机制,如图5a所示。(S,S)-6a与1缩合生成亚胺12,12在DBU的作用下生成碳负离子中间体 13。13对原位生成的季铵盐中间体14(由DBU亲核进攻MBH醋酸盐2形成)发生不对称加成,同时释放DBU,得到中间体16。随后水解16释放SN2’-SN2’ α-C烷基化产物3,并再生催化剂6a,完成催化循环。
总结:
受生物体内苏氨酸醛缩酶催化甘氨酸与醛的aldol反应启发,赵宝国教授和陈雯雯教授团队利用双功能手性吡哆醛催化剂,成功NH₂ 未保护的苄胺与 MBH 加合物的不对称直接α-C–H 位烯丙基烷基化反应,以良好的产率和优异的非对映选择性和对映选择性合成了具有重要生物活性的手性γ-氨基酸衍生物。该工作不仅展示了有机催化实现惰性C–H键官能化的典型范例,还凸显了基于维生素B6的有机催化剂在有机合成中的独特优势。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
关注Chem-Station抖音号:79473891841
请登陆TCI试剂官网查看更多内容
https://www.tcichemicals.com/CN/zh/


















No comments yet.