本文作者:自由基先生
导读
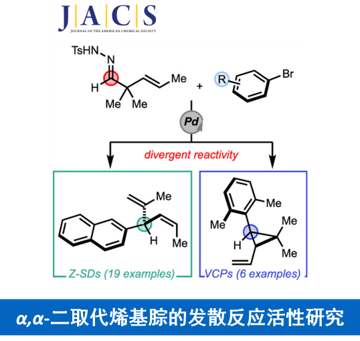
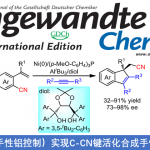
近日,North Carolina大学Chapel Hill分校 (The University of North Carolina at Chapel Hill)的S. M. Wilkerson-Hill课题组在J. Am.Chem. Soc.中发表论文,报道一种全新的通过钯催化剂参与的2,2-二烷基-3-(E)-烯基N-对甲苯磺酰腙与芳基溴之间的发散交叉偶联反应方法学,进而顺利实现各类 (Z)-3-芳基-1,4-二烯与偕二烷基乙烯基环丙烷的分子的立体选择性合成。这一全新的交叉偶联策略具有良好的立体专一性与立体选择性等优势。
Divergent Reactivity of α,α-Disubstituted Alkenyl Hydrazones: Bench Stable Cyclopropylcarbinyl Equivalents, N. F. C. Ritchie, A. J. Zahara, S. M. Wilkerson-Hill, J. Am. Chem. Soc. 2022, ASAP. Doi:10.1021/jacs.1c12881.
正文
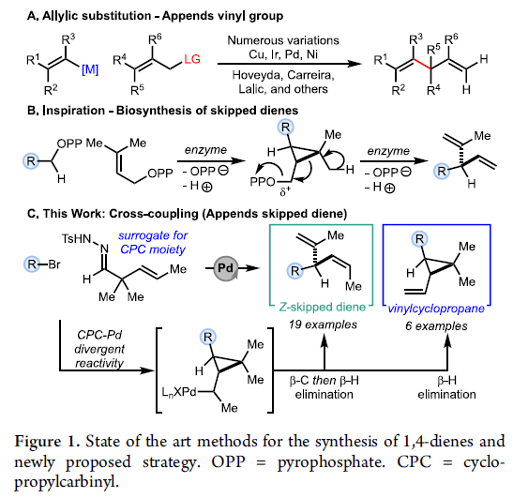
3-官能团化-1,4-二烯 (skipped diene)分子的构建,目前已经备受有机合成化学家的广泛关注 (Figure 1A) [1]-[8],然而,仍面临诸多的挑战。这里,受到1,4-二烯分子生物合成 (Figure 1B)相关研究报道的启发[9],S. M. Wilkerson-Hill研究团队成功设计出一种全新的通过钯催化剂促进的2,2-二烷基-3-(E)-烯基N-对甲苯磺酰腙与芳基溴之间的发散性交叉偶联反应方法学,进而顺利完成各类 (Z)-3-芳基-1,4-二烯以及偕二烷基乙烯基环丙烷的分子的立体选择性合成 (Figure 1C)。
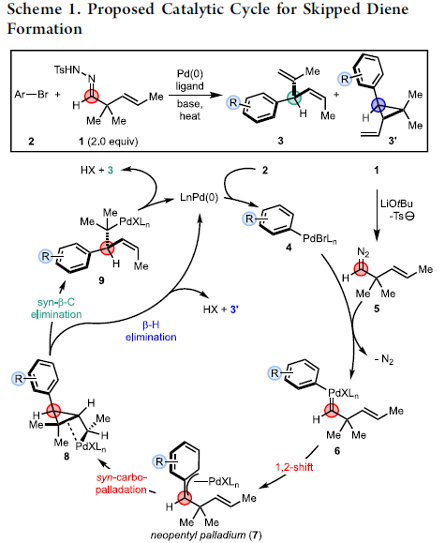
首先,作者提出如下合理的反应机理 (Scheme 1)。
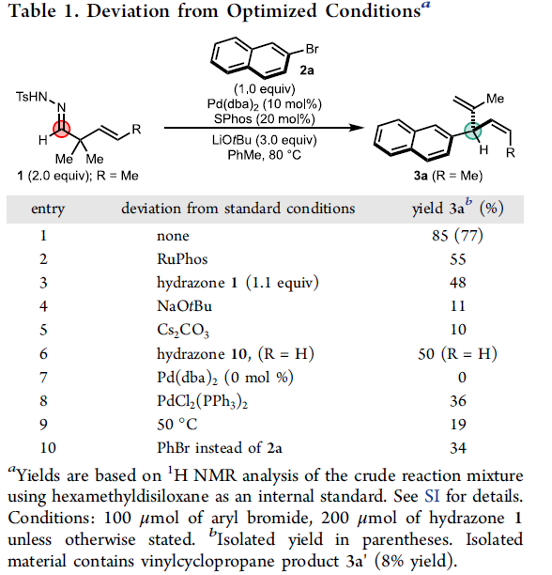
同时,作者采用腙(E)-1与萘基溴2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Pd(dba)2作为催化剂,SPhos作为配体,LiOtBu作为碱,甲苯作为反应溶剂,反应温度为80oC,最终获得85%收率的Z-SD (Z-skipped diene)产物3a ((Z)-3a:3′=10:1)。
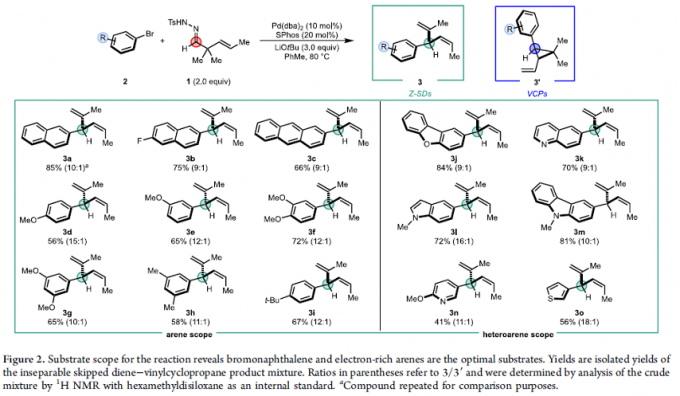
在上述的最佳反应条件下,作者首先对一系列芳基溴底物的应用范围进行考察 (Figure 2)。研究表明,各类萘基溴、蒽基溴以及苯环不同位置具有单一或多重供电子基团取代的苯基溴底物,均能够较好地与上述的标准反应条件兼容,并以中等至良好的反应收率,获得相应的(Z)-产物3a–3i。同时,作者进一步发现,各类杂环芳基溴底物同样能够有效地参与上述的合成转化过程,进而以中等至良好的反应收率,获得相应的(Z)-产物3j–3o。
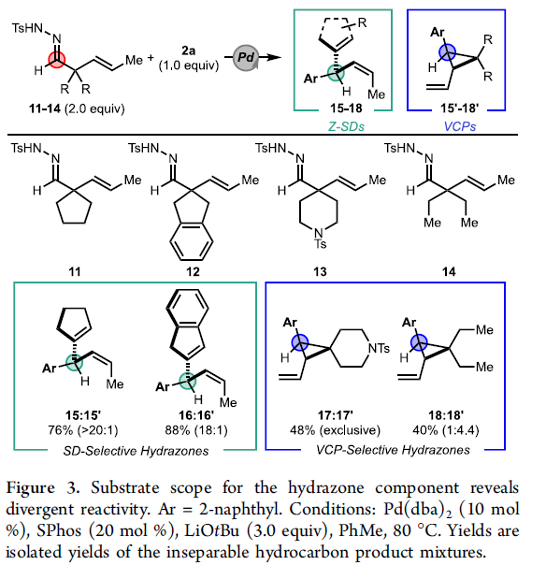
之后,作者进一步对各类腙底物的应用范围进行考察 (Figure 3)。研究表明,α,α-二取代腙中的烷基取代基对上述反应过程的选择性具有较为显著的影响,采用对称的腙底物11与12时,分别能够获得具有优良选择性与反应收率的Z-SD产物15与16。然而,采用腙底物13时,则仅能够以48%的收率,获得相应的VCP (vinylcyclopropane)产物17′;采用α,α-二乙基取代的腙底物时,则同样能够以40%的收率,获得相应的VCP 产物18′ (18:18′=1:4.4)。
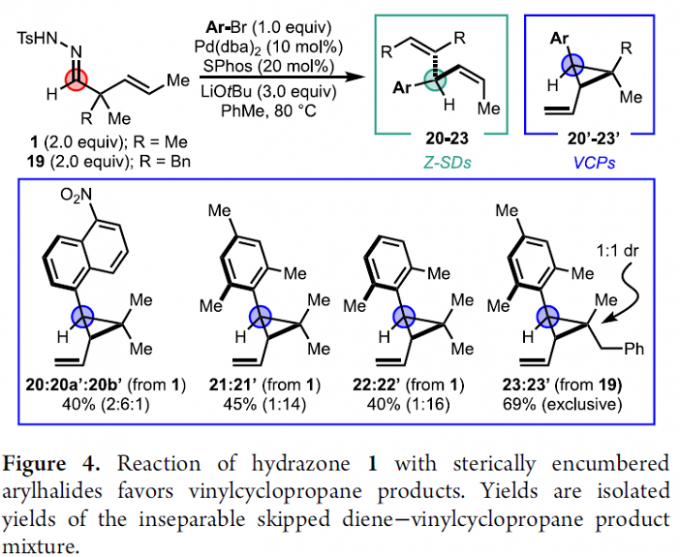
同时,作者通过一系列实验发现,芳卤底物的立体环境对钯中间体8的反应路径具有显著影响 (Figure 4)。由此进一步提出,空间相互作用能够提高C-C键的旋转能垒以及syn–β-碳消除过程的活化能垒,进而有利于β-氢消除过程的顺利进行。
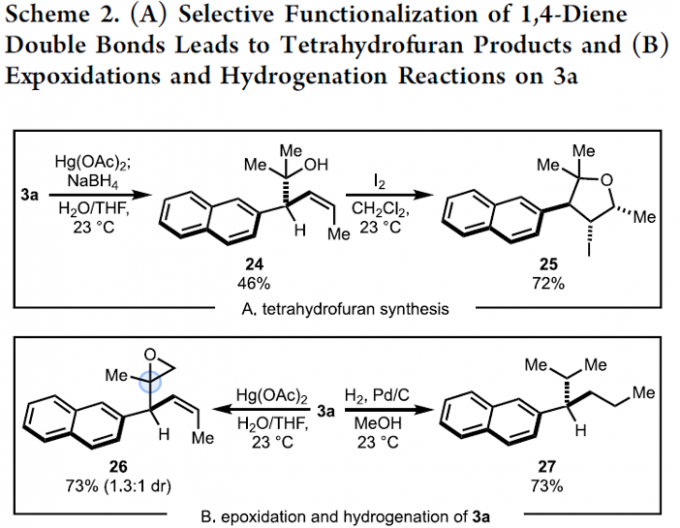
而且,作者进一步发现,相应的Z-SD产物3a能够进一步转化为多种不同类型的有机砌块 (Scheme 2),进而表明这一全新的交叉偶联策略具有潜在的合成应用价值。
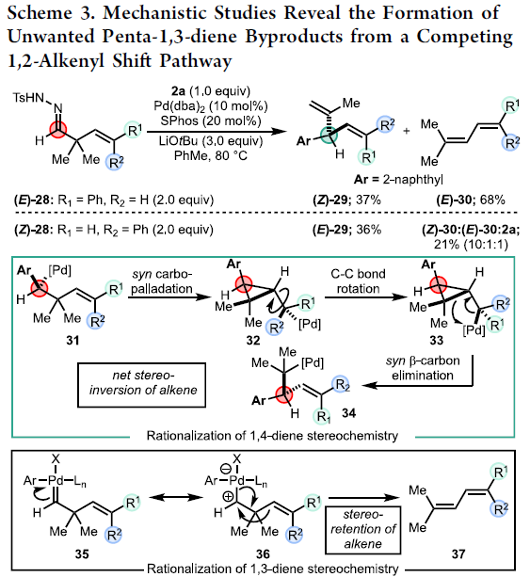
接下来,作者通过相关的实验研究 (Scheme 3),进一步表明,反应过程中涉及syn–β-碳消除步骤[10]。同时,1,4-二烯以及乙烯基环丙烷产物的形成可能经历相同的中间体8 (Scheme 1)。并且,通过钯卡宾中间体35的协同1,2-烯基迁移步骤,形成相应的1,3-二烯产物(E)-30与 (Z)-30。
总结
S. M.Wilkerson-Hill研究团队成功设计出一种全新的通过钯催化剂参与的2,2-二烷基-3-(E)-烯基N-对甲苯磺酰腙与芳基溴之间的发散交叉偶联反应方法学,进而顺利实现各类 Z-SD与VCP的分子的立体选择性构建。这一全新的交叉偶联策略具有良好的反应收率、立体专一性与选择性以及优良的官能团兼容性等优势。
参考文献
[1] Y. Hayasi, M. Riediker, J. S. Temple, J. Schwartz, Tetra. Lett. 1981, 28, 2629. doi: 10.1016/S0040-4039(01)92955-7. [2] M. Mailig, A. Hazra, M. K. Armstrong, G. Lali, J. Am. Chem. Soc. 2017, 139, 6969. doi: 10.1021/jacs.7b02104. [3] J. Y. Hamilton, D. Sarlah, E. M. Carreira, J. Am. Chem. Soc. 2013, 135, 994. doi: 10.1021/ja311422z. [4] B. M. Trost, G. D. Probst, A. Schoop, J. Am. Chem. Soc. 1998, 120, 9228. doi:10.1021/ja981540n. [5] A. Delbrassinne, M. Richald, J. Janssens, R. Robiette, Eur. J. Org. Chem. 2021, 2862. doi: 10.1002/ejoc.202100430. [6] M. S. McCammant, L. Liao, M. S. Sigman, J. Am. Chem. Soc. 2013, 135, 4167. doi: 10.1021/ja3110544. [7] H. Corlay, E. Fouquet, W. B. Motherwell, Tetra. Lett. 1996, 37, 5983. doi: 10.1016/0040-4039(96)01238-5. [8] L. Wang, L. Wang, M. Li, Q. Chong, F. Meng, J. Am. Chem. Soc. 2021, 143, 12755. doi: 10.1021/jacs.1c05690. [9] W. W. Epstein, C. D. Poulter, Phytochemistry, 1973, 12, 737. doi: 10.1016/0031-9422(73)80670-3. [10] M. E. O’Reilly, S. Dutta, A. S. Veige, Chem. Rev. 2016, 116, 8105. doi: 10.1021/acs.chemrev.6b00054.





















No comments yet.