本文作者:杉杉
导读
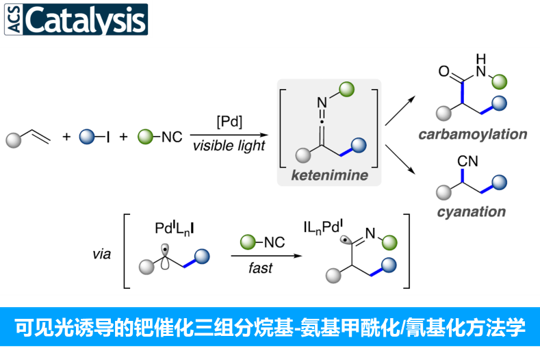
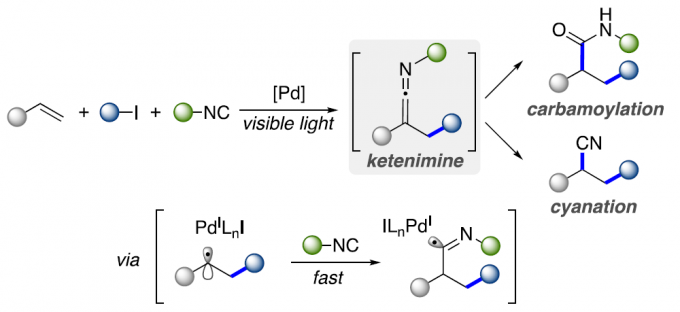
近日,Texas大学的V. Gevorgyan课题组在ACS Catal.中发表论文,报道一种通过可见光诱导的钯催化烯基底物的三组分一锅烷基-氨基甲酰化以及氰基化反应方法学。在这一全新的合成转化策略中,能够通过廉价易得的烯基化合物、烷基碘以及异腈作为起始原料,进而顺利完成一系列具有较高应用价值的酰胺以及腈分子的构建。上述的反应过程中涉及烯酮亚胺 (ketenimine) 活性中间体的原位形成。同时,上述的三组分反应策略同样能够较为高效地实现一系列四唑以及脒类化合物的制备。
Three-Component Visible-Light-Induced Palladium-Catalyzed 1,2-Alkyl Carbamoylation/Cyanation of Alkenes
X. Jia, Z. Zhang, V. Gevorgyan, ACS Catal. 2021, 11, 13217. doi: 10.1021/acscatal.1c04183.
正文
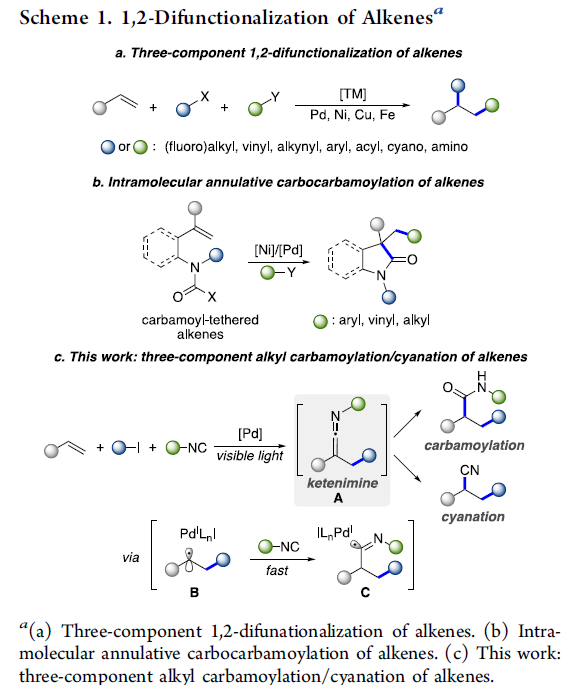
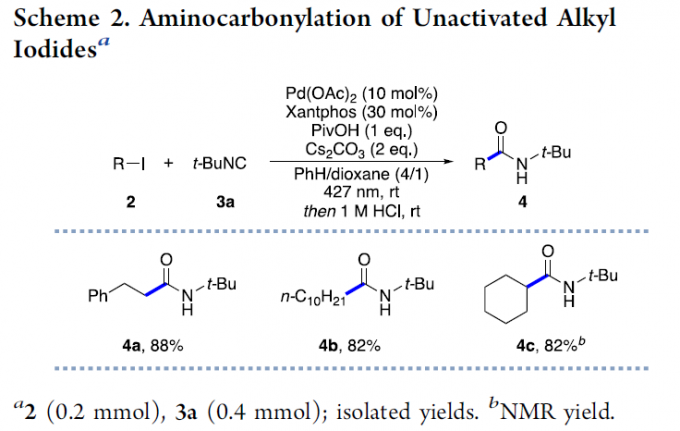
烯基化合物的多组分1,2-双官能团化方法学是一种具有较高应用价值的合成转化策略。采用这一策略,能够选择较为廉价易得的起始原料,通过一步的反应过程,较为高效地实现各类复杂有机分子的构建 (Scheme 1a)。其中,烯基化合物的1,2-烷基-氨基甲酰化方法学的研究尤其备受关注。并且,这一策略能够广泛应用于一系列较为重要的酰胺分子的构建[1]。目前,已经有文献报道,通过烷基-氨基甲酰化策略进行的双组分分子内环化反应方法学 (Scheme 1b) [2]。然而,对于三组分烷基-氨基甲酰化方法学的相关研究,目前尚未有相关的文献报道。这里,V. Gevorgyan课题组基于采用烯酮亚胺 (ketenimine)中间体参与的合成转化方法学的相关研究报道[3]与通过异腈类化合物参与的自由基加成策略,构建烯酮亚胺分子[4]-[5]以及本课题组前期相关研究报道 (Scheme 2) [6]的启发,成功设计出一种较为温和的通过可见光诱导的钯催化烯基化合物的三组分一锅1,2-烷基-氨基甲酰化以及氰基化反应方法学 (Scheme 1c)。
首先,作者采用苯乙烯1a、烷基碘2a与t-BuNC作为模型底物,进行相关烷基-氨基甲酰化反应条件的优化筛选 (Table 1)。进而确定最佳的烷基-氨基甲酰化反应条件为:采用Pd G3作为前催化剂,Xantphos作为配体,新戊酸作为添加剂,Cs2CO3作为碱,反应温度为室温,在苯与1,4-二噁烷的混合溶剂以及采用波长为427 nm的可见光 (Kessil lamp)辐射。之后,通过酸性条件下的水解 (1 M HCl)过程,最终获得65%收率的烷基-氨基甲酰化产物 5a。
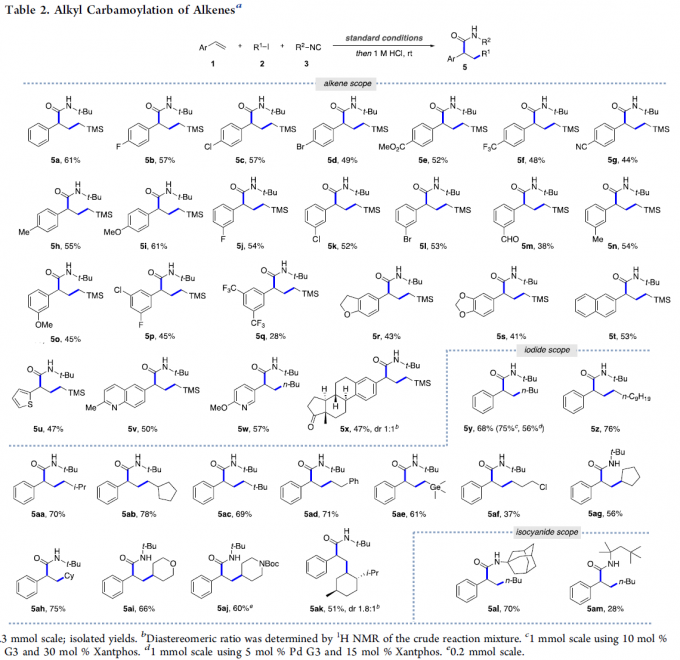
在上述的最佳反应条件下,作者首先对一系列烯基底物的应用范围进行考察 (Table 2)。研究表明,一系列芳基对位与间位中带有供电子与吸电子基团取代的苯乙烯底物均能较好地与上述的标准反应条件兼容,并获得中等收率的烷基-氨基甲酰化产物5a–5s。同时,研究发现,2-乙烯基萘与杂芳基乙烯底物同样能够较好地参与上述的三组分反应过程,并获得相应的目标产物5t–5w (47-57% 反应收率)。值得注意的是,这一全新的三组分反应策略同样能够应用于结构更为复杂的芳乙烯底物,例如,通过上述的反应过程,能够顺利完成estrone衍生物5x的制备。
之后,作者进一步对一系列烷基碘底物的应用范围进行考察 (Table 2)。研究发现,一系列一级与二级烷基碘底物,均能够顺利地参与上述的三组分反应过程,并获得中等至良好反应收率的目标产物5y–5z以及5aa–5ah。同时,该小组发现,一系列具有α-germyl以及γ-氯基团的一级烷基碘底物,同样能够与上述的标准反应条件良好地兼容。并且,该小组进一步发现,一系列饱和的杂环烷基碘衍生物,同样能够有效地完成上述的合成转化过程,并获得相应的烷基-氨基甲酰化产物5ai–5ak (51-66% 反应收率)。接下来,该小组进一步对异腈底物的应用范围进行深入研究。作者观察到,各类三级异腈底物,例如1-金刚烷基异腈与1,1,3,3-四甲基丁基异腈,均能够顺利地参与上述的三组分反应过程,并获得相应的目标产物5al (70% 反应收率)与5am (28% 反应收率)。
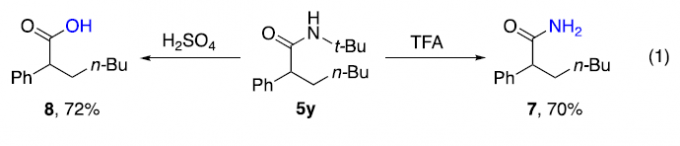
同时,该小组研究发现,通过上述的三组分反应过程获得的N-叔丁基酰胺产物5y,在酸性条件下,能够进一步转化为未保护的酰胺化合物7或相应的羧酸产物8(eq 1)。
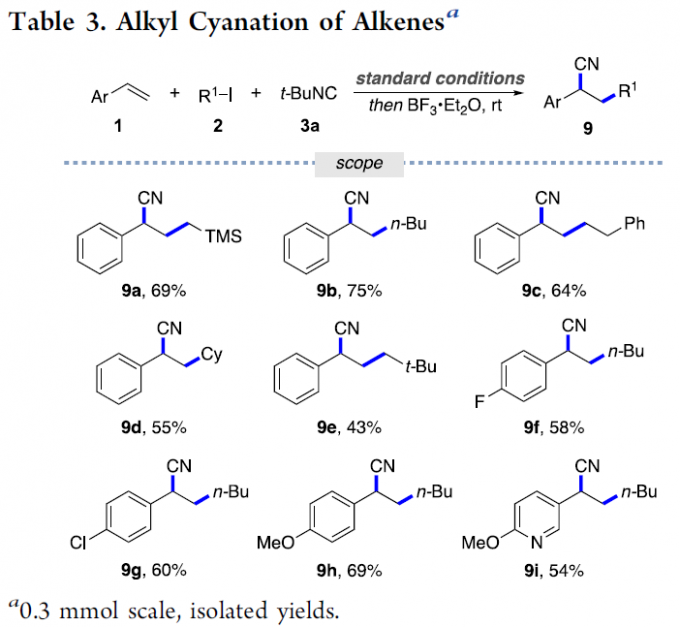
接下来,该小组开始对相关的烷基氰基化反应进行进一步研究 (Table 3)。实验表明,通过将上述的三组分反应过程,形成的烯酮亚胺中间体,采用BF3•Et2O进行处理,即可获得预期的烷基氰基化产物[7]。同时,作者进一步对这一全新的烷基氰基化方法学中的底物应用范围进行深入研究。该小组发现,一系列侧链位置中具有一级与二级烷基取代的碘代烷、苯基中具有不同基团取代的苯乙烯以及3-乙烯基吡啶底物,均能够顺利地参与上述的氰基化过程,并获得相应的目标产物9a–9i (43-75% 反应收率)。
同时,研究发现,通过上述的三组分反应策略,同样能够有效地完成其它含氮有机分子的合成,例如未保护的苄基四唑10以及脒类化合物11 (Scheme 3)。
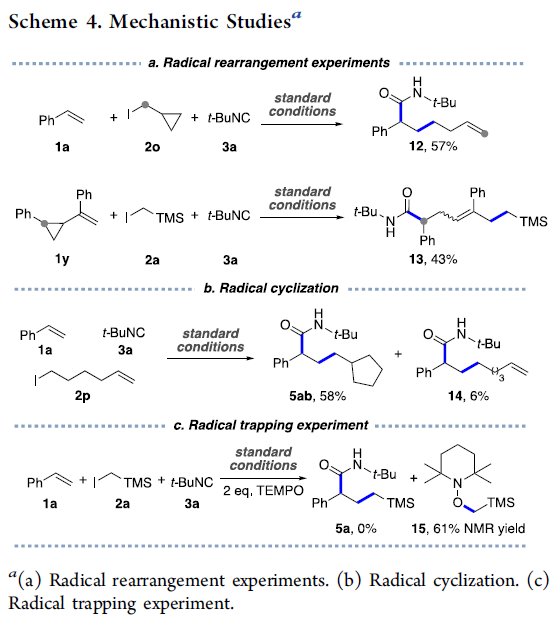
接下来,作者进行一系列相关的机理实验研究 (Scheme 4)。首先,作者通过自由基钟 (radical clock)与自由基捕获实验 (radical trap)表明,上述的三组分反应过程中涉及自由基中间体的形成。因此,在苯乙烯1a与t-BuNC以及具有环丙基取代的烷基碘2o之间的反应过程中,能够通过亚甲基环丙基自由基中间体的开环过程,形成端烯产物12 (Scheme 4a)。并且,同样能够通过自由基中间体对于烯基化合物1y的加成反应,之后,再通过区域选择性地重排过程,形成相应的苄基自由基,并进一步由t-BuNC进行捕获,进而获得三取代烯基化合物13 的两种立体异构体的混合物 (Scheme 4a)。之后,该小组观察到,采用烯基卤2p参与上述的三组分反应时,能够获得具有环状取代基团的产物5ab,这源自于最初的5-exo–trig自由基环化步骤 (Scheme 4b)。接下来,研究发现,向反应体系中加入自由基捕获剂,例如TEMPO时,则获得61%收率的自由基捕获产物15 (Scheme 4c)。
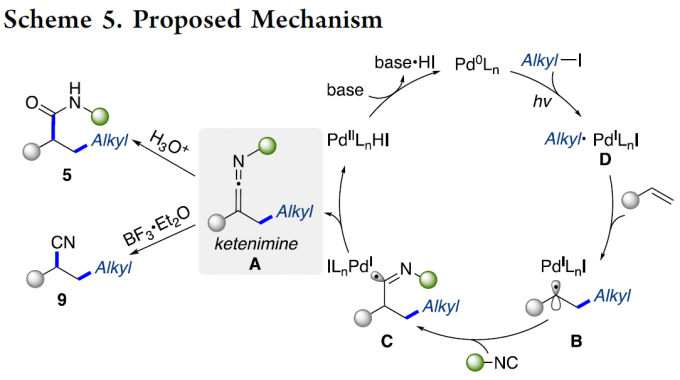
基于上述的实验观察以及前期的相关文献报道[6],作者提出一种合理的反应机理 (Scheme 5)。首先,通过光激发的Pd(0)配合物与烷基碘之间的SET反应过程,形成混合型Pd(I)-自由基 (hybrid alkyl Pd(I)-radical)中间体D。之后,通过D与烯基化合物之间的自由基加成过程,形成混合型苄基Pd自由基B,并通过异腈的迅速捕获,形成亚氨基自由基 (imidoyl radical) C。接下来,自由基C经历后续的β-H消除步骤,形成活性烯酮亚胺中间体A,同时,使钯催化剂的再生。最后,A通过酸性条件下的水解过程,形成酰胺产物5;或将A通过Lewis酸进行处理,转化为相应的腈产物9。
总结
V. Gevorgyan课题组成功设计出一种通过可见光诱导的钯催化策略,进而顺利实现烯基化合物、烷基碘与异腈之间的三组分1,2-烷基官能化反应。其反应过程中涉及活性烯酮亚胺中间体的形成,并在一锅反应条件下,进一步转化为一系列酰胺、腈、四唑以及脒等含氮有机分子。这一全新的三组分反应方法学具有反应条件温和、底物应用范围广泛以及优良的官能团兼容性等优势。
参考文献
[1] J. S. Carey, D. Laffan, C. Thomson, M. T. Williams, Org. Biomol. Chem. 2006, 4, 2337. doi: 10.1039/B602413K. [2] (a) C. Chen, J. Hu, J. Su, X. Tong, Tetrahedron Lett. 2014, 55, 3229. doi: 10.1016/j.tetlet.2014.04.019.(b) A. Whyte, K. I. Burton, J. Zhang, M. Lautens, Angew. Chem. Int. Ed. 2018, 57, 13927. doi: 10.1002/anie.201808460.
(c) Y. Li, F. P. Zhang, R. H. Wang, S. L. Qi, Y. X. Luan, M. Ye, J. Am. Chem. Soc. 2020, 142, 19844. doi: 10.1021/jacs.0c09949.
[3] (a) P. Lu, Y. Wang, Chem. Soc. Rev. 2012, 41, 5687. doi: 10.1039/C2CS35159E.(b) M. Alajarin, M. Marin-Luna, A. Vidal, Eur. J. Org. Chem. 2012, 5637. doi: 10.1002/ejoc.201200383.
[4] R. Cannalire, J. Amato, V. Summa, E. Novellino, G. C. Tron, M. Giustiniano, J. Org. Chem. 2020, 85, 14077. doi: 10.1021/acs.joc.0c01946. [5] Q. Li, H. Jin, Y. Liu, B. Zhou, Synthesis 2020, 52, 3466. doi: 10.1055/s-0040-1707229. [6] (a) D. Kurandina, M. Parasram, V. V. Gevorgyan, Angew. Chem. Int. Ed. 2017, 56, 14212. doi: 10.1002/anie.201706554.(b) D. Kurandina, M. Rivas, M. Radzhabov, V. Gevorgyan, Org. Lett. 2018, 20, 357. doi: 10.1021/acs.orglett.7b03591.
(c) P. Chuentragool, D. Yadagiri, T. Morita, S. Sarkar, M. Parasram, Y. Wang, V. Gevorgyan, Angew. Chem. Int. Ed. 2019, 58, 1794. doi: 10.1002/anie.201812398.
[7] Z. Liu, S. Cao, J. Wu, G. Zanoni, P. Sivaguru, X. Bi, ACS Catal. 2020, 10, 12881. doi: 10.1021/acscatal.0c02867.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.