本文作者:杉杉
导读
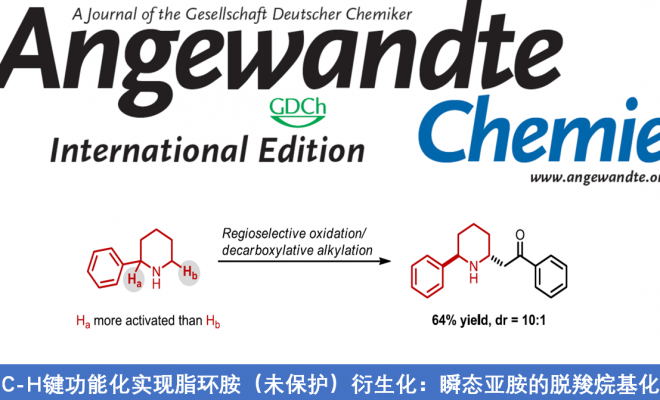
近日,佛罗里达大学(University of Florida)Daniel Seidel课题组在Angew. Chem. Int. Ed.上发表论文,实现了未保护脂环胺的直接α-C-H键功能化,该反应使用简单易得的中间体,通过与简单酮类氧化形成瞬态亚胺中间体,可在温和的条件下与β-酮酸进行烷基化反应,从而获得具有价值的β-氨基酮化合物。对于具有α-取代基的底物,实现了区域选择性α’-烷基化。此外,该方法通过引入SNAr步骤,可一锅合成多环二氢喹诺酮化合物。
Diversification of unprotected alicyclic amines via C-H bond functionalization: Decarboxylative alkylation of transient imines
Anirudra Paul, Jae Hyun Kim, Scott D. Daniel, and Daniel Seidel*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202011641 https://doi.org/10.1002/anie.202011641
正文
β-氨基酮化合物广泛出现于有机合成和药物化学中,而对脂环族胺的C-H键官能团化仍然是一个非常活跃的研究领域。虽然已实现了3°胺或受保护的2°胺C-H功能化,但从2°脂环族胺(未保护)直接实现α-官能化的方法仍然受到限制(Scheme 1)。此外,具有α-取代基的2°脂环族胺的α’-C-H键官能化也极具挑战性,尤其是具有电子活化性质的取代基,这些取代基有利于在取代位点进行官能团化。利用已知的锂酰胺与简单的酮类氧化反应生成亚胺的能力(e.g., 1 → 2, Scheme 1),本课题组最近开发了一种新的方法[1],实现未保护的脂环族胺的C-H键官能化。具体来说,由酰胺锂1氧化产生瞬态环状亚胺2,再与有机锂亲核试剂反应,从而来获得α-官能团化产物。同时,还实现了α-取代脂环族胺的区域选择性α’-C-H键官能团化。通过使用路易斯酸活化亚胺中间体,亲核试剂的范围可以扩展到其他有机金属,如Grignard试剂。事实证明,α-取代胺的α’-C-H键官能团化与路易斯酸活化不能兼容,阻碍了亲核试剂的范围。然而,当使用非有机金属亲核试剂时,可实现α’-C-H键功能化。在此,佛罗里达大学Daniel Seidel课题组报道了一种利用瞬态亚胺2与β-酮酸3发生的脱羧烷基化反应,从而来获得β-氨基酮化合物4。同时,利用邻氟芳基-β-酮酸5,可通过SNAr反应获得多环胺6。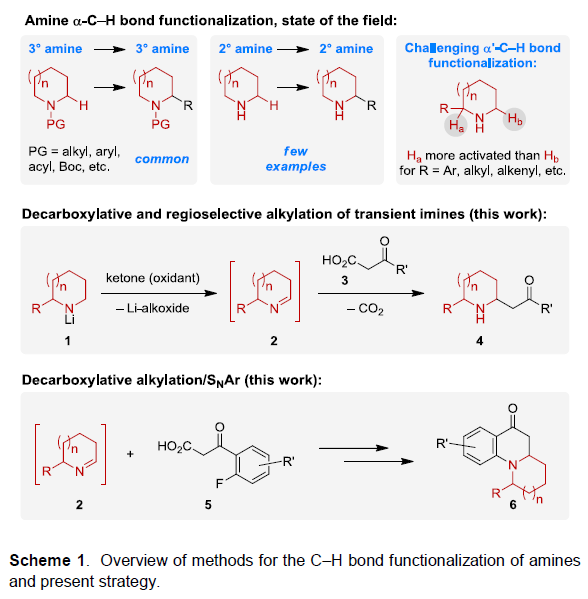
Mannich反应以及使用β-酮酸的脱羧反应,是从亚胺合成β-氨基酮的有效方法,但这些反应中使用的可烯化的环状亚胺,在很大程度上仍限于易得的脂环式亚胺,如1-吡咯啉(pyrroline)和1-哌啶(piperideine)。这可能是因为可烯化的环状亚胺,特别是在α-位具有取代基的手性变体可用性/稳定性比较有限。为了确定通过酰胺化锂原位生成脂环族亚胺,是否与脱羧Mannich法兼容,作者以哌啶和β-酮酸3a为模型反应底物评估了一系列反应条件(Scheme 2)。胺去质子化后再与三氟苯乙酮反应获得1-哌啶,再加入β-酮酸3a(1.5当量),然后在室温下搅拌,以39%的产率获得了所需的β-氨基酮4a。而使用2.5当量的3a,可将4a的产率提高到50%。此外,考虑到由三氟苯乙酮还原产生的Li-醇盐可能会干扰随后的脱羧烷基化反应,因此需加入酸性添加剂。实际上,在所有情况下都观察到收率有所提高。作为添加剂,三氟乙酸(TFA)优于乙酸,大概是因为乙酸锂仍然具有足够的碱性部分阻止加成过程。在最佳条件下,以76%的收率获得产物4a。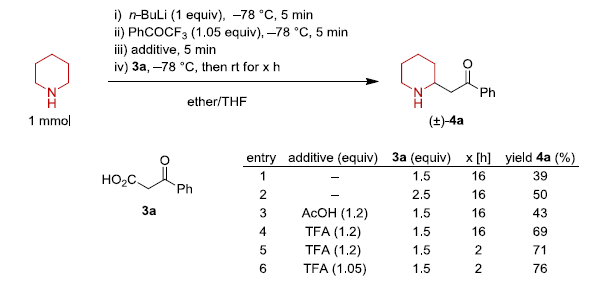
在获得上述最佳反应条件后,作者开始对各种脂环族胺和β-酮酸的底物范围进行扩展(Scheme 3)。反应结果表明,具有不同环状取代基的脂肪族胺、以及不同芳基、烷基的β-酮酸反应时,均可获得相应的β-氨基酮4a-4o。同时,对于具有α-取代基的胺底物,均可观察到α’-位的区域选择性,获得具有良好的非对映选择性(d.r. = 1.1:1-20:1)的产物4p-4aa。此外,当在上述反应后加入邻氟芳基-β-酮酸5后,无需分离中间体,即可进行SNAr反应,从而有效的合成多环二氢喹诺酮类化合物6a-6m。因此,这些产物均可直接从未保护的胺中获得,但采用其他方法制备则具有很大的挑战。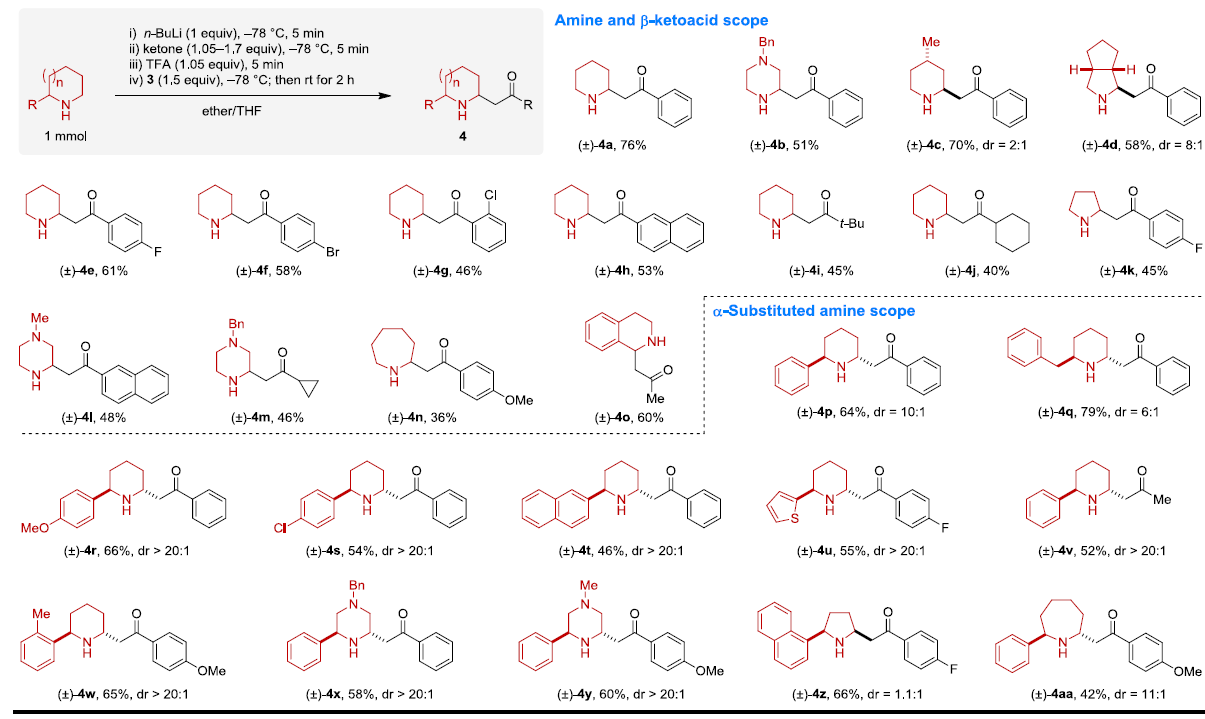
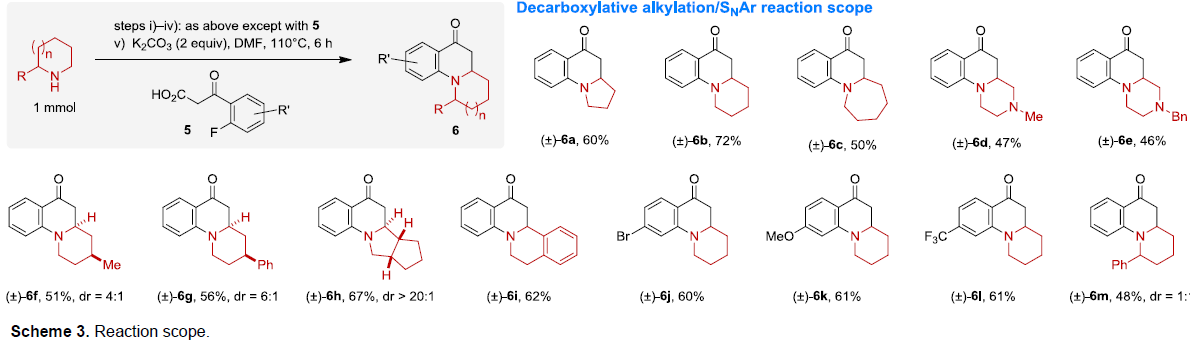
值得注意的是,上述产物4p-4y主要以反式非对映异构体的形式获得(Scheme 3)。实际上,反式非对映异构体是这些反应的动力学产物,因为已经确定相应的顺式异构体在热力学上更稳定[2]。这些非对映异构体的相互转化也是可能的,大概是通过逆Mannich或逆共轭加成途径来实现转化。实际上,仅改变产物4p的合成中的反应条件就可以完全逆转非对映选择性,从而有利于顺式异构体(Scheme 4)。
总结
佛罗里达大学Daniel Seidel课题组通过涉及区域选择性C-H键功能化的脱羧Mannich过程,实现了未保护脂环族胺的α-烷基化。同时,只需在整个反应过程中增加一个SNAr步骤,即可合成多环二氢喹诺酮衍生物。
参考文献
[1] a) W. Chen, L. Ma, A. Paul, D. Seidel, Nat. Chem. 2018, 10, 165; b) A.Paul, D. Seidel, J. Am. Chem. Soc. 2019, 141, 8778; c) W. Chen, A.Paul, K. A. Abboud, D. Seidel, Nat. Chem. 2020, 12, 545.[2] a) D. Compère, C. Marazano, B. C. Das, J. Org. Chem. 1999, 64, 4528;b) F.-X. Felpin, J. Lebreton, J. Org. Chem. 2002, 67, 9192; c) G. Zheng,L. P. Dwoskin, P. A. Crooks, J. Org. Chem. 2004, 69, 8514; d) J. Ryan,M. Šiaučiulis, A. Gomm, B. Maciá, E. O’Reilly, V. Caprio, J. Am. Chem.Soc. 2016, 138, 15798.


















No comments yet.