作者:石油醚
本期热点研究,我们邀请到了本文第一作者,来自中国科学院微生物研究所的范洁博士为我们分享。
2023年3月3日和5月8日,Angew先后发表了中国科学院微生物研究所尹文兵研究员团队的科研成果,分别题为「Pretrichodermamide A biosynthesis reveals the hidden diversity of epidithiodiketopiperazines」和「An ortho-quinone methide mediates disulfide migration in the biosynthesis of epidithiodiketopiperazines」。尹文兵研究团队通过解析多硫代二酮哌嗪(ETP)典型次级代谢产物pretrichodermamide A复杂生物合成步骤,揭示了非沉默途径次级代谢产物隐秘结构多样性的形成机制(Angewandte Chemie, 2023, 135, e202217212),阐明了关键中间体邻亚甲基苯醌(ortho-quinone methide,o-QM)参与非典型α, β’-二硫桥形成的新颖酶催化机制(Angewandte Chemie, 2023, e202304252)。
“Pretrichodermamide A biosynthesis reveals the hidden diversity of epidithiodiketopiperazines”
Jie Fan, Huomiao Ran, Peng-Lin Wei, Yuanyuan Li, Huan Liu, Shu-Ming Li, Youcai Hu, Wen-Bing Yin*
Angew. Chem. Int. Ed., 2023, 135, e202217212, Doi: 10.1002/ange.202217212.
“An ortho-quinone methide mediates disulfide migration in the biosynthesis of epidithiodiketopiperazines”
Jie Fan, Huomiao Ran, Peng-Lin Wei, Yuanyuan Li, Huan Liu, Shu-Ming Li, Wen-Bing Yin*
Angew. Chem. Int. Ed., 2023, e202304252. Doi: 10.1002/ange.202304252
Q1. 请对成果作一个简单介绍。
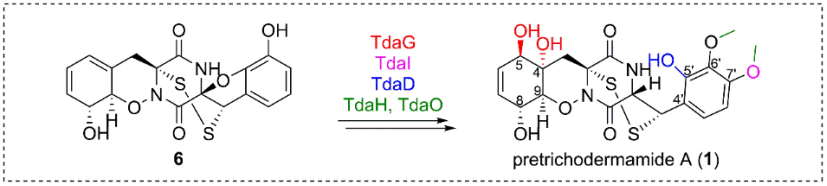
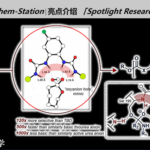
多硫代二酮哌嗪类化合物(ETPs)是一类由真菌产生的次级代谢产物,按照跨环二硫桥在二酮哌嗪母核(DKP)的连接位置,ETPs分为两类:一类具有α, α’-二硫桥,另一类具有α, β’-二硫桥。Pretrichodermamides是一类结构多种多样的ETPs,含有独特的α, β’-二硫桥、1, 2-噁嗪环和复杂的多环结构(A–F环,图1),独特的结构赋予这类化合物重要的生物活性。化学家成功利用不同合成策略对其脱硫开环产物trichodermamides进行了全合成,然而,仅仅1, 2-噁嗪环骨架的构建就需要繁琐的步骤和苛刻的条件,严重制约了此类化合物的药用开发。因此,研究pretrichodermamides的生物合成途径是理解该类次级代谢产物结构复杂性和多样性的关键手段,对药用ETP化合物的合成生物学开发具有重要意义。
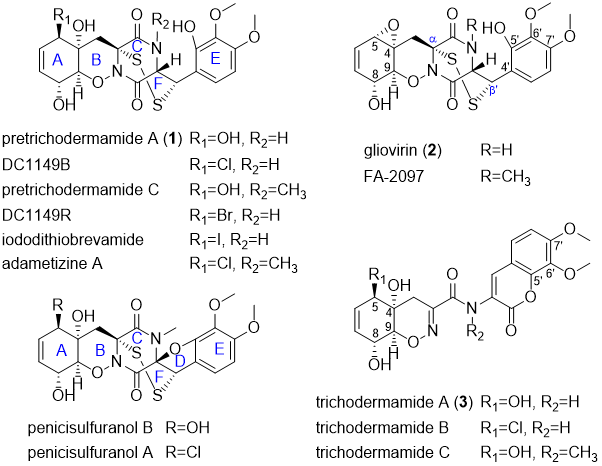
图1. 真菌中具有α, β’-二硫桥的ETP类化合物及其类似物
前期研究中,尹文兵团队在炭团木霉中鉴定了pretrichodermamide A和其生物合成基因簇(tda基因簇)(Chem. Sci., 2021, 12, 4132-4138)。在「Pretrichodermamide A biosynthesis reveals the hidden diversity of epidithiodiketopiperazines」论文中,作者通过基因敲除和体外蛋白反应解析了α, β’-二硫桥形成后的pretrichodermamide A生物合成步骤,发现两个细胞色素P450氧化酶TdaB和TdaQ分别催化C8, C9过氧化和DKP母核中N10羟基化,再经由自发环化形成独特的1, 2-噁嗪环(B环),这一发现不同于前人报道的1, 2-噁嗪环形成机制,为1, 2-噁嗪环的酶法合成提供了新元件;细胞色素P450氧化酶TdaI催化C7′-OH的形成,甲基转移酶TdaO和TdaH分别负责C7’和C6′-羟甲基化,完成了E环的修饰;还原酶TdaD将呋喃环(D环)还原,形成C5′-OH;细胞色素P450氧化酶TdaG催化环己二烯结构中(A环)C4, C5的氧化。通过鉴定以上7个修饰酶,作者推测了α, β’-二硫桥形成后的pretrichodermamide A复杂生物合成步骤时,有趣的是,除了途径涉及的中间体外,还发现大量超过20个隐秘的ETP类化合物,揭示了ETP次级代谢产物隐秘结构多样性的形成机制。
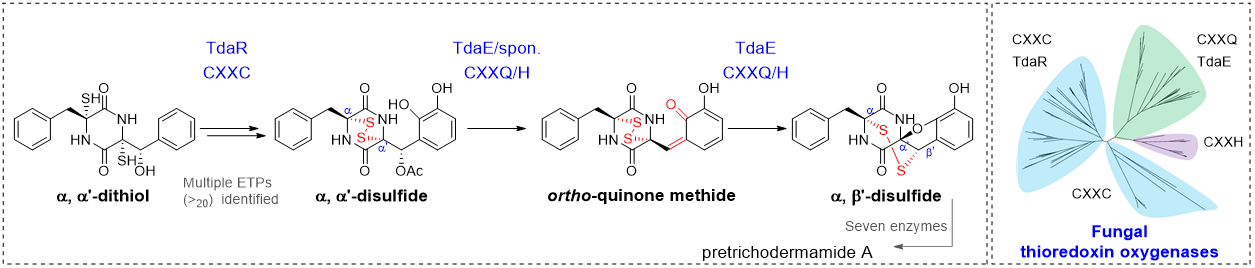
「An ortho-quinone methide mediates disulfide migration in the biosynthesis of epidithiodiketopiperazines」论文旨在解析α, β’-二硫桥形成前的生物合成步骤,阐明pretrichodermamide A中非典型α, β’-二硫桥的形成机制。作者通过簇内修饰基因敲除和次级代谢产物分离,共鉴定20个新结构,其中大多数为pretrichodermamide A生物合成中的分支途径产物,体现了非沉默途径中隐秘次级代谢产物结构的多样性。对这些结构进行分析,推测了α, β’-二硫桥形成前的pretrichodermamide A生物合成步骤,发现α, α’-二硫桥、β’-乙酰基和C5‘, C6′-羟基的形成,是构建α, β’-二硫桥的先决条件,体外蛋白反应证实了TdaE经由关键中间体o-QM,催化α, α’-二硫桥的迁移,进而形成非典型的α, β’-二硫桥。通过蛋白定点突变和体外反应,推测了一个新颖的α, β’-二硫桥酶催化机制,谷氨酰胺残基(Q140)夺取C5‘-羟基氢,使得β’-乙酰基基团离去,形成o-QM中间体;紧接着,半胱氨酸残基(C137)进攻α, α’-二硫桥,使其发生迁移,形成α, β’-二硫桥和呋喃环(图2)。生物信息学和系统进化分析结果表明,真菌硫桥形成相关的黄素依赖型氧化酶分为四类,具有高度保守CXXC motif的氧化酶负责催化硫醇氧化,形成二硫桥;具有CXXQ和CXXH motif的氧化酶负责催化α, α’-二硫桥的迁移,形成非典型的α, β’-二硫桥。
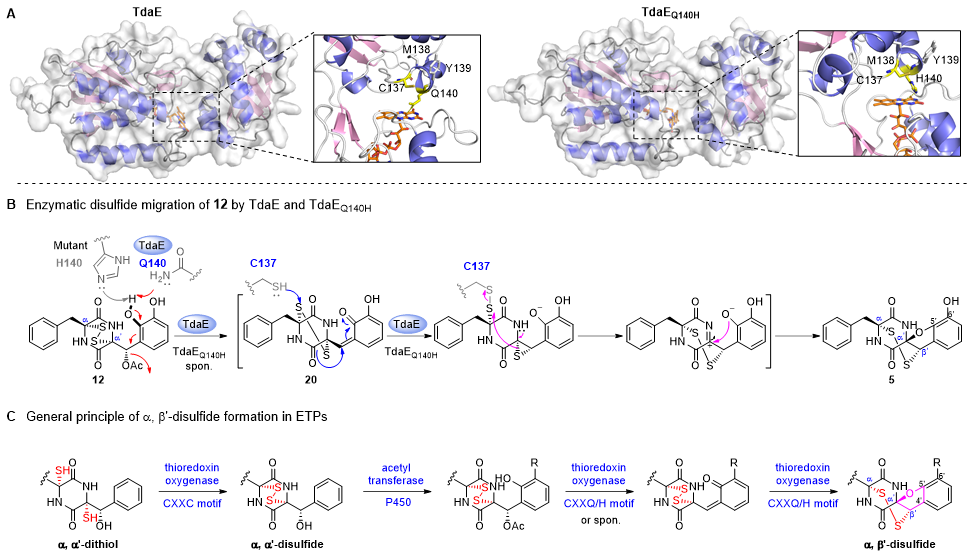
图2. ETP中非典型α, β’-二硫桥的形成机制
(A)TdaE和突变体TdaEQ140H的晶体结构预测分析;(B)黄素依赖型氧化酶催化α, β’-二硫桥形成的机制;(C)ETP类次级代谢产物非典型α, β’-二硫桥的生物合成步骤。
综上所述,通过解析pretrichodermamide A复杂生物合成步骤,作者揭示了非沉默途径次级代谢产物隐秘多样性的形成机制,阐明了二酮哌嗪骨架α, β’-二硫桥的普适性酶催化机制,通过利用这些修饰酶的催化特性,可实现ETP类化合物的可预测生物合成,为该类化合物的定向挖掘及多样性创制提供了新思路。
Q2. 有关本次研究的时候遇到过怎样的困难呢?又是怎样克服的呢
这项研究遇到的最大的困难则是pretrichodermamide A生物合成途径的解析。Pretrichodermamides由于其独特的α, β’-二硫桥、1, 2-噁嗪环和复杂的多环结构的特征,其修饰酶功能和生物合成途径的鉴定一直是研究的热点。本研究中我们选择以pretrichodermamide A为研究目标,首先对参与合成的22个基因进行敲除,但由于TdaG、TdaD等修饰酶的底物选择宽泛性,导致我们分离获得了大量分支化合物。再加上α, β’-二硫桥结构造成的底物不稳定性和细胞色素P450酶膜蛋白性质,大大影响了我们对Pretrichodermamide A生物合成途径的推测和验证。
为了克服底物稳定性难题,我们对反应体系、光照、温度、时间和环境O2含量等多种因素进行考评,构建了可用于酶蛋白验证的高效催化体系。除此之外,由于细胞色素P450酶膜蛋白的结构特征,导致我们在大肠杆菌、酵母及丝状真菌构巢曲霉异源表达未能成功表达,因此,我们以原始菌炭团木霉作为底盘,进行敲除tda基因簇、敲除单端孢霉烯合成基因和创制筛选标签等技术优化,成功构建了可用于鉴定TdaG等细胞色素P450酶的表达系统,为解析pretrichodermamide A生物合成途径奠定了坚实的技术支撑。
Q3. 本次研究主体,有没有什么让您感觉特别辛苦和烧脑呢?
在我们研究的过程中最头疼的是如何排除酶底物选择宽泛性和底物不稳定性所带来的干扰,大量分支化合物的干扰存在使得我们无法判断正确的生物合成顺序,使我们在整个验证历程中走了很多弯路。并且底物的超强不稳定性,进一步造成了主线合成途径前体的难以发现和获得,为此我们对整个菌株发酵、化合物分离、保存等多个流程工作进行了考究和改良,其中影响特别深刻的是黄素依赖型氧化酶TdaE的前体化合物和反应中间体o-QM的鉴定,光照、溶液、pH、温度等都会影响化合物的稳定性,因此我们都是反应前体现制现用、反应后立即进行仪器分析,全程避光低温保存,容不得一点疏忽和大意。除此之外,整个合成途径有多个细胞色素P450参与反应,我们为了鉴定这些酶的功能,尝试了在大肠杆菌、酵母及丝状真菌构巢曲霉多个系统进行了表达,但由于这种酶的膜结合特性和伴侣蛋白CPR的对应性,都一一宣告失败。最后,我们构建创制了来源菌的遗传操作系统,并对之进行多步优化改良,成功鉴定了细胞色素P450的蛋白功能。
总之,整个研究过程中我们一直坚持“大胆猜测,小心求证”和“如果没有条件,那就自己创造条件”,虽经历百般挫折,但终究是克服了过来。
Q4. 请您介绍一下尹文兵研究团队的研究方向?
以“合成生物学”的理念和策略,从真菌中发现活性分子并进行生物合成途径重建与调控及新的代谢途径设计,用化学语言诠释真菌合成次级代谢产物过程中涉及到的生物学问题。
Q5. 最后,有什么想对各位读者说的吗?
真诚与坚定是科学发现的重要基石,团队协作是科学发现的重要保证。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载





















No comments yet.