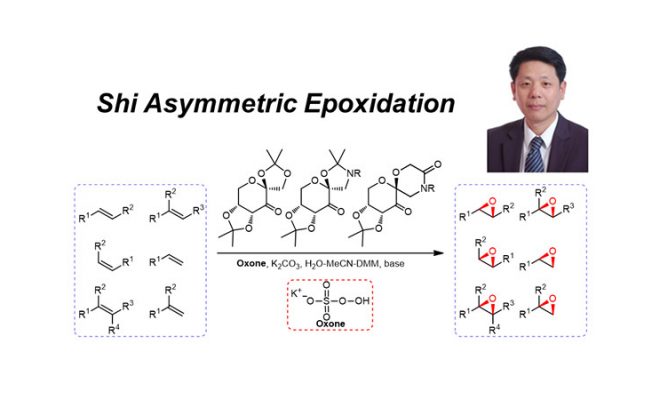
官能团化的底物的环氧化反应
1.1 端位双键的环氧化
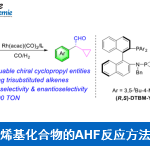
当使用ketone 2b进行不对称环氧化时发现产物显示出很好的立体选择性,并且有些脂肪端位双键可以被化学选择的氧化1。反应的过程的过渡态可能是和顺式双键一样,但是ketone2b对端位双键氧化的e.e.值要比顺式烯烃26的e.e.值稍低,这说明反应的实际过渡态是介于螺型过渡态和平面型过渡态之间的。N-芳基取代的手性酮ketone 3c-3f同样被用来参与端位双键的环氧化反应2,但是反应的效率要高于ketone 2b,产率最高可至100%,并且有大约80% e.e.
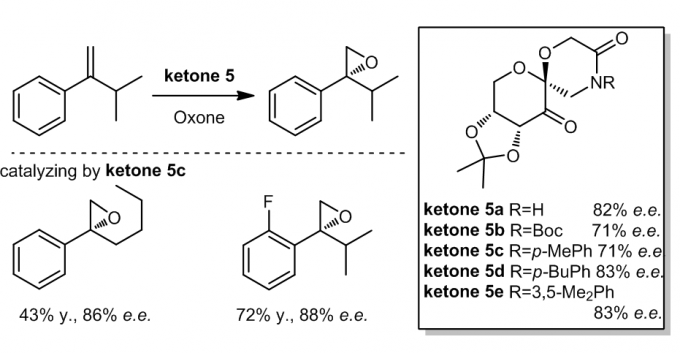
另一种内酰胺的手性酮催化剂ketone 5被开发出来,并且参与了催化的1,1-二取代的端位烯烃,立体选择性最高可达88% e.e.,反应的过渡态可能是平面型的过渡态。这类的手性酮催化剂的催化效果是很好的,并且对于反式双键和三取代的双键也有很好的效果,特别是ketone 5f3.
1.2 区域选择的和立体选择地环氧化共轭二烯烃
在共轭二烯烃的环氧化过程中,生成单环氧化物和双环氧化物的反应只见存在竞争的关系,反应中主要需要关注的就是反应的化学选择性4。
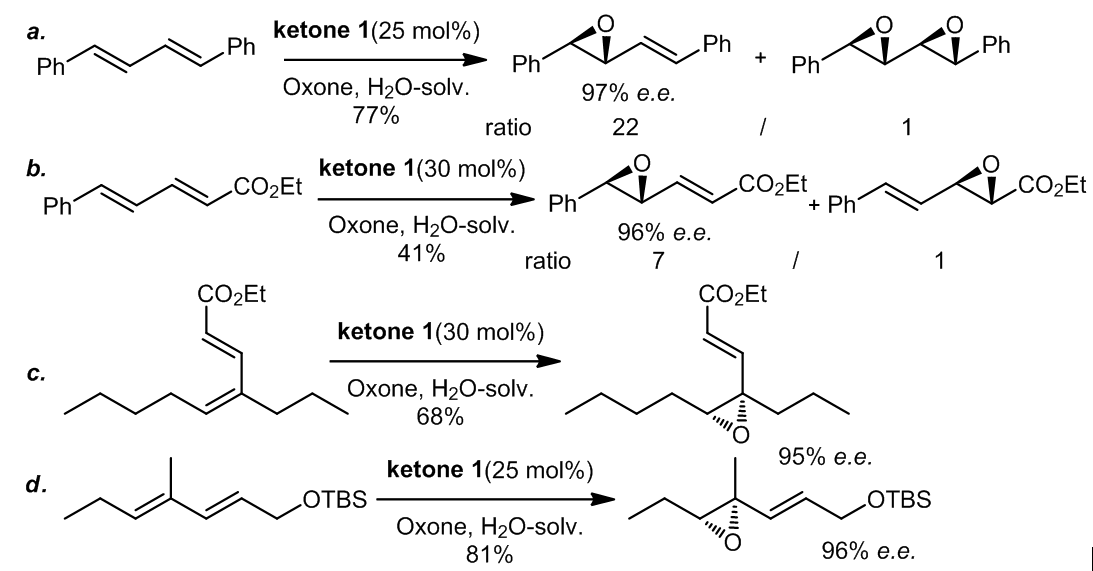
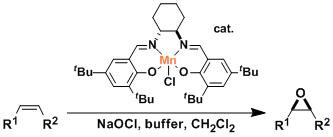
生成二环氧化物的过程可以通过催化剂的浓度来控制,因为这样可以减小过度氧化的程度,从而生成单环氧化物(等式a),但是由于反应先生成的单环氧化物可以影响第二次氧化的立体选择性,最高可以达到97%e.r.;此外,电子密度丰富的双键更加容易进行环氧化(等式b),并且反应底物的两个双键中若有一个是三取代的双键,那么这个三取代的双键就会更加容易的参与反应,并且反应的立体选择性也会很好(等式c,d)。
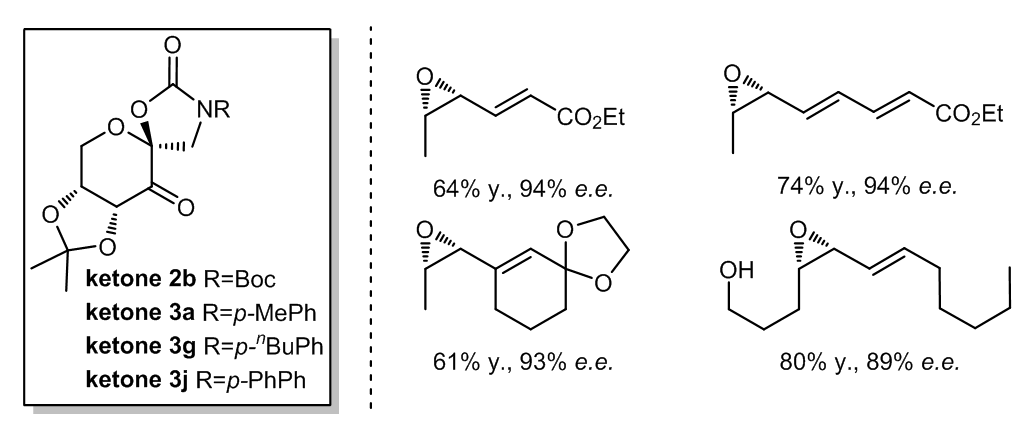
若共轭双烯中有一个二取代的双键和一个三取代的双键,那么三取代的双键可以很容易的被ketone 1环氧化,但是若将ketone 1置换ketone 2b, 3a, 3g,或3j成进行同样的反应时,二取代的双键的反应活性将会高于三取代的双键而优先进行环氧化反应。
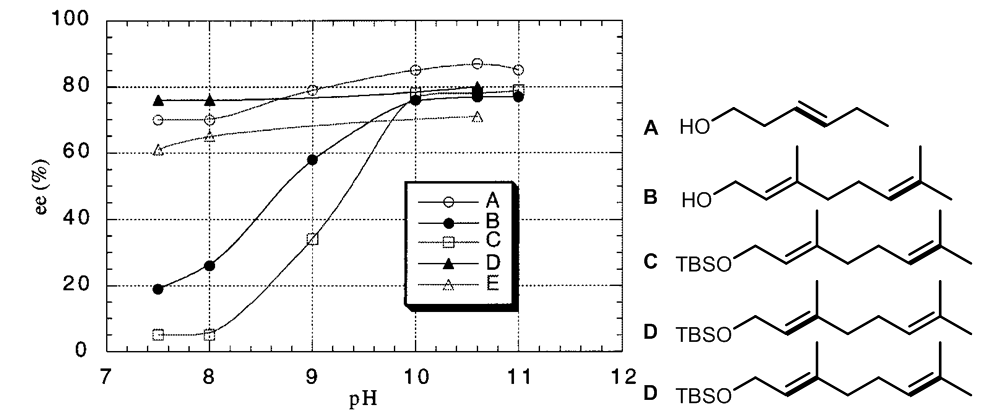
1.3 含有羟基的烯烃的氧化和pH对反应的影响
将ketone1和香叶醇(A)混合进行环氧化反应用来测试这一类底物的反应效果。5
对于将此类化合物的氧化成为环氧化物的反应,反应的立体选择性随着pH的从7升高到11而从19%升高到77%(B)。距离羟基最近的环氧化物,反应的立体选择性随pH的变化更大,当pH从7升高至11时,e.e.从小于5%升高至79%(C),而D和E,e.e.随pH的变化则小得多小,可能的原因是反应过程中经历了丙酮的催化,使得手性酮发生了分解,而在较低的pH时手性酮催化剂将会自动分解,因而使得反应的立体选择性降低,并且还有氢键参与反应过程的可能。
当醇和对应的TBS硅醚共存时,只有醇会参与反应的过程产生环氧化物,而硅醚不会5。这样的实验结果有力的支持了羟基对于Oxone参与的环氧化过程是非常有利的,因为羟基和Oxone只见可以形成分子间氢键(pathway b)。并且反应底物的羟基可以增强底物的水溶性,更加有利于Oxone和双键只见的相互作用而促进这种双相的反应。
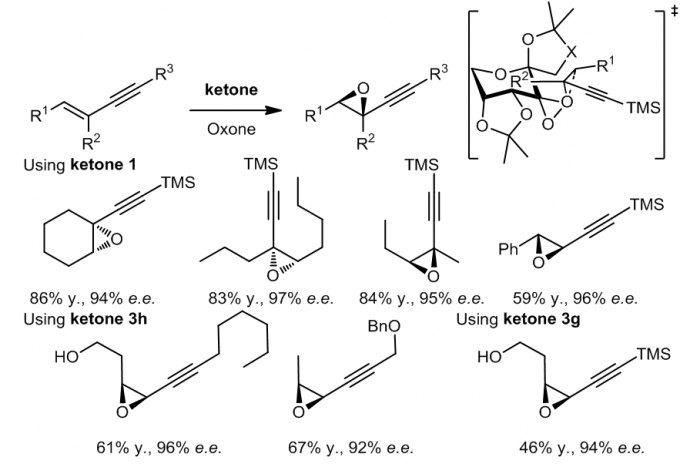
1.4 烯炔的环氧化
由于碳碳三键的电子效应和空间位阻效应,利用ketone 1对共轭烯炔的环氧化反应是高度化学选择的和立体选择的6,7。利用ketone 3a和3h就可以对顺式烯炔高效的进行环氧化反应。手性酮催化剂在反应的立体选择性上起了非常重要的作用。酮的噁唑环上的取代基和烯炔之间的相互作用会对反应的立体选择性产生显著的影响。
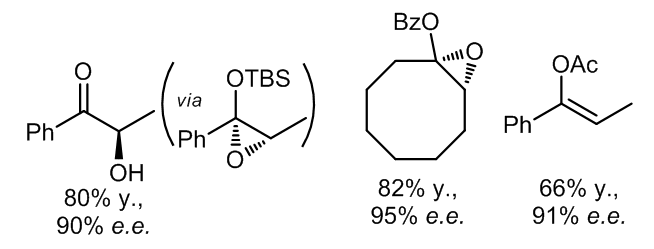
1.5 烯醇酯和烯醇醚的环氧化
多种烯醇酯的环氧化物可以有ketone 1氧化得到,并且反应呈现出很好的立体选择性8,反应用过相同环氧化物的α-羟基酮的两种对映异构体异构体而产生,并且某些产物重结晶后的e.e.可以达到超过99%e.e。
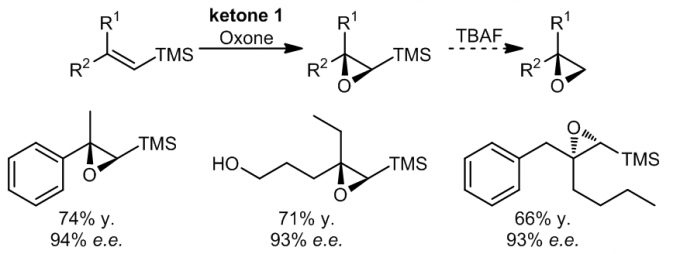
1.6 2,2-二取代的乙烯基硅烷的环氧化
在这些例子中,反应通过通过酮ketone 1的催化发生,硅烷基团基可以通过平面型过渡态的空间效应来增强反应的立体选择性9。
1.7 α, β-不饱和酯的环氧化
Ketone 4催化的α,β-不饱和酯的不对称环氧化反应,对许多反式和三取代的底物都可以显示出很高的立体选择性10,其中,共轭烯烃是一种很好的反应底物,产率很好,并且e.e也很高;Ketone 4参与的环氧化反应说明了在催化不对称环氧化过程中对于反应有力的结构因素。
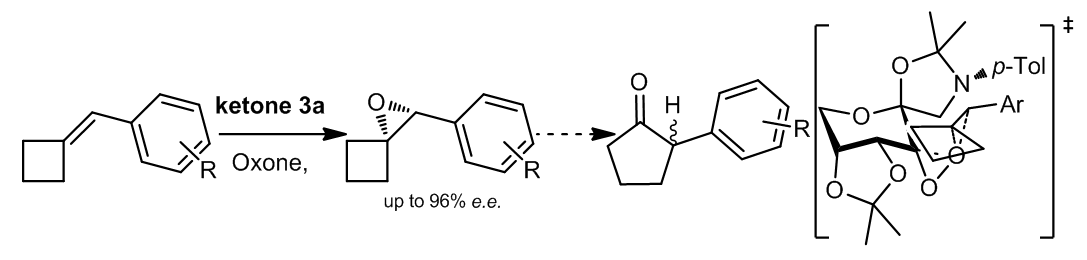
1.8 2-芳基亚甲基环己烷的环氧化反应
亚苄基环丁烷及其衍生物可以被手性酮ketone 3a以高对映体选择性地环氧化11,生成的产物可以经历重排反应以产生五元环化合物。
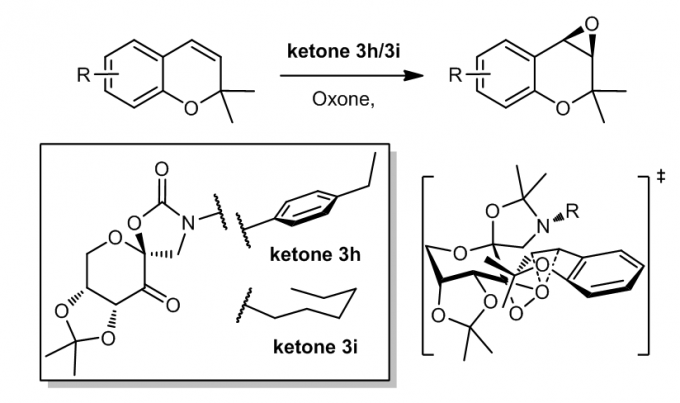
1.9 苯并吡喃及其衍生物的环氧化
N-芳基取代的和烷基取代的的含恶唑烷酮的酮ketone3h和3i可以用于催化这类底物的环氧化反应过程12,并且烯烃的苯环上的6-位取代基对对映体选择性具有显着影响,选择性最高可高达93%e.e。
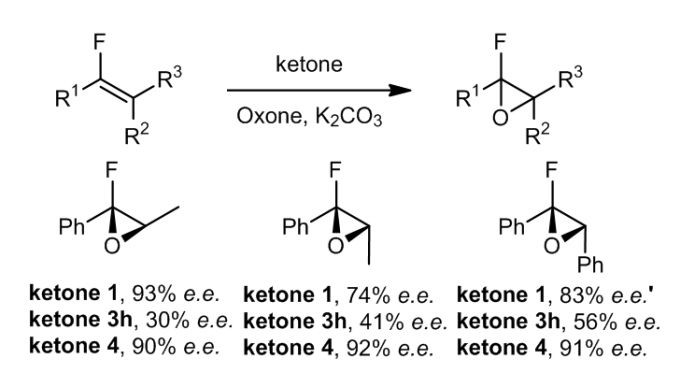
1.10 含氟烯烃的环氧化和氟原子效应
氟代烯烃也可以在手性酮的催化下进行环氧化反应。手性酮ketone1和4的催化反应通常具有很好的e.e.,最高可达91%,而酮ketone3h的选择性则较低e.e.,约为6-56%。虽然在某些情况下,氟可以通过底物和酮催化剂之间的空间和/或电子相互作用作为有效的导向基团,但在其他情况下,氟对环氧化的对映体选择性不利。这些结果可以让我们更好地了解手性酮催化的环氧化上的烯烃取代基的影响效应。
参考文献
- Org. Lett., 2001, 3 (12), pp 1929–1931, DOI:10.1021/ol010066e
- J. Org. Chem., 2002, 67, 2435-2446, DOI:10.1021/jo010838k
- J. Org. Chem., 2009, 74 (16), pp 6335–6338, DOI:10.1021/jo900739q
- J. Org. Chem., 1998, 63, 2948-2953, DOI:10.1021/jo9721195
- J. Org. Chem., 1998, 63, 3099-3104, DOI:10.1021/jo972106r
- Tetrahedron Lett., 1998, 39, 4425-4428, DOI:1016/S0040-4039(98)00838-7
- J. Org. Chem., 1999, 64, 7646-7650, DOI:10.1021/jo9907639
- Tetrahedron Lett., 1998, 39, 7819-7822. , DOI:1016/S0040-4039(98)01711-0
- J. Org. Chem., 1999, 64, 7675-7677, DOI:10.1021/jo990951z
- J. Am. Chem. Soc., 2002, 124 (30), pp 8792–8793, DOI:10.1021/ja020478y
- Angew. Chem. Int. Ed., 2006, 45, 1429-1432, DOI:10.1002/anie.200501520
- J. Org. Chem., 2006, 71 (10), pp 3973–3976, DOI:10.1021/jo0604179
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!














No comments yet.