本文投稿作者 孙苏赟
研究背景
- 早期手性酮催化的不对称环氧化反应
1.1 手性酮催化的环氧化的起源
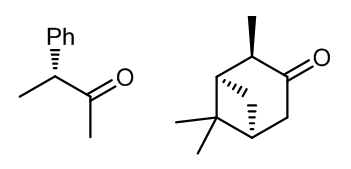
在上世纪八十年代,Curci发现了一种手性酮,它可以参与很多种烯烃的环氧化反应1,例如图中的这两种手性酮,但是他们使用时需要使用化学计量的量,最多可达到1/1,这些反应大多数需要在2-6°C进行,反应介质是DCM/H2O缓冲溶液的两相,同时作为相转移催化剂,产率在60%-90%之间,但是立体选择性很不好,大约只有10% e.e.。
1.2 在手性酮中引入吸电基团增加性能
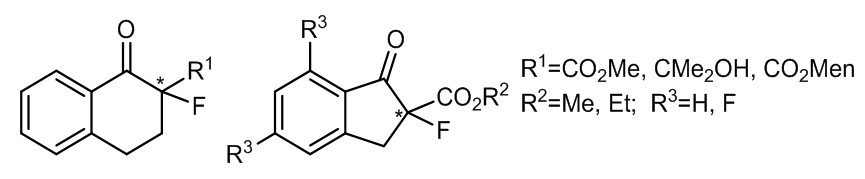
探究发现,在手性酮的结构中若引入吸电集团,那么酮可以表现出更加优异的性能2,例如这样一个引入三氟甲基的酮参与反应的例子:
相同的,这些反应也是在两相系统中进行,但是他们的产率普遍要高一些,大概在80%,立体选择性也有微小的提升,大约为20%。
1.3 手性芳香酮催化反应
Brian S.Marples课题组在1995年报道了一例含氟的手性酮参与的环氧化反应3。这些芳香酮具有平面型的结构,并认为这样的平面型结构是有非常利于催化位阻较大的结构,例如发杂结构中的反式双键的,事实证明的确如此,而且这种芳香手性酮的催化效果很好。
虽然这些芳香手性酮参与的反应不能得到立体选择性非常高的产物,但是利用吸电基团对羰基进行活化的思路在之后的研究中被进一步的研究和开发了。
- 史一安的策略
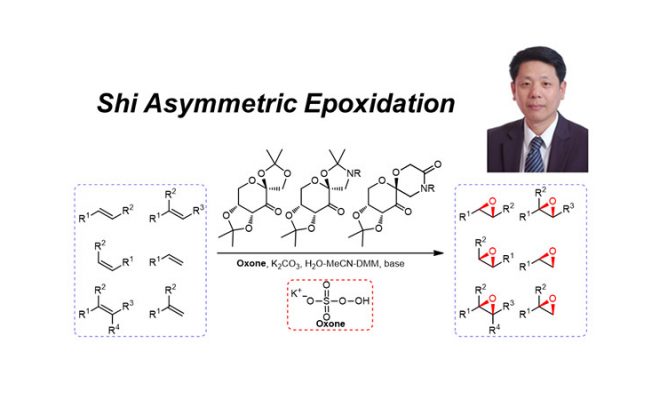
在1996年,年轻的华裔化学家史一安报道了一种极其有用的反应,这个反应可以将烯烃原位氧化成环氧化合物,并且反应具有很好的立体选择性4。在这之后,这个反应也被叫做“史一安氧化反应”,或是叫“史一安环氧化反应”。即使是在今天,这个反应也经常在有机合成中被使用,用于高效的将烯烃转化成环氧化合物,而环氧化合物是一种活泼的反应中间体,可以接下来进行多种反应的转化。
2.1 反应方程
2.2 史一安对手性酮的设计
手性酮催化剂中包含的结构是为了实现以下的功能:
- 高效的反应底物发生联系,产生特定的化学选择性,因此反应中心附近结构的位阻需要较大以产生很好的化学选择性;
- 当多环化合物或是含有叔碳的化合物座位反应底物时,产生位阻的碳原子的构形可以根据反应设计的要求进行调控;
- 在立体化学上可以限制副反应的发生而产生副产物;
糖基手性酮的优点5:
- 碳水化合物作为基体的手性酮具有很好的立体构型和光学纯度,并且容易通过化学合成得到,价格低廉;
- 碳水化合物作为基体的手性酮是多取代的化合物,并且分子中含有氧原子,可以提高反应的化学活性;;
- 由于差向异构体的转化的影响,碳水化合物作为基体具有很好的分子构型,对于反应的立体选择性非常有利。
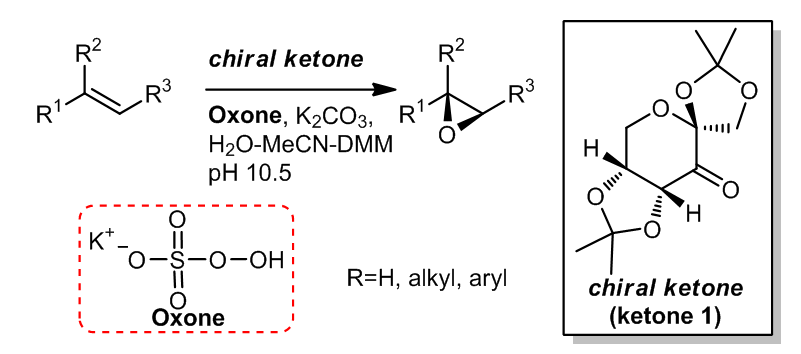
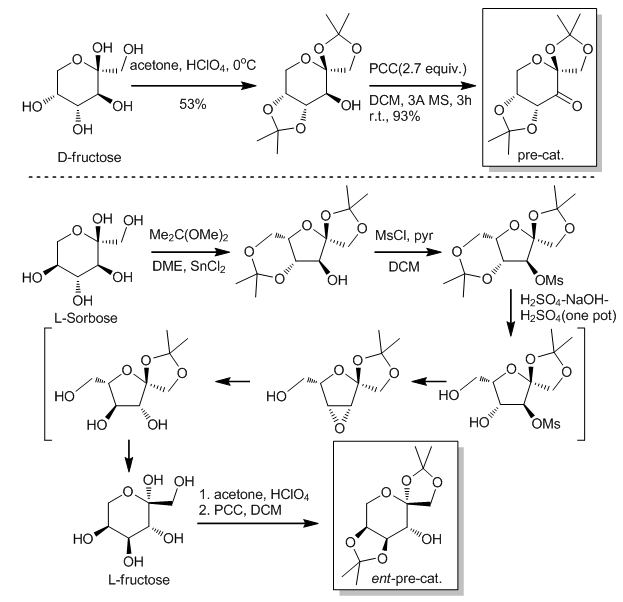
2.3 预催化剂的合成
这种手性酮及其对应异构体可以通过合成很简单的得到,而且反应的原料是D-fructose 和L-fructose,价格十分便宜,大约约15美元1千克。它们先通过和丙酮反应生成五元环,在再被PCC氧化得到酮。此外,在2003年,又有人报道了另一种用于从D-glucose合成含有氮元素的手性酮的新方法。
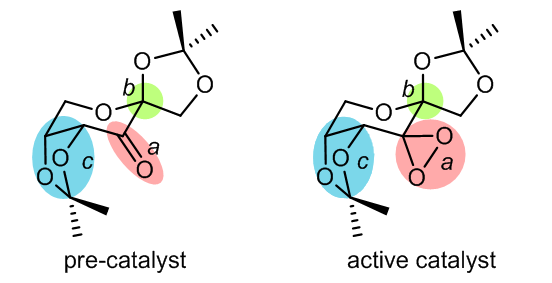
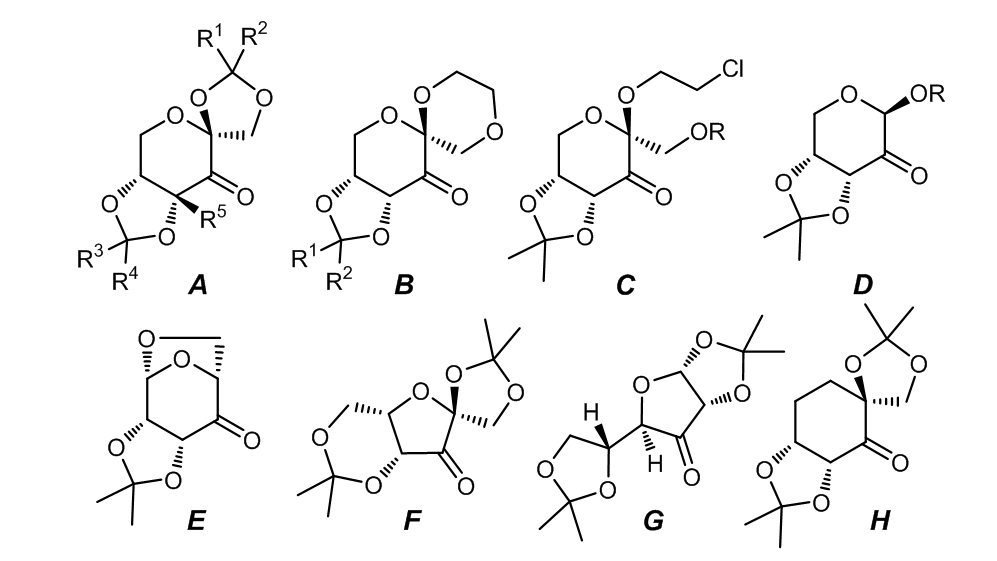
2.4 手性酮催化剂的结构7-9
手性酮上的取代基和取代基的性质与酮的催化效果有很大的关系,酮A具有五元环螺六元环的结构,它的性能较六元环螺六元环的酮B的催化效果更好,特别是参与反式二取代的双键的反应时,可以表现出更好的效果;而对于C和D,他们结构中的非环状的结构对于立体化学的控制能力不如前两者的出色。
酮A具有很好的立体选择性,因为五元螺环的缩酮结构可以有力的控制反应的过渡态,使得反应通过螺状都过渡态进行,相同类似的基团在B,C和D中也存在,但是对于螺形过渡态的控制不如A,因此立体选择性也较弱一些。
对于E来说,它可以从(-)-qunic acid合成,但是E的结构和前者有很大的不同之处,尽管如此,E的催化效果一般,34%-95%产率,52%-94% e.e。
2.5 环氧化的反应机理
环氧化过程主要的两个极限过渡态是平面型过渡态和螺型过渡态10。
过氧丙酮进行环氧化反应时发现,顺式双键的反应活性一般要高于反式双键,可能的原因是此类反应是通过螺型过渡态进行的。相同地,史一安环氧化反应的过程中,手性酮会经历一个过氧丙酮类似物的中间体,这个中间体再对烯烃进行环氧化反应,反应过程中可能是螺型过渡态,但是通常时候是平面型过渡态占主导,因为普遍认为螺型过渡态是电子丰时的过渡态,因为氧原子孤对电子和烯烃的π*轨道只见的相互作用,但是史一安的环氧化反应中底物越缺电子则越有利于反应的发生,因此更加可能是平面型过渡态发生反应;此外,反应的产物大多是(R,R)-构型的,这更加支持了反应的过渡态的理论。
在反应中,真正的氧化剂是具有氧化性的被活化的手性过氧化酮,这个过氧酮的中间体是通过手性在原位被Oxone氧化而得到的,而这个中间体可以看做是过氧丙酮的类似物,之后这样的过氧丙酮类似物和烯烃发生环氧化反应得到环氧化物的产物。但是反应会存在一个竞争的反应,即反应中会发生Baeyer-Villiger重排,也就是Baeyer-Villiger氧化反应,这个副反应会严重的影响底物的转化率。此外,在这个反应中,只有反式双键可以得到具有较高立体选择性的产物,这样可以和只能和顺式烯烃反应的Jacobsen氧化反应和Sharpless AE作为相互补充的反应。但是史一安反应中的一个缺点是催化的手性酮的用量较大,其反应中的浓度需要达到20-30 mol%。
参考文献
- J. Chem. Soc., Chem. Commun., 1984, 155-156. , DOI:10.1039/C39840000155
- Tetrahedron, 1995, 36(32), 5831-5834, DOI:1016/0040-4039(95)01108-T
- Tetrahedron, 1995, 51(12), 3587-3606, DOI:10.1016/0040-4020(95)00075-J
- Tetrahedron, 1991, 47(12), 2133-2144, DOI:1016/S0040-4020(01)96124-1
- J. Am. Chem. Soc., 1997, 119, 11224-11235, DOI:10.1021/ja972272g
- J. Org. Chem., 1997, 62, 8622-8623, DOI:10.1021/jo971701q
- J. Org. Chem., 1998,63, 8475-8485, DOI:10.1021/jo9817218
- J. Org. Chem., 1999, 64, 6443-6458, DOI:10.1021/jo9908849
- J. Am. Chem. Soc., 1996, 118, 9806-9807, DOI:10.1021/ja962345g
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.