本文翻译投稿 Suming 校对编辑 JiaoJiao
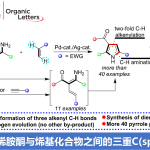
本文报道了使用具有铱催化剂的仲胺来进行烯基酰胺在分子间/分子内的双胺化,可以通过改变添加剂和溶剂来选择所得的内酰胺的环大小(γ-或δ-内酰胺)。连接其中一个胺与烯烃的双胺化
由于含氮化合物被广泛应用于大多数药物分子中,所以开发出能够方便的将氮原子引入的方法显得意义重大。在这些方法中,我们知道烯烃的双胺化是一种可以一次性引入两个氮原子,被称为邻二胺的有效合成方法。然而,两者引入不同的氨基的时候,有必要控制其各自的反应性和区域选择性,因而它仍然是一项具有挑战性的研究。[1]
作为该问题的解决方案之一,我们已经知道了几例将烯烃与胺的单侧相连,实现分子内/分子间内进行双胺化反应。
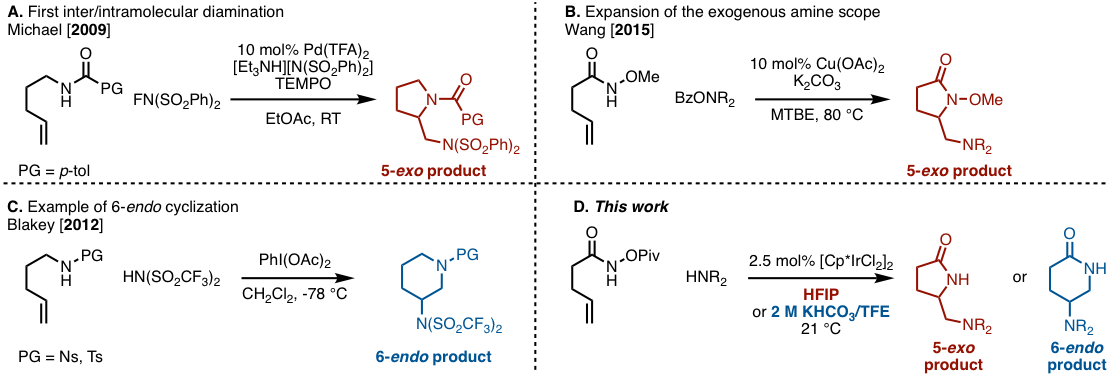
Michael等人报道了使用Pd催化剂,通过分子内的酰胺和NFSI对烯烃的双胺化,并且随后发展为不对称反应(见图1A)。[2]尽管该方法是分子间/分子内双胺化的第一个实例,但分子间胺化剂仅限于使用NFSI。作为可以引入更多通用氨基的例子,王教授等人已知了一种在使用铜催化剂的情况下把o-苯甲酰羟胺作为分子间胺化剂的方法。(图1B)[3] 尽管在上面的例子中提供5-exo体的例子,但Blakey等人成功地使用超价碘和Tf2NH选择性地获得6-endo体。(图1c)[4]
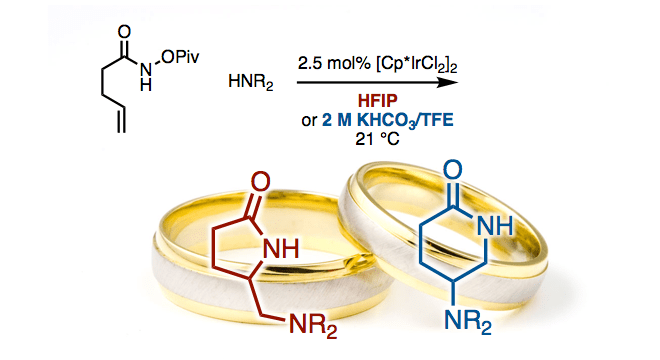
这一次,哥伦比亚大学Rovis教授等人报道了使用铱催化剂的烯烃分子间/分子内的双胺化反应。(图1D)值得注意的是仲胺是可以用作分子间胺的、并可以通过选择溶剂和添加剂来控制5-exo体(γ-内酰胺)和6-endo体(δ-内酰胺)的选择性。
“Regiodivergent Iridium(III)-Catalyzed Diamination of Alkenyl Amides with Secondary Amines: Complementary Access to γ– or δ‐Lactams”
Conway, J. H. Jr.; Rovis, T. J. Am. Chem. Soc. 2018, 140, 135. DOI: 10.1021/jacs.7b11455
论文作者介绍
研究者:Tomislav Rovis (URL: https://rovisresearch.wordpress.com)
研究者经历:
- 1990年 B.S 加拿大安大略省多伦多大学S. S.
- 1998年 Ph.D 安大略省多伦多大学(Mark Lautens教授)
- 1998年 Postdoc 哈佛大学硕士(David A. Evans教授)
- 2000年 助理教授 科罗拉多州立大学
- 2005年 副教授 科罗拉多州立大学
- 2008年 教授 科罗拉多州立大学
- 2016年 教授 纽约哥伦比亚大学
研究内容:NHC不对称配体,基于Rh的有机金属,光催化剂
论文概要
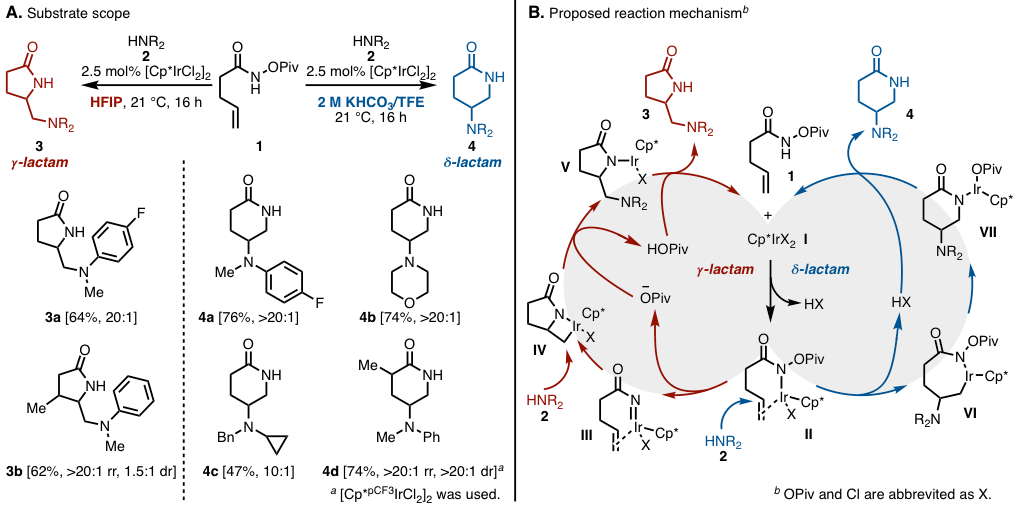
作者在的[Cp*IrCl2]2的催化剂下,在HFIP溶剂中搅拌烯酰胺1和仲胺2,温度为21摄氏度成功获得了作为分子间/分子内双胺基化产物的γ-内酰胺3(图2A)
有趣的是,他们还发现可以通过向添加剂中加入KHCO3并且将溶剂改变为TFE/H2O,来切换exo/endo选择性以获得δ-内酰胺4。
在前面的反应中,即使酰胺的β位被烷基化,反应也可以继续进行,对于2,则可以使用N-烷基苯胺衍生物。另一方面,在后者中,多种仲胺作为2可适用于反应。另外,通过将催化剂的Cp配位基改变为更缺电子的配位基,即使α位被取代,也可以继续进行反应。
进行氘标记等实验时,他们研究了该反应的机理(图2B)。首先,Ir催化剂与I的烯烃双键及酰胺配位生成II。在解离特戊酸之后形成金属氮宾III、并随后迁移插入烯烃双键形成γ-内酰胺IV。用胺对IV进行亲核攻击和加氢去金属化形成5-exo体3。另一方面,图中右侧-δ内酰胺的生成路线,是用胺对II进行胺的亲核攻击,经由环状铱中间体VI形成6-endo体4。
本文的关键在于5-exo / 6-endo的选择性,它展现出来了胺在两种反应条件下的亲核性差异。也就是说,当使用具有相对高的酸度的HFIP作为溶剂时,由于HFIP和胺之间的氢键,对于II上的亲核攻击会受到抑制并且从经由中间体III的路线优先进行。而另一方面,在在2M的KHCO3/TFE碱性条件下,胺上氢键会削弱,更易进行亲核进攻,从而得到VI。
在上文中,烯烃的分子间/分子内双胺化可以通过添加剂和溶剂来切换exo/endo选择性。尽管Ir催化的价格很高,但它是能够在温和条件下直接引入仲胺并且反应良好。
参考文献
- De Jong, S.; Nosal, D. G.; Wardrop, D. J. Tetrahedron 2012, 68, 4067. DOI: 1016/j.tet.2012.03.036
- Sibbald, P. A.; Michael, F. E. Org. Lett. 2009, 11, 1147. DOI: 10.1021/ol9000087(b) Ingalls, E. L.; Sibbald, P. A.; Kaminsky, W.; Michael, F. E. J. Am. Chem. Soc. 2013, 135, 8854. DOI: 10.1021/ja4043406
- Shen, K.; Wang, Q. Chem Sci. 2015, 6, 4279. DOI: 10.1039/c5sc00897b
- Kong, A.; Blakey, S. B. Synthesis 2012, 44, 1190. DOI: 1055/s-0031-1290591























No comments yet.