我们将具有催化功能的蛋白质统称为“酶(酵素)”,这些酶分子大多是分子量超过1万的巨型分子。
但是,酶的活性部分与其全体相比较的话,往往却只是其中占有比例非常少的那一部分。如果没有如此庞大的(无用)部分,而只有明确结构的(有效)多肽的话,是否依然能作为催化的基质使用呢。。。?
由此突发奇想而生的多肽性催化剂,发表于2014年的Nature Chemistry上,研究题目是「淀粉样纤维」的文章。[1] 今天就让本小编为大家简单介绍一下吧~。
淀粉样纤维(Amyloid)是何物?
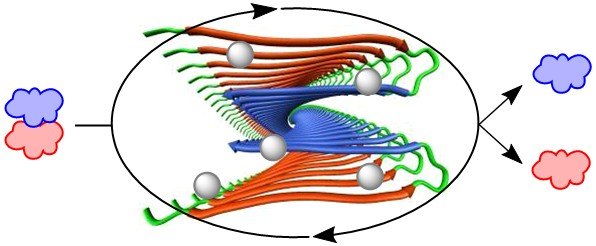
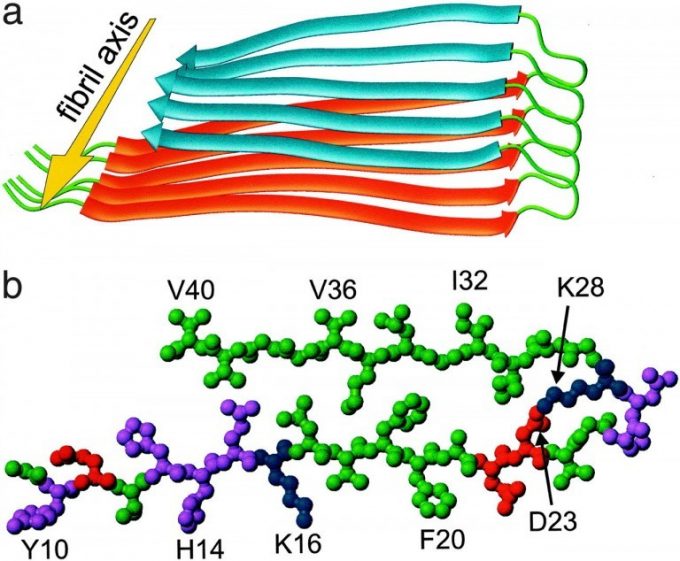
淀粉样纤维(amyloid)是具有交叠β-折叠构型形成的纤维状不溶性的多肽(蛋白质)的统称。虽然具有比较小的分子尺寸,却有相对明确的结构,具有一些其他蛋白质所没有的特性。
淀粉样纤维与众多难治性疾病(Amyloidosis)都有一定的关系。比如艾尔兹海默症(俗称老年痴呆症 Alzheimer‘s Disease),很早之前就有假说猜测是由于A-β纤维蛋白(Amyloid-β)的凝聚是造成的这一些列疾病的罪魁祸首。
Amyloid由于溶解度极差,样品的处理上就是一个难题,以至于生物化学的性质表征都十分不易。但又因其是病原多肽,又很有必要对它进行研究,研究者们面对这个令人困扰的分子,一时之间只好蹙眉。
将“令人困扰”的淀粉样纤维转变为有力工具
今天介绍的研究重点就是:首次发现能形成淀粉样纤维的多肽(仅含7个氨基酸残基!)自组装的同时显示出的催化机能。
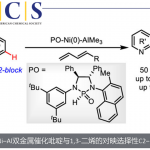
疏水性氨基酸与亲水性氨基酸交互排布的Amyloid多肽LKLKLKL[3]作为参考,作者们将赖氨酸替换为组氨酸,改变了序列,制备了Ac-LHLHLHL-CONH2。
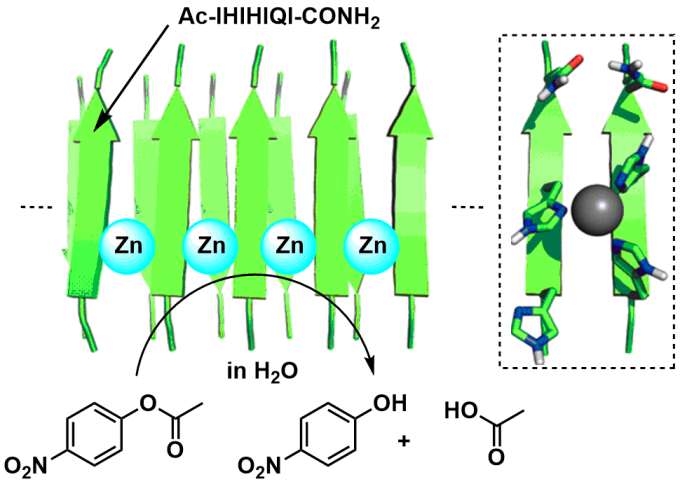
二氯化锌与上述多肽混合,如此一来淀粉样纤维侧链上的组氨酸作为配体与锌离子配位。组氨酸侧链由于是单点配位,单纯的短链多肽难以与金属进行稳定的配位。但是,一旦形成了淀粉样纤维,相同的多肽的组氨酸侧链距离拉近,则多个组氨酸侧链同时与锌离子配位。此螯合作用又能进一步稳定作为重中之重的蛋白结构。圆二色光谱(荧光)结果也显示凝聚体中富余β折叠结构,也就是说确定了该组装体具有Amyloid性。
“是不是作为多核锌络合物作为路易斯酸能起到催化作用呢”,作者们尝试着利用此金属-淀粉样纤维配合物作为催化剂应用。多次尝试之后,他们发现此配合物可以催化4-硝基苯基乙酸酯的水解反应。
作者随即制备了不同氨基酸序列的数种多肽,研究结构-催化活性的关系(构效关系)。成功发现最高活性的多肽序列为Ac-IHIHIQI-CONH2。
除此之外,在进行反应速率解析时,显示出此淀粉样纤维催化剂竟与酶有相同的行为,也就是具有饱和特性和pH依赖性等性质。
正如前文所述,蛋白质催化机能的发挥,是需要长链多肽通过适当的折叠形成巨大的三级结构的。然而,这篇工作报道了“通过自聚集形成规则结构的短链多肽,也能发挥催化能力”,这是一个很有意思的发现。
以此实验结果为基础,作者们又提及了“淀粉样纤维在进化过程中,可能会形成酶中间体”。此观点也是非常有意思的着眼点。
“淀粉样纤维催化剂”的可能性
多肽可以通过固相法迅速合成,正是如此,结构的展开就有无限种可能性。本次虽然只报道极其简单的反应应用,然而根据与不同金属的不同组合,有可能开展其他种类的催发反应。
除此之外,淀粉样纤维本身属于多肽,不难联想到“创造良好生物兼容性催化剂”这一课题。如果能有效地抑制淀粉样纤维的毒性,说不定能发现埋藏于低分子催化剂~酶(酵素)中间的【第三类催化剂】。
该催化剂的结构在剧烈的条件下是否稳定、催化剂活性能提升到何种程度、是否是具有化学选择性的催化剂。。。等等一系列的未解之谜还需要今后进一步的研究。除本文之外,关于难处理的【Amyloid】还有一些纳米材料和生物技术方向上的摸索[4]。很期待淀粉样纤维今后的发展潜力。
相关文献
- (a) “Short peptides self-assemble to produce catalytic amyloids” Rufo, C. M.; Moroz, Y. S.; Moroz, O. V.; Stöhr, J.;Smith,T. A.; Hu,X.; DeGrado, W. F.; Korendovych, I. V. Nat. Chem.2014, 6, 303. doi:10.1038/nchem.1894 (b) “Protein chemistry: Catalytic amyloid fibrils” Aumüller, T.; Fändrich, M.Nat. Chem. 2014, 6, 273. doi:10.1038/nchem.1904
- “A structural model for Alzheimer’s β-amyloid fibrils based on experimental constraints from solid state NMR” Robert Tycko et al. Proc. Natl. Acad. Sci. USA2002, 99, 16742. doi:10.1073/pnas.262663499
- (a) “Induction of peptide conformation at apolar/water interfaces: a study with model peptides of defined hydrophobic periodicity.” DeGrado, W. F. ; Lear, J. D. J. Am. Chem. Soc.1985, 107, 7684. DOI: 10.1021/ja00311a076 (b) “Protein design, a minimalist approach.” DeGrado, W. F.; Wasserman, Z. R.; Lear, J. D. Science1989, 243, 622. DOI:10.1126/science.2464850
- (a) “Nanomechanics of functional and pathological amyloid materials” Knowles, T. P. J.; Buehler, M. J.Nature Nanotech.2011, 6, 469. doi:10.1038/nnano.2011.102 (b) “Amyloids: Not Only Pathological Agents but Also Ordered Nanomaterials” Cherny, I.; Gazit, E. Angew. Chem. Int. Ed.2008, 47, 4062. DOI: 10.1002/anie.200703133
相关书籍
[amazonjs asin=”1493929771″ locale=”CN” title=”Protein Amyloid Aggregation: Methods and Protocols”] [amazonjs asin=”0128042567″ locale=”CN” title=”Intracellular Consequences of Amyloid in Alzheimer’s Disease”] [amazonjs asin=”3319395335″ locale=”CN” title=”Nanoscale Imaging and Characterisation of Amyloid-β”]
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!














No comments yet.