这次介绍的论文报道了使用羟基邻苯二甲酰亚胺的逆Markovnikov型加氢胺化。反应中并不需要使用过渡金属以及光催化剂,反应条件温和,通过这个反应可以转化得到伯胺产物。
使用邻苯二甲酰亚胺自由基进行逆Markovnikov型加氢胺化
含氮官能团,是医药,农业以及很多天然产物中常见的重要部位、因此简便并且效率的C-N成键反应的开发是非常有必要的。其中,脂肪族烯烃的加氢胺化是烷基胺合成的最有魅力的方法之一,近年来通过使用过渡金属催化剂和光催化剂得到迅速发展。但是,其位置选择性主要是Markovnikov型、逆Markovnikov型的选择性反应极少。另外,对于能够导入的胺种类来说,为了防止过度的加氢胺化,只能使用高级胺这一点是目前需要克服的难题。
加州大学圣地亚哥分校的Schmidt助理教授等人、在烯烃的加氢胺化中、把目光着眼于邻苯二甲酰亚胺基(PhthN·)。他们预测N中心自由基可以发生逆Markovnikov加成,、将所得邻苯二甲酰亚胺加成产物在温和条件下脱保护,得到伯胺。在已有的报道中,邻苯二甲酰亚胺自由基,可以在Ir催化剂・可见光照射条件下,与芳香族化合物发生亚酰胺化(图1A)(1)、以及在紫外线照射下发生烯烃的卤代酰亚胺化(图1B)(2)、但是目前还没有一例应用与加氢胺化的实例。这是因为、以前的例子中都是用N-X(卤素)键的裂解来生成PhthN·自由基、同时加入化学当量的氢源可能会导致其他自由基副反应从而导致无法实现所想要的加氢胺化反应。
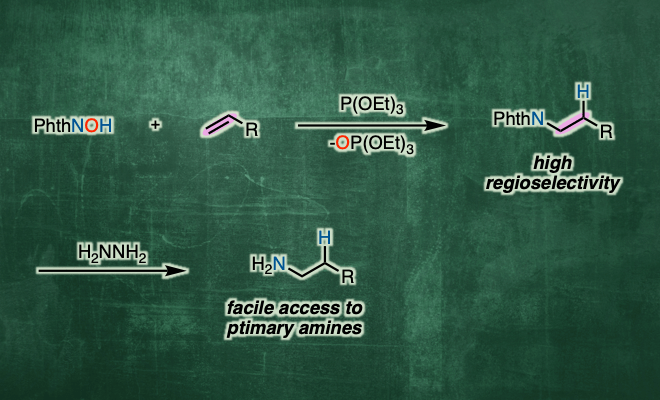
这次Schmidt等人,使用N–羟基邻苯二酰亚胺(NHPI)作为产生PhthN·自由基的原料,亚磷酸三乙酯(P(OEt)3)作为氧清除剂、成功开发出了底物适用性广的烯烃的逆Markovnikov型加氢胺化(图1C)。
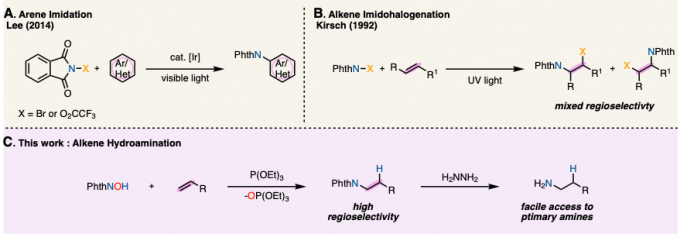
图1.已报道的PhthN·自由基的反应实例与这次介绍的反应
“Intermolecular Radical Mediated Anti-Markovnikov Alkene Hydroamination Using N-Hydroxyphthalimide”
Lardy, S. W.; Schmidt, V. A. J. Am. Chem. Soc. 2018, 140, 12318.
DOI: 10.1021/jacs.8b06881
论文作者介绍

经历:
-2007 BSc, University of Towson, USA (Prof. Ryan E. Casey and Prof. Steven M. Lev)
2008-2013 Ph.D, University of North Carolina, Chapel Hill, USA (Prof. Erick J. Alexanian)
2013-2016 Posdoc, University of Princeton, USA (Prof. Paul J. Chirik)
2016- Assistant Prof. at University of California, San Diego
研究内容:使用过渡金属催化剂的反应开发、自由基的反应开发
论文概要
以烯烃为底物,在二氯乙烷溶剂中、将NHPI与P(OEt)3与自由基引发剂(tBuON)2发生作用、成功实现选择性逆Markovnikov的加氢胺化。该反应适用于与亲电子自由基相容的富电子烯烃,如乙烯基醚硫醚和乙烯基硅烷(图2A)。而且,对于没有电子偏向的非活性烯烃,通过改变自由基引发剂和提高反应温度也能进行反应(图2B)。此外,得到的加氢邻苯二甲酰亚胺取代产物,在肼的作用下可以转变成伯胺。
根据各种对照实验的结果,作者提出了以下反应机理(图2C)。通过自由基引发剂先生成PhthNO·、然后再通过亚磷酸三乙酯切断比较弱的N–O键形成PhthN·自由基。然后PhthN·与烯烃底物发生反应形成碳自由基。生成的碳自由基再与NHPI发生原子移动得到产物,并且再次生成PhthNO·自由基。该反应的一个亮点是通过使用NHPI,使得烯烃的加氢胺化所必需的H原子和N原子可以从同一分子提供。
如上所述,作者开发出使用N-羟基邻苯二甲酰亚胺的逆Markovikov型烯烃加氢胺化。由于该方法简便并且能够得到高位置选择性的烷基胺,底物适用范围广,因此很有望用于药物或者天然产物的全合成中。
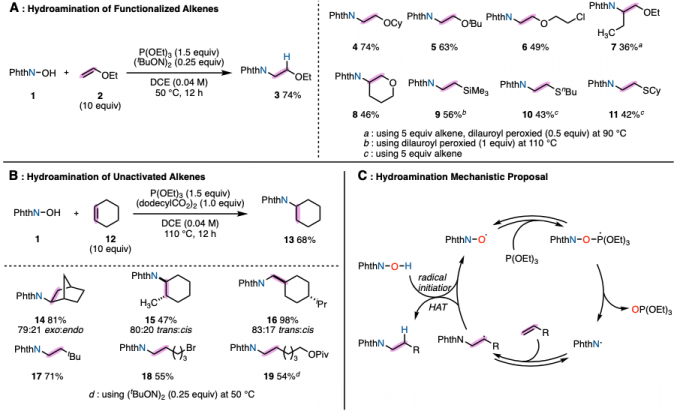
图2. (A),(B)底物适用范围 (C)推定的反应机理
参考文献
- (a) Kim, H.; Kim, T.; Lee, D. G.; Roh, S. W.; Lee, C. Chem Commun. 2014, 50, 9273. DOI: 10.1039/c4cc03905j(b) Allen, L. J.; Cabrera, P. J.; Lee, M.; Sanford, M. S. J. Am. Chem. Soc. 2014, 136, 5607. DOI: 10.1021/ja501906x
- (a) Day, J. C.; Katsaros, M. G.; Kocher, W. D.; Scott, A. E.; Skell, P. S. J. Am. Chem. Soc. 1978, 100, 1950. DOI: 10.1021/ja00474a063(b) Luning, U.; Kirsch, A. Chem. Ber.1993, 126, 1171. DOI: 10.1002/cber.19931260517
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.