复旦大学张俊良课题组使用膦催化剂,开发了由叠氮化合物和α,β-烯酮合成β-氨基α-二氮羰基化合物的合成方法。由于磷叠氮中间体不会放出(离去)氮气、因此可以将所有三个氮原子引入α,β-烯酮中。
使用磷催化的叠氮化物的转化反应
叠氮化合物是常见的非常有用的building block[1]。作为代表性的叠氮化物的转化反应,常常使用化学当量或者催化量的膦催化剂进行反应。其中,以Staudinger反应为代表的通过磷叠氮中间体1脱氮气生成氨基膦烷2,然后再利用该中间体进行各种官能团转换(图1A)。2的水解可以生成胺(Staudinger反应)、与羧酸衍生物反应可以生成酰胺(Staudinger Ligation)、与醛或者酮反应生成imine(aza-Wittig反应)。以上是将叠氮转化成含有一个氮原子的官能团的手法,当然转换成含有两个氮原子的官能团比如说重氮的方法也已经被报道。Raines等人、将叠氮与使用具有活性酯部分的膦试剂反应,成功转化成了重氮产物(图1B)[2]。通过叠氮膦试剂1、将叠氮的三个氮原子全部引入的例子,到目前为止只有Molina等人报道的含有亚胺官能团的芳香族叠氮转化成2H–吲唑骨架这一个例子(图1C)[3]。
本次、复旦大学的张俊良教授课题组使用催化量的膦试剂、将氟代α,β-烯酮3于TMS-azide作用,成功合成了β–amino α–diazide cabonyl化合物4(图1D)。并且如果使用手性膦催化剂也可以产生对映选择性。
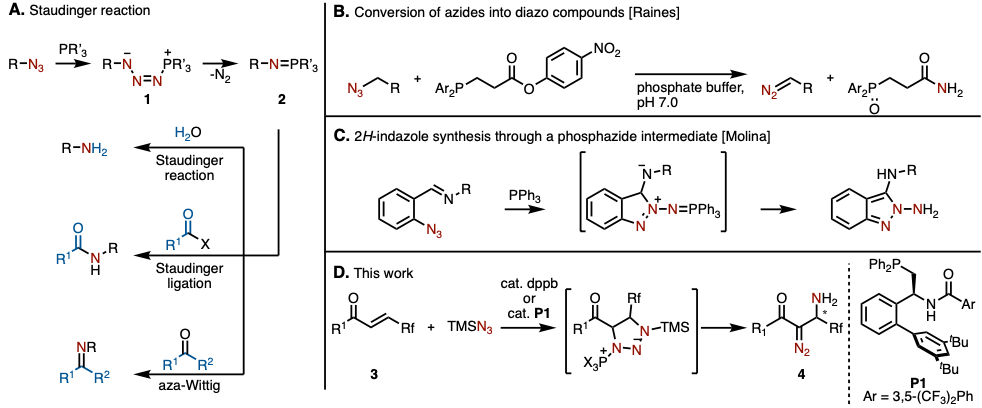
图1. 使用膦试剂的叠氮的转化反应 (A) Staudinger反应等、 (B) Raines等人的方法、 (C) Molina等人的方法、 (D) 这次的反应
“Phosphine-Catalyzed Difunctionalization of b-Fluoroalkyl a,b-Enones: A Direct Approach to b-Amino a-Diazo Carbonyl Compounds”
Wang, H.; Zhang, Li.; Tu, Y.; Xiang, R.; Guo, Y.-L.; Zhang, J. Angew. Chem., Int. Ed.2018, 57, 15787
论文作者介绍

经历:
1993-1997 BSc, Tianjin University (Prof. Wenqin Zhang and Prof. Chunbao Li)
1997-2002 PhD, Shanghai Institute of Organic Chemistry (Prof. Shengming Ma)
2002-2003 Research Chemist, Shanghai Institute of Organic Chemistry (Prof. Shengming Ma)
2003-2004 Humboldt Fellow, University of Colongne (Prof. Hans-Günther Schmalz)
2005-2006 Postdoc, The University of Chicago (Prof. Chuan He and Prof. Stephen Kent)
2006-2017.9 Professor and Vice Dean, East China Normal University
2017.10-present Professor, Fudan University
研究内容:以共轭化合物与小元环为底物的反应方法学开发、手性配体的开发与应用、聚合催化剂的开发
论文概要
在该方法中,通过使用dppb作为膦催化剂,并且使TMSN3和在β-具有氟烷基(Rf)的α,β-烯酮3,可以高产率地获得β-氨基α-叠氮羰基化合物4(图2A)。此外,当使用他们自己的手性膦催化剂P1代替dppb时,可以以高产率和高对映选择性合成4。有趣的是,将该反应条件应用于β位含有三氟甲基的β,β-二取代烯酮或β位不含氟烷基的烯酮5,不能得到重氮取代产物,而是产生叠氮基1,4-加成的产物6(图2B)。
本反应的假定反应机理如图2C所示。首先、膦催化剂对叠氮的末端氮原子进行亲核进攻,形成叠氮膦试剂中间体7。然后与β–氟代烷基α,β–烯酮3进行1,4-加成、得到烯醇中间体8、继而发生分子内亲核加成得到中间体9。9再通过水解(水的来源未知)使得膦试剂再生的同时生成10。最后10发生分子内环开裂[4]、生成产物4。该反应机理的一个关键点是,由于使用的TMS叠氮位阻大,所以有效抑制了异构体Z-7的生成、从而抑制了脱氮气副反応。
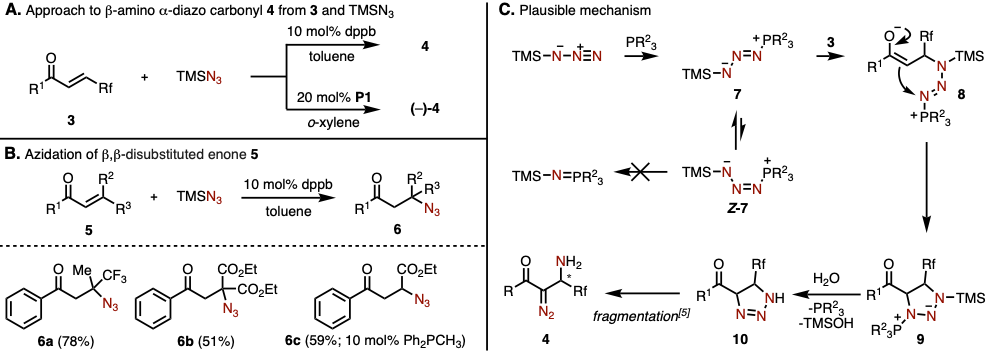
图2. (A) 使用3与TMSN3的β–amino α–diazide cabonyl化合物合成法 (B) 双取代烯酮5的1,4-加成反应 (C) 假定机理
综上、通过叠氮膦中间体成功在α,β–烯酮上导入了三个氮原子、合成了β–胺基α–叠氮羰基化合物。预计该反应将进一步推动叠氮化物的转化法与Rh卡宾催化的发展。
参考文献
- (a) Bräse, S.; Gil, C.; Knepper, K.; Zimmermann, V. Angew Chem., Int. Ed. 2005, 44, 5188. DOI: 10.1002/anie.200400657(b) Shin, K.; Kim, H.; Chang, S. Acc. Chem. Res. 2015, 48, 1040. DOI: 10.1021/acs.accounts.5b00020
- (a)Myers, E. L.; Raines, R. T. Angew. Chem., Int. Ed. 2009, 48, 2359. DOI:10.1002/anie.200804689(b)Chou, H.-H.; Raines, R. T. J. Am. Chem. Soc.2013, 135, 14936. DOI:10.1021/ja407822b
- Molina, P.; Arques, A.; Vinader, M. V. Tetrahedron Lett.1989, 30, 6237. DOI:1016/S0040-4039(01)93353-2
- Ouali, M. S.; Vaultier, M.; Carrié, R. Tetrahedron1980, 36, 1821. DOI: 1016/0040-4020(80)80081-0
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.