作者:杉杉
导读:
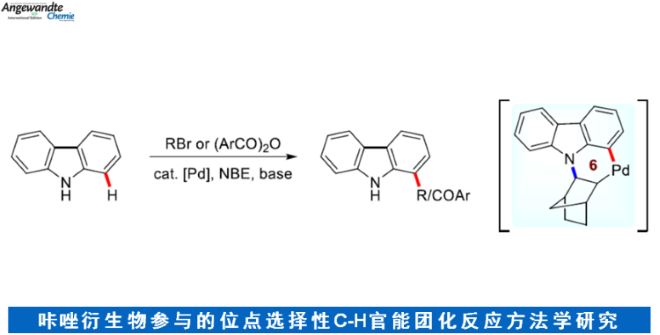
近日,美国Texas Tech大学的H. Ge与IIT Bombay (Indian Institute of Technology Bombay)的D. Maiti课题组在Angew. Chem. Int. Ed.中发表论文,共同报道一种全新的采用钯/NBE催化体系促进的通过咔唑类化合物参与的C-H官能团化反应方法学,进而成功完成一系列取代咔唑分子的构建。
Site-Selective C-H Functionalization of Carbazoles
M.Elsaid, R.Ge, C. Liu, D. Maiti, H. Ge, Angew. Chem. Int. Ed. 2023, ASAP. doi: 10.1002/anie.202303110.
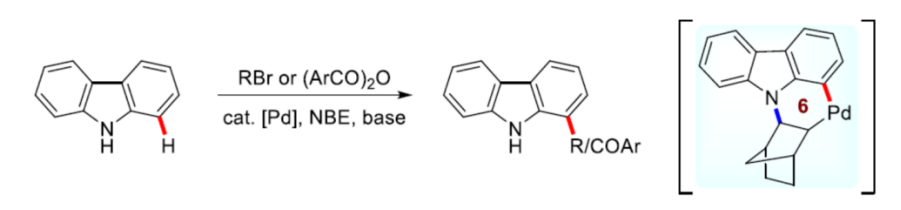
正文:
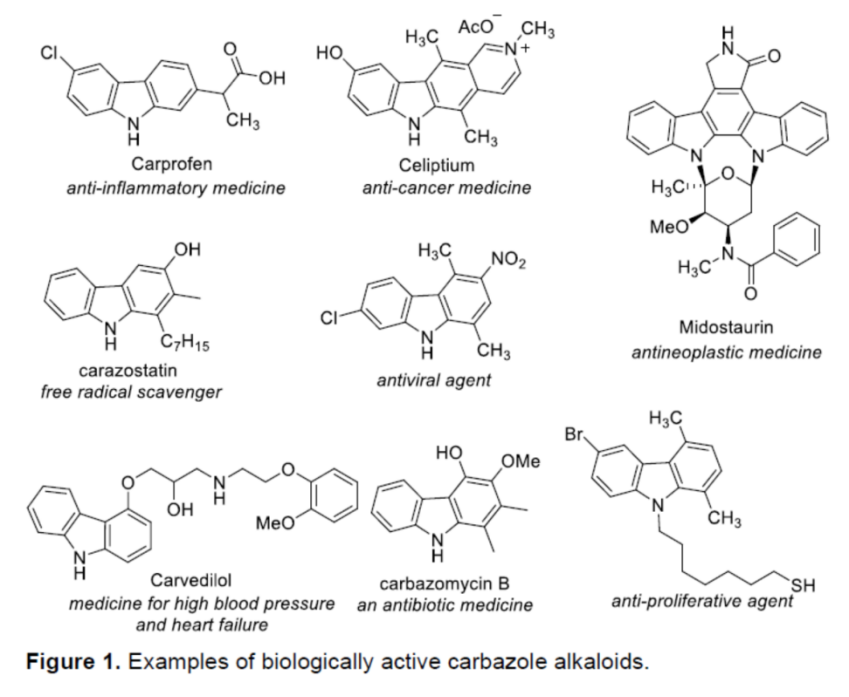
近年来,C-H活化与官能团化反应方法学的研究,一直以来备受诸多科研团队的广泛关注 (Scheme 1a-c)[1]–[6]。这里,鉴于具有生物活性的咔唑类生物碱的潜在应用价值 (Figure 1) [7],同时受到咔唑分子参与的C-H官能团化反应方法学[8]相关研究报道的启发,美国Texas Tech大学的H. Ge与IIT Bombay的D. Maiti课题组成功设计出一种全新的采用钯/NBE催化体系促进的通过咔唑类化合物参与的C-H官能团化反应方法学 (Scheme 1d)。
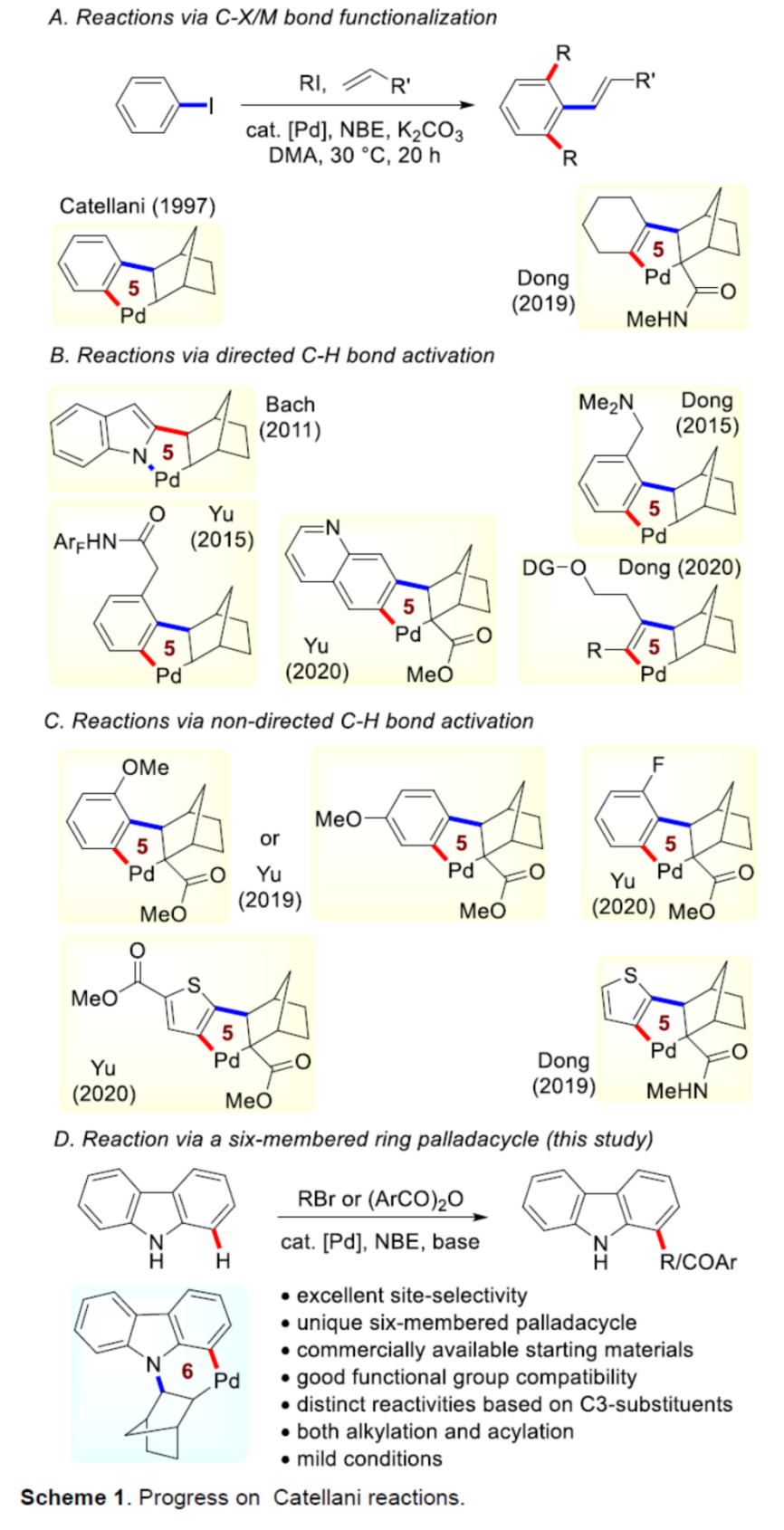
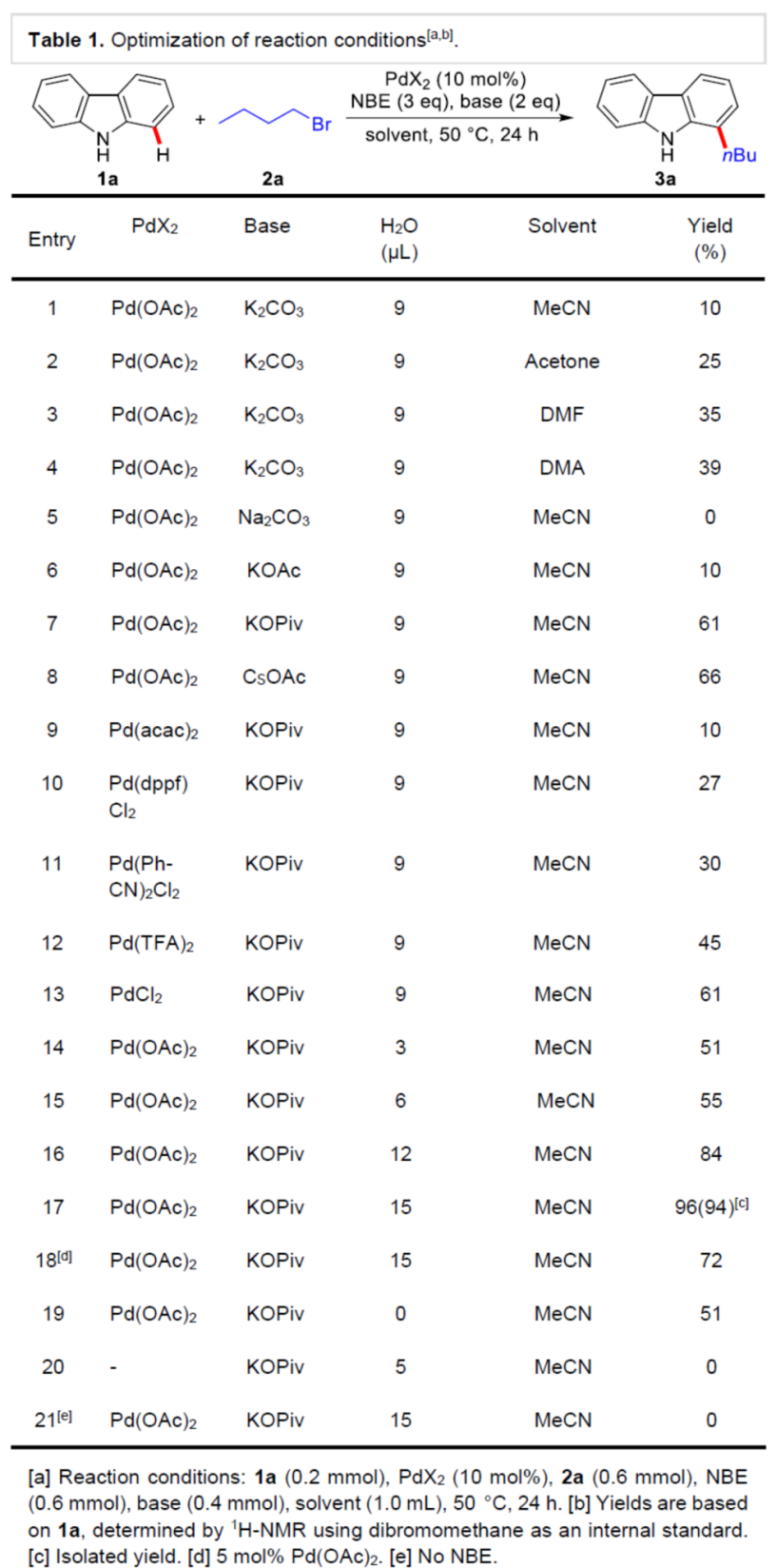
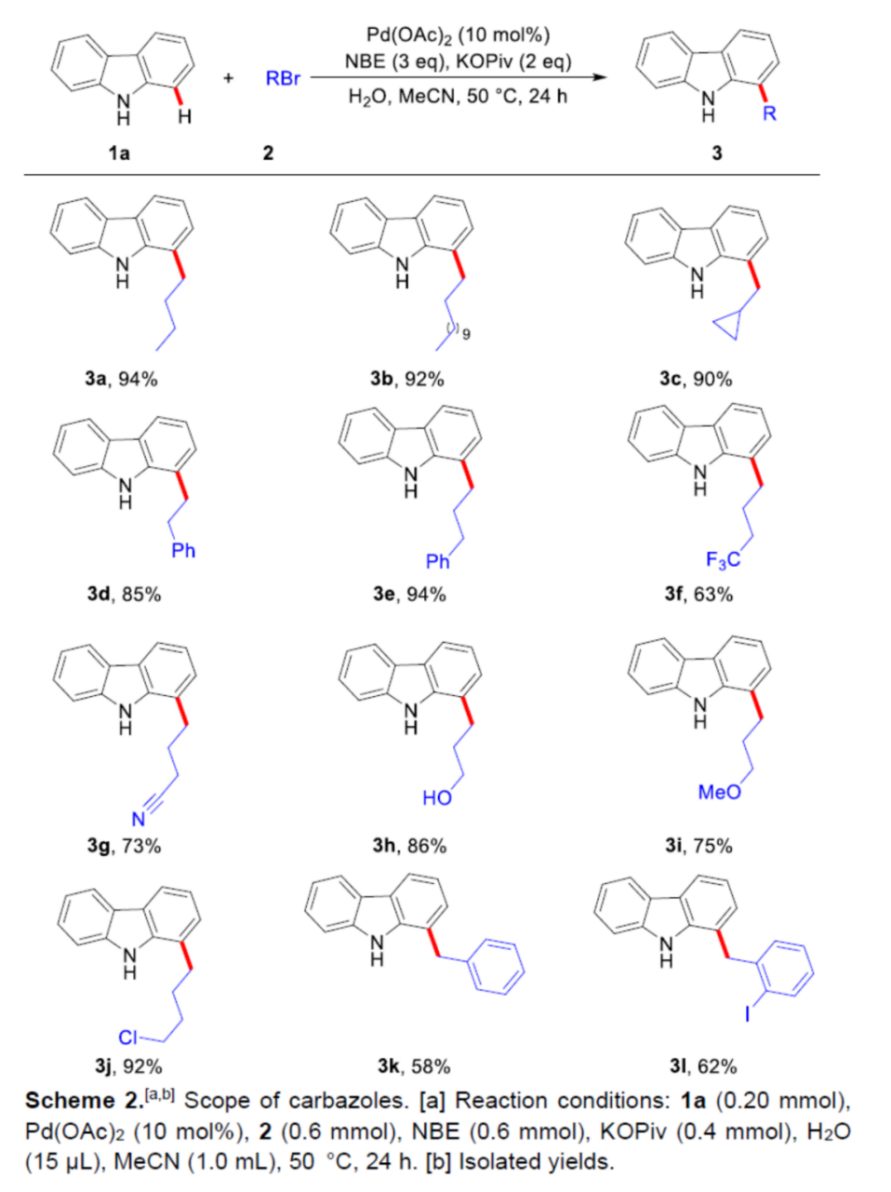
首先,作者采用咔唑1a与1-溴丁烷2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Pd(OAc)2作为催化剂,NBE作为配体,KOPiv作为碱,水作为助溶剂,MeCN作为反应溶剂,反应温度为50 oC,最终获得94%收率的C-H官能团化产物3a。
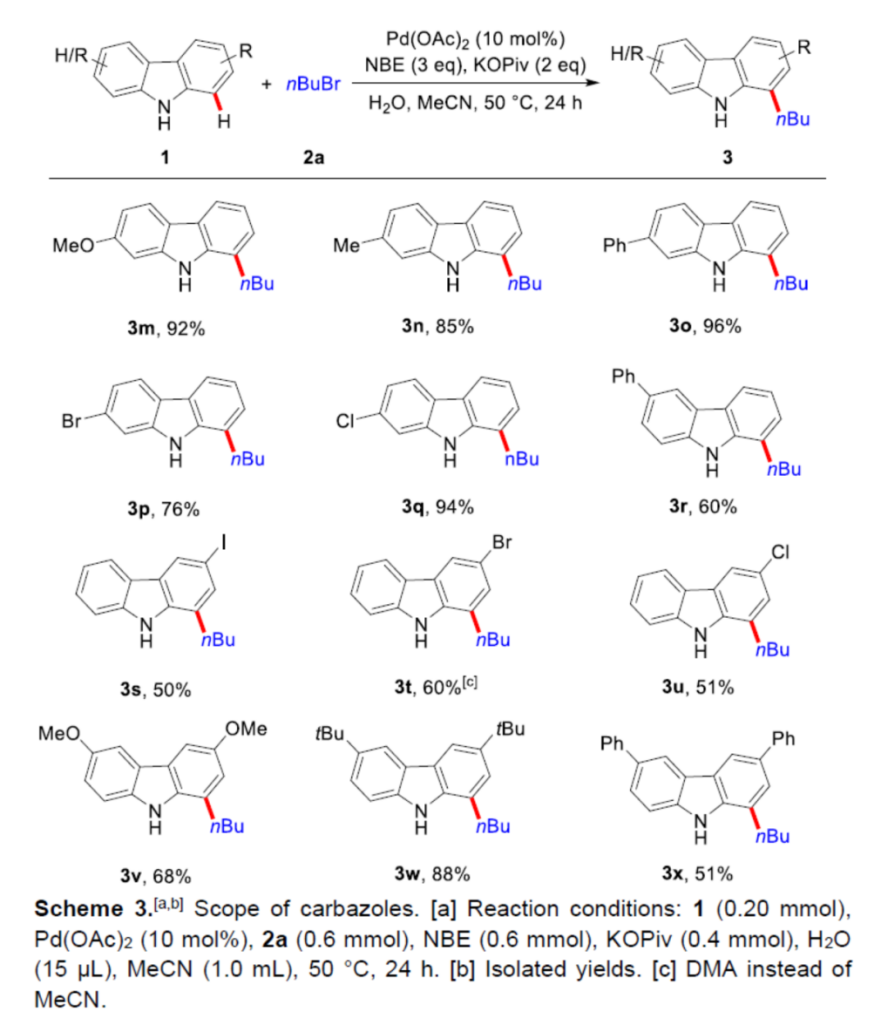
在上述的最佳反应条件下,作者分别对一系列烷基与芳基溴底物 (Scheme 2)以及咔唑底物 (Scheme 3)的应用范围进行深入研究。


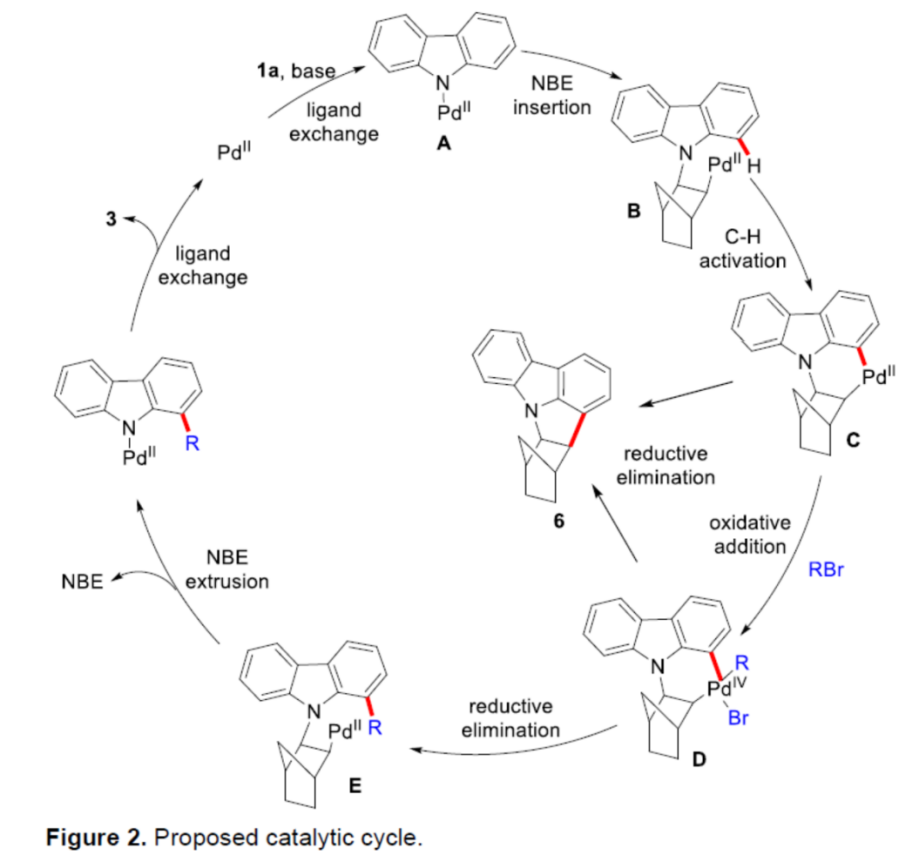
基于前期相关的文献报道[1], [9],作者提出如下合理的反应机理 ( Figure 2)。
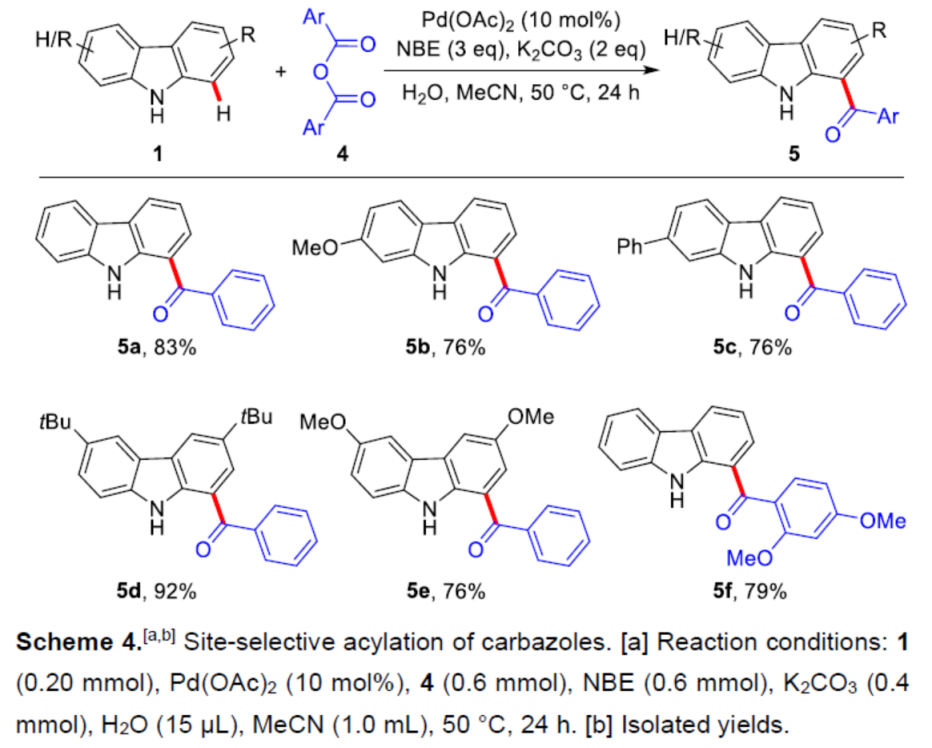
同时,该小组将上述的反应条件进一步优化,进而顺利完成一系列咔唑衍生物的选择性酰化 (Scheme 4)。

总结:
美国Texas Tech大学的H. Ge与IIT Bombay的D. Maiti课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的采用钯/NBE催化体系促进的通过咔唑类化合物参与的C-H烷基化与酰化反应方法学,进而成功完成一系列取代咔唑分子的构建。这一全新的C-H官能团化策略具有广泛的底物应用范围、优良的官能团兼容性以及优良的位点选择性等优势。
参考文献:
- [1] M. Catellani, F. Franco, A. Rangoni, Angew. Chem., Int. Ed. 1997, 36, 119. doi: 10.1002/anie.199701191.
- [2] J. Wang, G. Dong, Chem. Rev. 2019, 119, 7478. doi: 10.1021/acs.chemrev.9b00079.
- [3] S. Chen, Z. Liu, T. Yang, Y. Hua, Z. Zhou, H. Cheng, Q. Zhou, Angew. Chem., Int. Ed. 2018, 57, 7161. doi: 10.1002/anie.201803865.
- [4] Z. Dong, C. Yang, G. Dong, Nat. Chem. 2019, 11, 1106. doi:10.1038/s41557-019-0358-y.
- [5] Z. Dong, J. Wang, G. Dong, J. Am. Chem. Soc. 2015, 137, 5887. doi: 10.1021/jacs.5b02809.
- [6] L. Liu, J. Qiao, K. Yeung, W. Ewing, J. Q. Yu, Angew. Chem., Int. Ed. 2020, 59, 13831. doi: 10.1002/anie.202002865.
- [7] H. J. Knölker, K. R. Reddy, Chem. Rev. 2002, 102, 4303. doi: 10.1021/cr020059j.
- [8] (a) A. W. Schmidt, K. R. Reddy, H.-J. Knölker, Chem. Rev. 2012, 112, 3193. doi: 10.1021/cr200447s .(b) J. Roy, A. K. Jana, D. Mal, Tetrahedron 2012, 68, 6099. doi: 10.1016/j.tet.2012.05.007.(c) S. Maiti, T. Mandal, J. Dash, J. Org.Chem. 2021, 86, 1396. doi: 10.1021/acs.joc.0c01746.(d) L. Zhu, X. Cao, R. Qiu, T. Iwasaki, V. P. Reddy, X. Xu, S.-F. Yin, N. Kambe, RSC Adv. 2015, 5, 39358. doi: 10.1039/C5RA04965B.(e) B. Urones, R. G. Arrayás, J. C. Carretero, Org. Lett. 2013, 15, 1120. doi: 10.1021/ol400206k.
- [9] L. Jiao, E. Herdtweck, T. Bach, J. Am. Chem. Soc. 2012, 134, 14563. doi: 10.1021/ja3058138.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载






















No comments yet.