作者:石油醚
导读:
近日,中国科学院上海有机化学研究所汤文军研究员、徐广庆副研究员和南方科技大学化学系钟龙华教授合作在Angewandte Chemie发表论文,报道了新型手性双硼介导芳基烷基酮亚胺的不对称还原偶联,合成了一系列前所未有的手性大位阻邻位四取代邻二胺,反应中无内消旋化合物产生。该方法具有实用、广谱、简单、高效等特点,表现出优异的非对映选择性和对映选择性。该文将在Angewandte Chemie以hot paper形式发表。
Asymmetric Synthesis of Vicinal Tetrasubstituted Diamines via Reductive Coupling of Ketimines Templated by Chiral Diborons
M.Zhou, Y.Lin, X.-X. Chen, G.Xu*, L.W.Chung*, W.Tang*.
Angew. Chem. Int. Ed. 2023, ASAP. doi: 10.1002/anie.202300334
正文:
手性邻二胺近年来逐渐成为药物[1]、生物活性分子、功能材料[2]和金属有机催化剂[3]的重要合成砌块,也更多地用作手性的有机小分子催化剂[4]。在过去数十年里化学家们发展了许多合成手性邻二胺的方法包括一系列高效的不对称催化反应[5]- [9]。然而,绝大多数已知的方法局限于邻位单或双取代的手性邻二胺的合成,对于邻位四取代邻二胺的不对称合成鲜有报道(Figure 1)。而要实现邻位四取代的手性邻二胺的高效合成需要克服对空间位阻、底物的低反应性、化学选择性、非对映选择性和对映选择性等诸多困难与挑战。
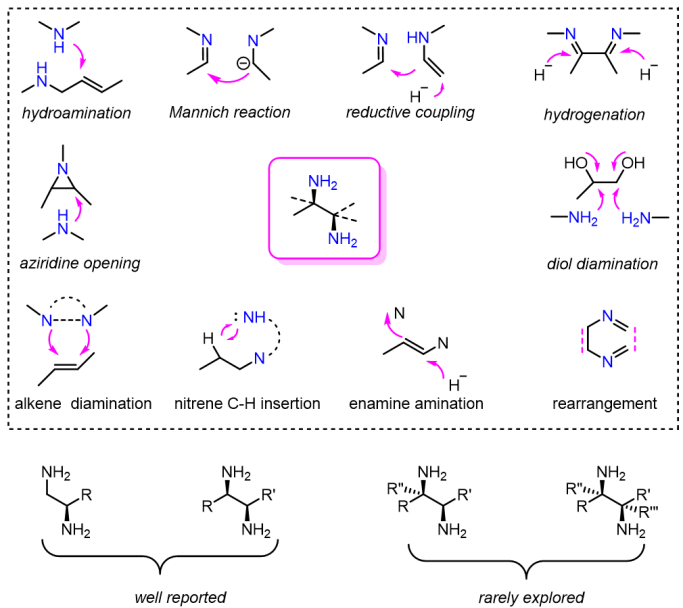
Figure 1. Current development on enantioselective synthesis of chiral vicinal diamines.
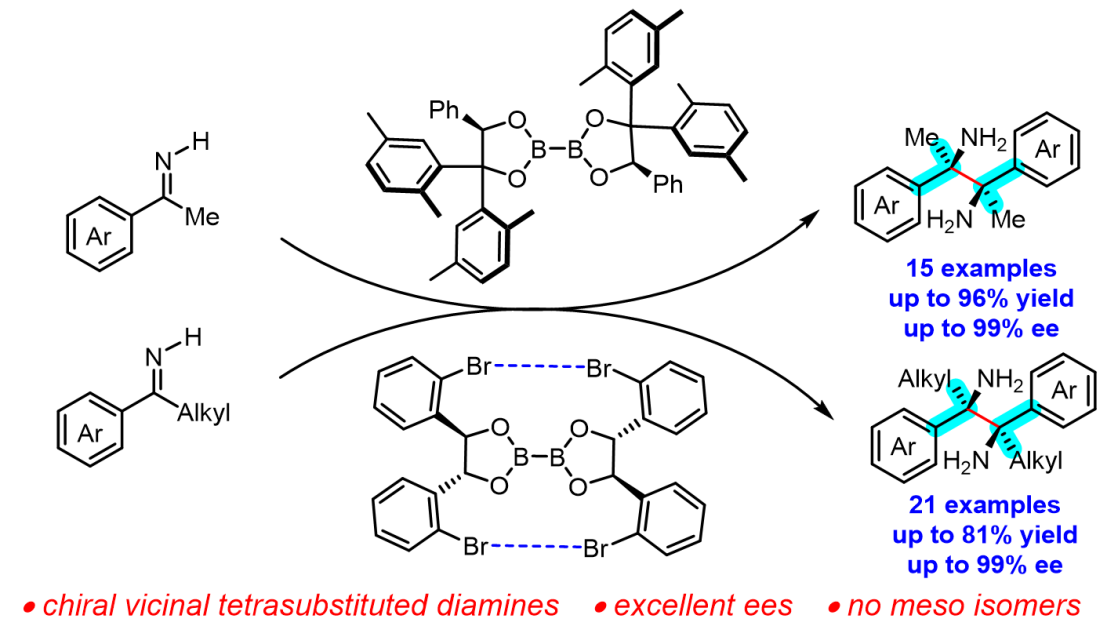
基于研究团队在双硼介导[3,3]-σ重排方面的前期工作(J. Am. Chem. Soc. 2017, 139, 9767; J. Organomet. Chem. 2018, 864, 97; J. Am. Chem. Soc. 2020, 142, 10337),上海有机所汤文军/徐广庆课题组实现了新型手性双硼介导的邻位四取代邻二胺的不对称合成。研究团队利用大位阻的手性联硼酸酯作为手性试剂,仅一步反应首次实现了芳基烷基酮亚胺的高效还原偶联,合成了一系列以前未有的邻位四取代邻二胺,反应中无内消旋化合物产生。该方法具有实用、广谱、简单、高效等特点,表现出优异的非对映选择性和对映选择性(Scheme 1)。
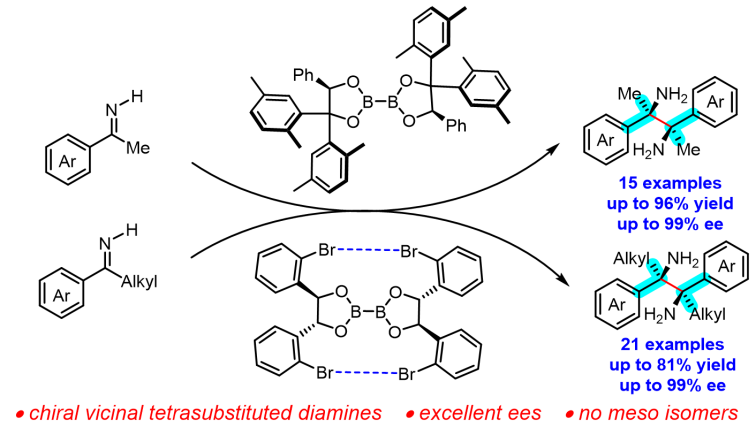
Scheme 1. Asymmetric synthesis of chiral vicinal tetrasubstituted diamines.
在成功制备酮亚胺后,研究团队首先使用大位阻双硼DB1对活性较低的N-H芳基甲基亚胺成功进行不对称还原偶联,以优异的对映选择性和中等到良好的收率得到相应的手性邻位四取代邻二胺(Table 1)。
Table 1. Chiral Diboron-templated Asymmetric Reductive Coupling of Ketimines.
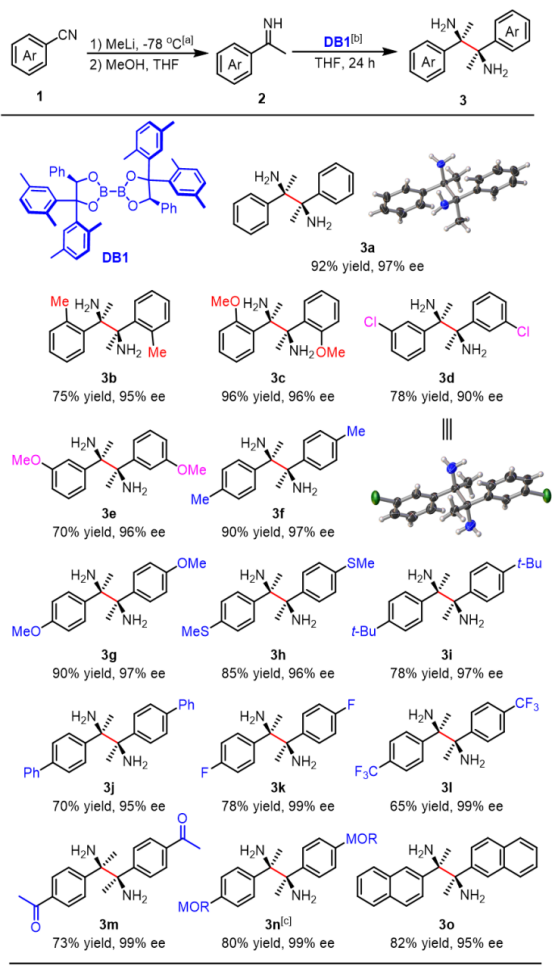
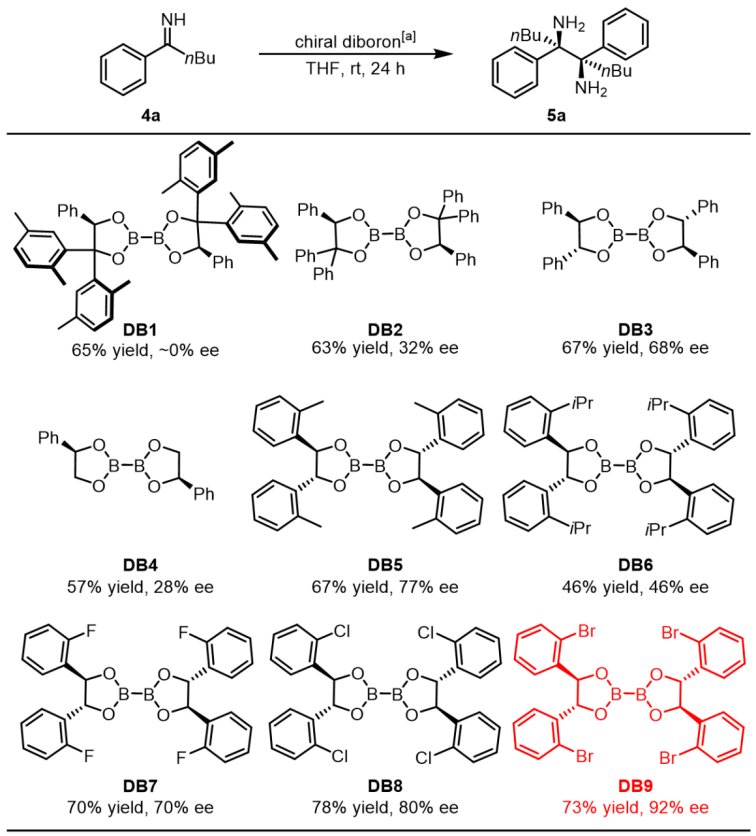
当双硼DB1应用于更大位阻的芳基丁基酮亚胺底物时,只能拿到近乎消旋的产物,这可能是体积更大的底物4a在过渡态中无法满足DB1的空间需要,所间位阻小的双硼可能可更适合类似4a这类更长烷基链的芳基烷基亚胺底物。因此,该团队制备了一系列不同位阻大小和不同电性的双硼并且筛选出最优双硼DB9(Table 2)。
Table 2. Asymmetric Reductive Coupling of Ketimine 4a Templated with Various Chiral Diborons
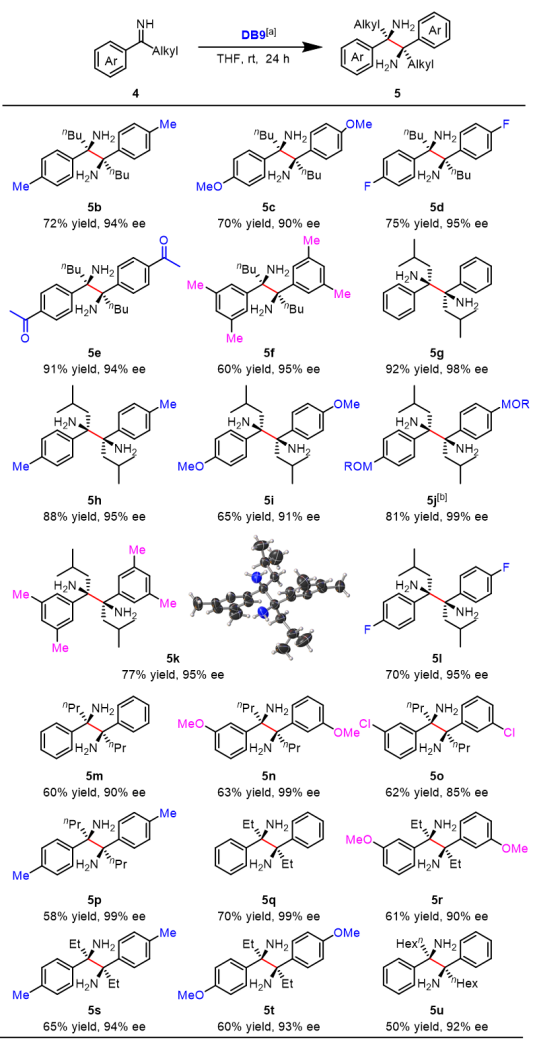
紧接着作者将DB9用于一系列更长烷基链的芳基烷基亚胺的不对称还原偶联中,以优秀的收率和对映选择性得到相应的手性邻位四取代邻二胺,对直链和支链的烷基链均可很好地兼容(Table 3)。
Table 3. Asymmetric Reductive Coupling of Ketimines Templated by DB9
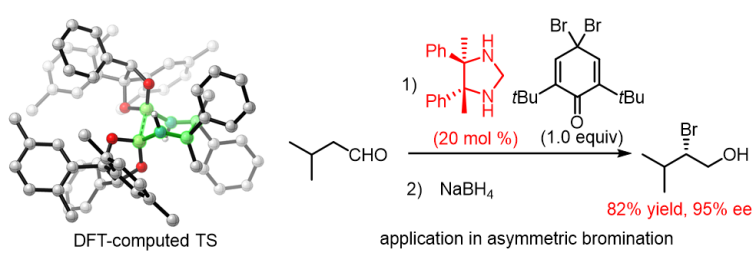
以 SMD M06-2X/6-31G* 为方法的DFT计算研究表明,DB1和DB9分别经过TS1-A1和TS9-A1协同[3,3]-σ型重排过渡态结构形成主要耦合产物P1-A1和P9-A1。在DB1催化体系中,作者观察到优势过渡态TS1-A1与次要的过渡态TS1-A2采用了不同的“扭曲半椅式 ”构象,过渡态 TS1-A2相比于优势过渡态TS1-A1,DB1中的轴向氧原子与底物较大的苯基之间存在的空间位阻导致其更高的扭曲能是促进对映选择性的主要驱动力。而对于DB9催化体系,反应有利过渡态结构中,溴代苯采用远离硼氧键的“反式”构象,减少溴-氧键的静电排斥作用及形成有利于稳定过渡态的溴-溴卤键作用。优势过渡态TS9-A1 中酮亚胺的N-H键和硼氧之间较短的距离,以及底物的轴向苯环和硼氧之间较小的空间位阻,是实现手性控制的主要因素(Figure 2)。
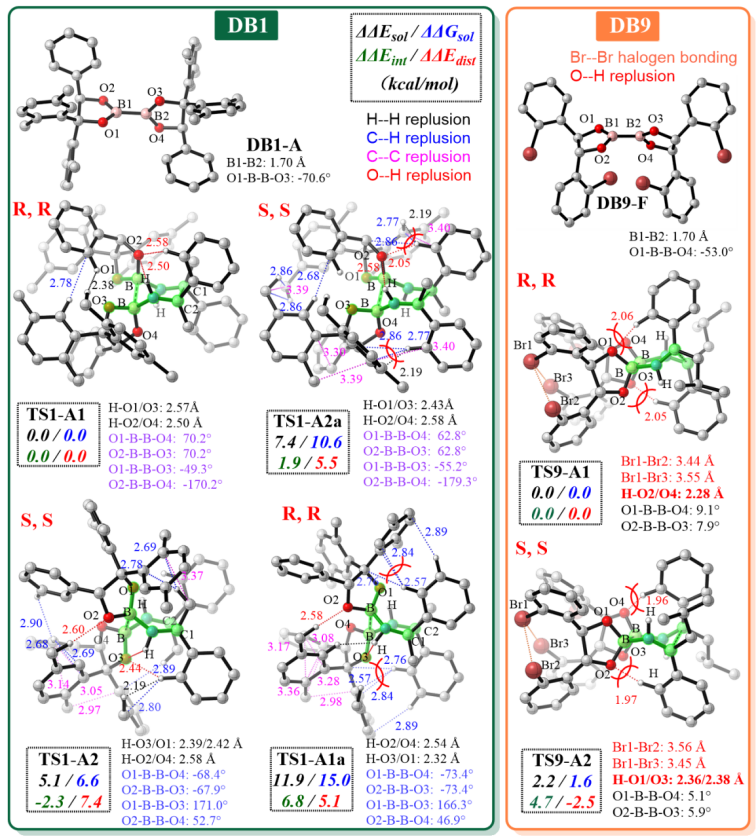
Figure 2. Computed relative electronic energy and free energy (in kcal/mol) and distortion/interaction analysis for the lower-energy concerted [3,3]-sigmatropic rearrangement transition states with (left) DB1 and (Right) DB9 in solution by the SMD M06-2X/6-31G* method. The key geometrical parameters are also given.
值得注意的是,DFT计算也定性地支持了不同卤素取代基对观察到的对映选择性的远程影响,部分原因是不同取代基对零点能量(ZPE)校正的修正幅度不同(Br是最小的修正)。
手性联硼酸酯DB1和DB9可以很好地实现实验室克级规模制备手性四取代二胺,并且光学纯的邻位四取代邻二胺可以用于发展有效的有机小分子催化剂。在脂肪醛的不对称α-溴代反应中,邻位四取代邻二胺衍生的有机催化剂展示出优秀的对映选择性(Scheme 3)。
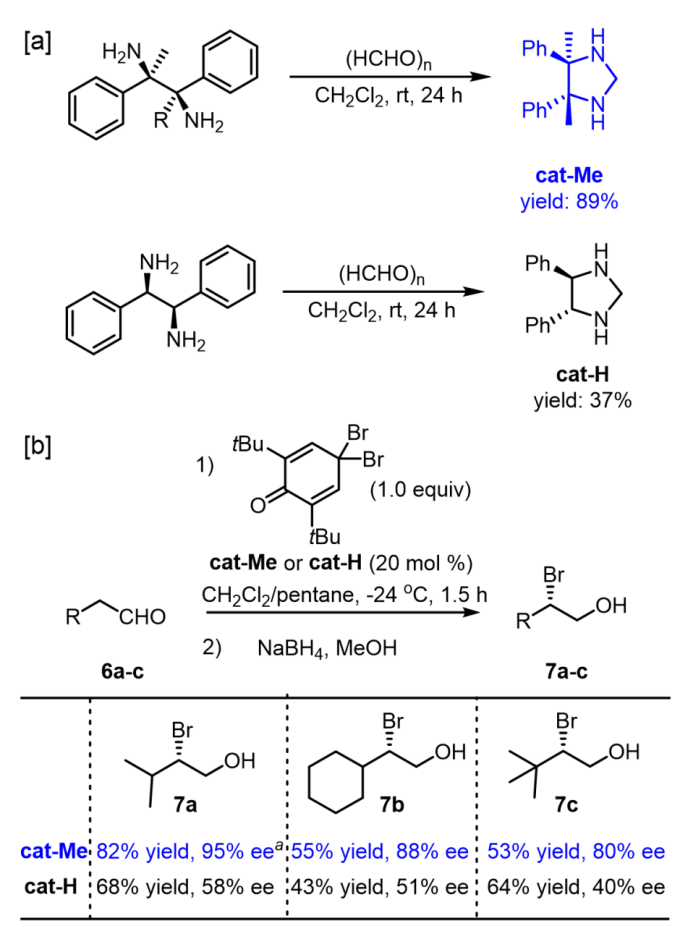
Scheme 3. Asymmetric α-Bromination of Aldehydes
总结:
中科院上海有机所汤文军课题组设计出新型手性联硼酸酯,实现一系列不同烷基链长的芳基烷基亚胺的不对称还原偶联,并且与南方科技大学钟龙华团队合作,通过系统性的DFT计算展示了两种手性双硼在六元环紧密过渡态中采用了不同的构象或组装模式。除此之外,该课题组也将手性邻位四取代邻二胺发展为有机小分子催化剂应用于脂肪醛的不对称α-溴代反应中。该工作是研究团队在发现和发展双硼参与[3,3]-σ重排反应方面的最新突破,为邻位四取代手性邻二胺及相关手性砌块提供一个高效、简便和实用的合成方法。
参考文献:
- [1] V. V. Bakhonsky, A. A. Pashenko, J. Becker, H. Hausmann, H. J. M. D. Groot, H. S. Overkleeft, A. A. Fokin, P. R. Schreiner, Dalton. Trans. 2020, 49, 14009. doi: 10.1039/D0DT02391D.
- [2] C. Hirel, J. Pécaut, S. Choua, P. Turek, D. B. Amabilino, J. Veciana, P. Rey, Eur. J. Org. Chem. 2005, 348. doi: 10.1002/ejoc.200400454.
- [3] S. Hashiguchi, A. Fujii, J. Takehara, T. Ikariya, R. Noyori, J. Am. Chem. Soc. 1995, 117, 7562. doi: 10.1021/ja00133a037.
- [4] E. P. Talsi, K. P. Bryliakov, Angew. Chem. Int. Ed. 2004, 43, 5228. doi: 10.1002/anie.200460108.
- [5] E. P. Vanable, J. L. Kennemur, L. A. Joyce, R. T. Ruck, D. M. Schultz, K. L. Hull, J. Am. Chem. Soc. 2019, 141, 739. doi: 10.1021/jacs.8b09811.
- [6] J. Chen, X. Gong, J. Li, Y. Li, J. Ma, C. Hou, G. Zhao, W. Yuan, B. Zhao, Science 2018, 360, 1438. doi: 10.1126/science.aat4210.
- [7] P. Zhou, X. Shao, S. J. Malcolmson, J. Am. Chem. Soc. 2021, 143, 13999. doi: 10.1021/jacs.1c07707.
- [8] Y. Chen, Y. Pan, Y.-M. He, Q.-H. Fan, Angew. Chem. Int. Ed. 2019, 58, 16831. doi: 10.1002/anie.201909919.
- [9] H.-J. Pan, Y. Lin, T. Gao, K. Lau, W. Feng, B. Yang, Y. Zhao, Angew. Chem. Int. Ed. 2021, 60, 18599. doi: 10.1002/anie.202101517.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.