本文作者:杉杉
导读
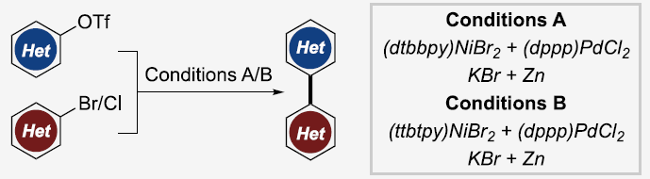
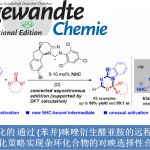
近日,Wisconsin-Madison大学的D. J. Weix课题组在J. Am. Chem. Soc.中发表论文,报道一种全新的通过Ni与Pd催化的杂芳基卤与杂芳基三氟甲磺酸酯之间的多金属交叉Ullmann偶联反应 (multimetallic cross-Ullmann coupling)方法学,进而成功完成一系列杂环联芳基化合物 (biheteroaryl)的构建。这一全新的交叉偶联策略具有反应条件温和、底物范围广泛以及高度的官能团兼容性等优势。
A General, Multimetallic Cross-Ullmann Biheteroaryl Synthesis from Heteroaryl Halides and Heteroaryl Triflates
K. Kang, N. L. Loud, T. A. DiBenedetto, D. J. Weix, J. Am. Chem. Soc. 2021, 143, 21484. doi:10.1021/jacs.1c10907.
正文
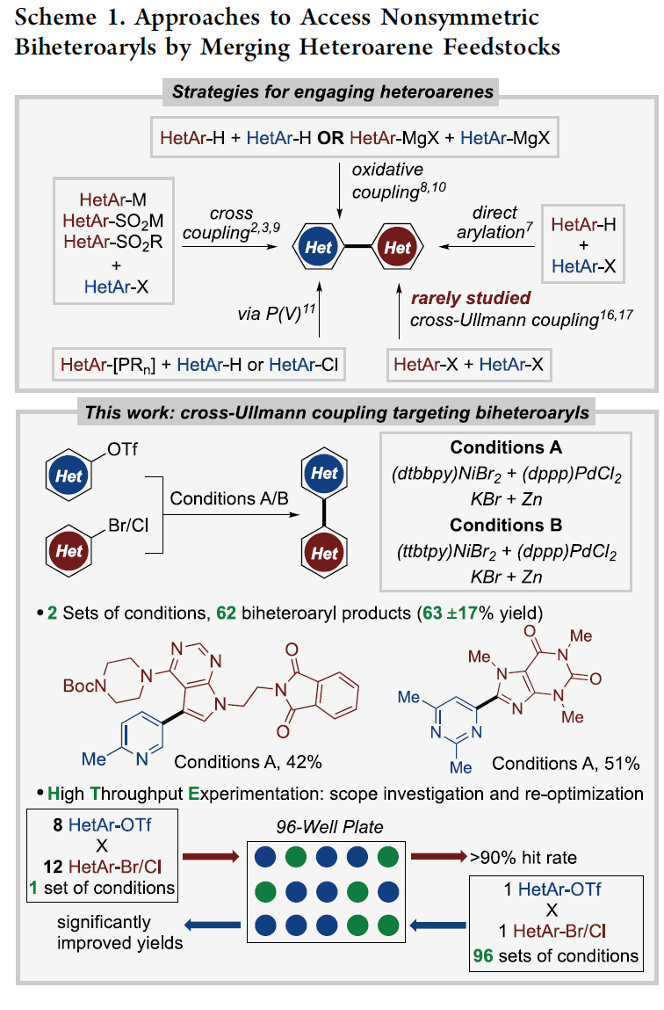
杂环联芳基化合物广泛存在于各类药物、电子材料、配体以及天然产物分子中。然而,对于杂环联芳基化合物相关合成策略的研究,目前仍面临诸多挑战(Scheme 1)[1]-[8]。受到前期对于交叉Ullmann偶联反应方法学[9]以及本课题组对于多金属催化的交叉偶联反应方法学[10]相关研究的启发,这里,D. J. Weix课题组成功设计出一种全新的多金属催化交叉Ullmann偶联反应方法学 (Scheme 1)。
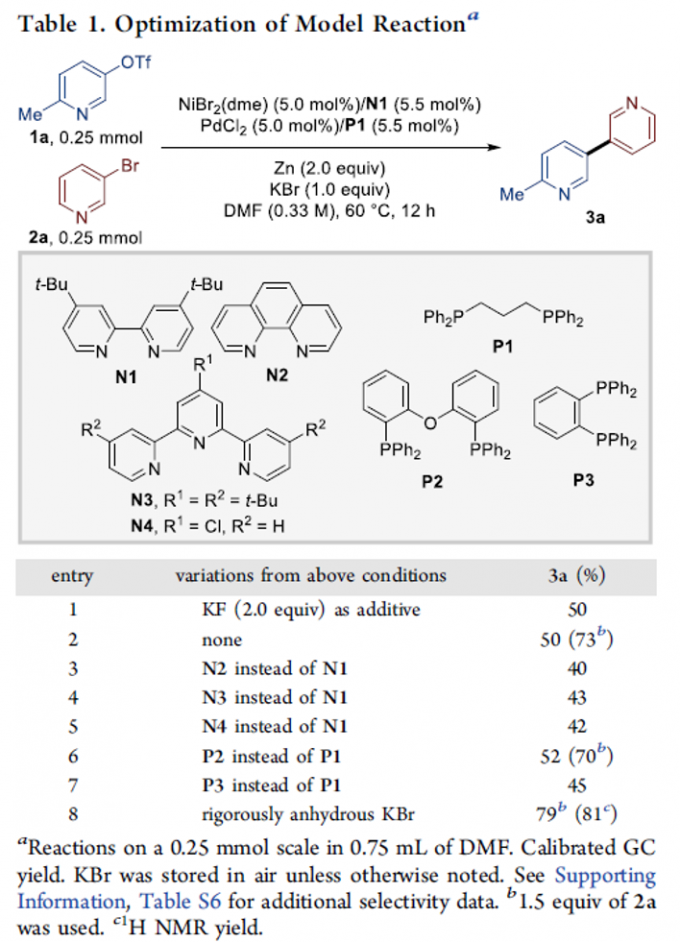
首先,作者采用1a与3-溴吡啶2a作为模型底物,进行相关偶联反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用NiBr2(dme)/N1与PdCl2/P1作为催化剂,Zn作为还原剂,无水KBr作为添加剂,DMF作为反应溶剂,反应温度为60oC,最终获得79%收率的偶联产物3a。
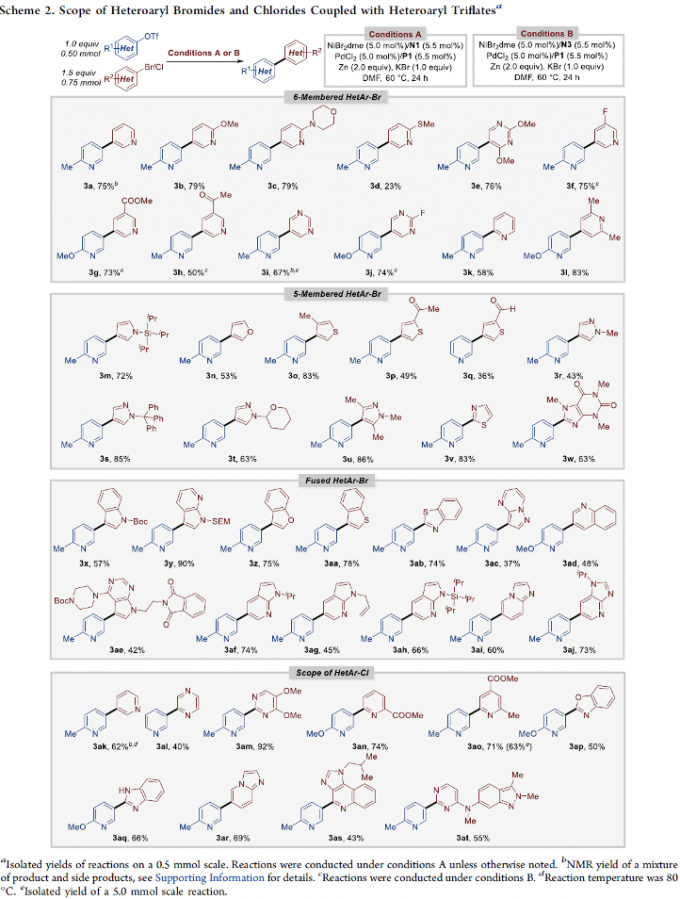
在上述的最佳反应条件下,作者首先对各类杂芳基溴与杂芳基氯底物的应用范围进行考察 (Scheme 2)。研究表明,一系列六元环、五元环与稠合杂环芳基溴底物,均能够较好地与上述的标准反应条件兼容,并以中等至优良的反应收率,获得相应的交叉偶联产物3a–3z以及3aa-3aj。之后,作者发现,一系列杂芳基氯底物,同样能够有效地参与上述的交叉偶联过程,进而以中等至优良的反应收率,获得相应的目标产物3ak–3at。并且,通过杂芳基氯底物参与的交叉Ullmann偶联反应方法学能够进一步应用于各类药物分子 (3as-3at)的结构修饰。而且,作者进一步发现,将底物3ao的用量增加至5 mmol时,同样能够顺利地完成上述的交叉偶联过程。同时,该小组观察到,这一全新的交叉Ullmann偶联策略对于各类亲电性官能团 (3g, 3h, 3p, 3q, 3an, 3ao)、酸敏性保护基 (acid-sensitive protecting groups) (3m, 3s, 3t, 3x, 3ah) 与烯丙基 (3ag)以及具有高度立体位阻的各类基团 (3e, 3o, 3u, 3w,3xaa, 3ac, 3ae),均表现出良好的兼容性。接下来,该小组研究发现,采用ttbtpy (N3)配体时 (Conditions B),能够有效地抑制缺电子杂芳基溴底物的同偶联过程,进而获得相应的交叉Ullmann偶联产物3f–3j。
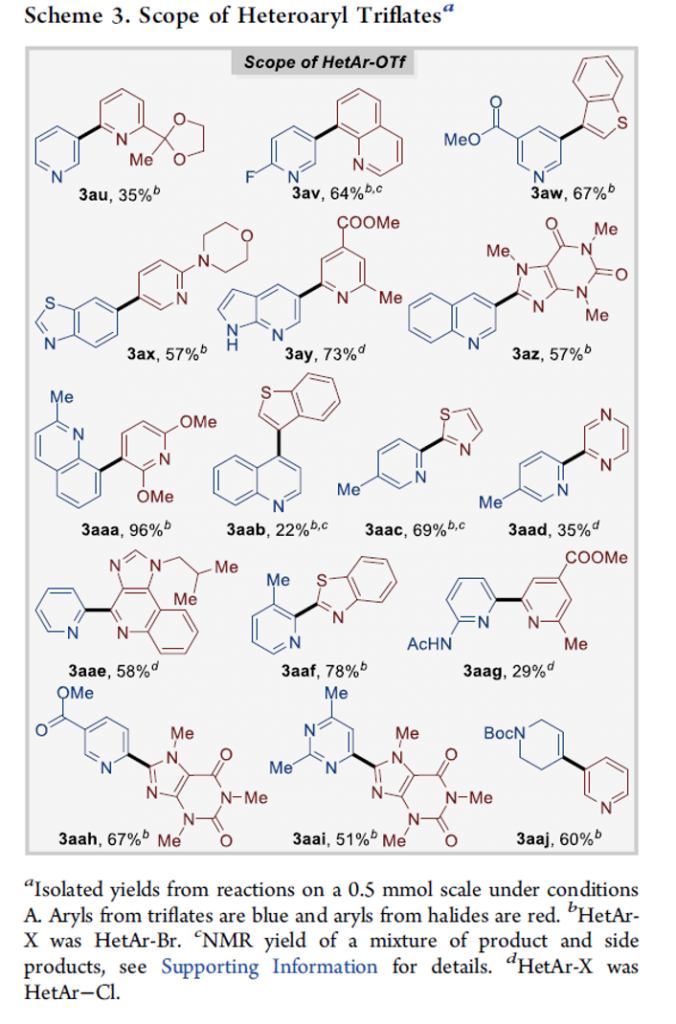
接下来,作者对一系列杂芳基三氟甲磺酸酯底物的应用范围进行深入研究(Scheme 3)。该小组发现,各类具有不同电子性质的杂芳基三氟甲磺酸酯底物,均能够顺利地参与上述的交叉Ullmann偶联过程,并以中等至优良的反应收率,获得相应的产物3au–3aai。同时,研究表明,上述的标准反应体系同样能够良好地应用于各类非芳香烯基三氟甲磺酸酯 (3aaj)底物,进而获得良好的反应收率。
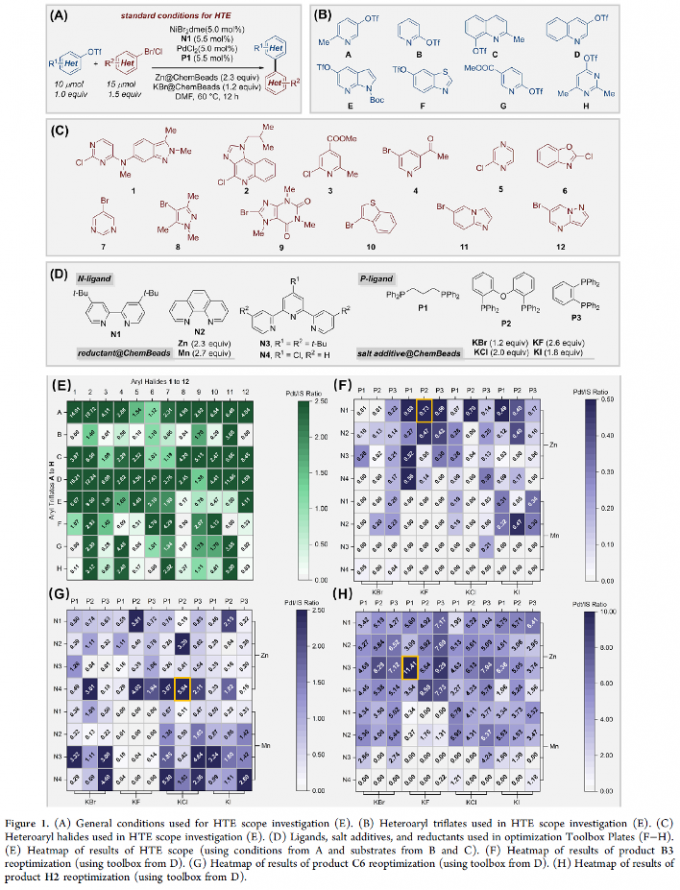
接下来,作者通过标准的高通量实验 (THE, high-throughput experimentation)对上述的反应条件进行进一步优化,同时对这一全新的交叉Ullmann偶联反应策略在药物化学中的应用进行更为深入的研究 (Figure 1)。
总结
Wisconsin-Madison大学的D. J. Weix课题组报道一种全新的通过Ni与Pd催化剂促进的杂芳基卤与杂芳基三氟甲磺酸酯之间的多金属交叉Ullmann偶联反应 (multimetallic cross-Ullmann coupling)方法学,进而顺利完成一系列杂环联芳分子的构建。这一全新的交叉Ullmann偶联反应方法学具有反应条件温和、底物范围广泛以及高度的官能团兼容性等优势。同时该小组通过高通量实验的进一步优化,进一步表明这一全新的交叉Ullmann偶联具有潜在的合成应用价值。
参考文献
[1] (a) V. F. Slagt, A. H. M. de Vries, J. G. de Vries, R. M. Kellogg, Org. Process Res. Dev. 2010, 14, 30. doi: 10.1021/op900221v.(b) A. E. Rubtsov, A. V. Malkov, Synthesis 2021, 53, 2559. doi: 10.1055/s-0040-1706030.
[2] C. Cordovilla, C. Bartolome, J. M. Martinez-Ilarduya, P. Espinet, ACS Catal. 2015, 5, 3040. doi: 10.1021/acscatal.5b00448. [3] V. Snieckus, Chem. Rev. 1990, 90, 879. doi: 10.1021/cr00104a001. [4] P. A. Cox, M. Reid, A. G. Leach, A. D. Campbell, E.J. King,G. C. Lloyd-Jones, J. Am. Chem. Soc. 2017, 139, 13156. doi: 10.1021/jacs.7b07444. [5] D. Alberico, M. E. Scott, M. Lautens, Chem.Rev.2007, 107, 174. doi: 10.1021/cr0509760. [6] Y. Yang, J. Lan, J. You, Chem. Rev. 2017, 117, 8787. doi: 10.1021/acs.chemrev.6b00567. [7] T. Markovic, P. R. D. Murray, B. N. Rocke, A. Shavnya, D. C. Blakemore, M. C. Willis, J. Am. Chem. Soc.2018, 140, 15916. doi: 10.1021/jacs.8b09595. [8] M. C. Hilton, X. Zhang,B. T. Boyle,J.V. Alegre-Requena,R. S. Paton, A. McNally, Science 2018, 362, 799. doi: 10.1126/science.aas8961. [9] (a) O. Baudoin, M. Cesario, D. Guénard, F. Guéritte, J. Org. Chem. 2002, 67, 1199. doi: 10.1021/jo0160726.(b) C. Gosmini, S. Lasry, J. Y. Nedelec, J. Perichon, Tetrahedron 1998, 54, 1289. doi: 10.1016/S0040-4020(97)10225-3.
(c) W. Miao, C. Ni, P. Xiao, R. Jia, W. Zhang, J. Hu, Org. Lett. 2021, 23, 711. doi: 10.1021/acs.orglett.0c03939.
(d) S. Sengmany, S. Vasseur, A. Lajnef, E. Le Gall, E. Leonel, Eur. J. Org. Chem. 2016, 4865. doi: 10.1002/ejoc.201600790.
(e) A. Dewanji, R. F. Bülow, M. Rueping, Org. Lett. 2020, 22, 1611. doi: 10.1021/acs.orglett.0c00199.
(f) J. Qin, S. Zhu, L. Chu, Organometallics 2021, 40, 2246. doi: 10.1021/acs.organomet.0c00813.
(g) S. Xu, F. Sun, W. Deng, H. Hao, X. Duan, New J. Chem. 2018, 42, 16464. doi: 10.1039/C8NJ02184H.
(h) L. Liao, X. Kong, X. Duan, J. Org. Chem. 2014, 79, 777. doi: 10.1021/jo402084m.
(i) T. Wu, Y. Zhang, Y. Fu, F. Liu, J. Tang, P. Liu, F. D. Toste, B. Ye, Chem. 2021, 7, 1963. doi: 10.1016/j.chempr.2021.06.007.
(j) L. K. G. Ackerman, M. M. Lovell, D. J. Weix, Nature 2015, 524, 454. doi: 10.1038/nature14676.
[10] (a) L. Huang, L. K. G. Ackerman, K. Kang, A. M. Parsons, D. J. Weix, J. Am. Chem. Soc. 2019, 141, 10978. doi: 10.1021/jacs.9b05461.(b) K. Kang, L. Huang, D. J. Weix, J. Am. Chem. Soc. 2020, 142, 10634. doi: 10.1021/jacs.0c04670.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.