本文作者:杉杉
导读
近期,泰国Chulalongkorn大学的S. Wacharasindhu课题组在Green Chemistry中发表论文,报道了一种全新的电化学合成策略,能够通过2-氨基苯酚与异硫氰酸酯作为起始原料,直接合成2-氨基苯并噁唑。同时,该反应选择廉价易得的NaI/NaCl试剂作为反应媒介/电解质 (mediator/electrolyte),无需加入外部支持电解质 (external supporting electrolyte)与碱。同时,上述反应能够在环境友好型的乙醇/水混合溶剂以及更为温和的反应条件下进行。
Electrochemical NaI/NaCl-mediated one-pot synthesis of 2-aminobenzoxazoles in aqueous media via tandem addition cyclization
T. N. T. Huynh, T. Tankam, S. Koguchi, T. Rerkrachaneekorn, M. Sukwattanasinitta S. Wacharasindhua, Green Chem. ASAP. doi:10.1039/D1GC01131F.
正文:
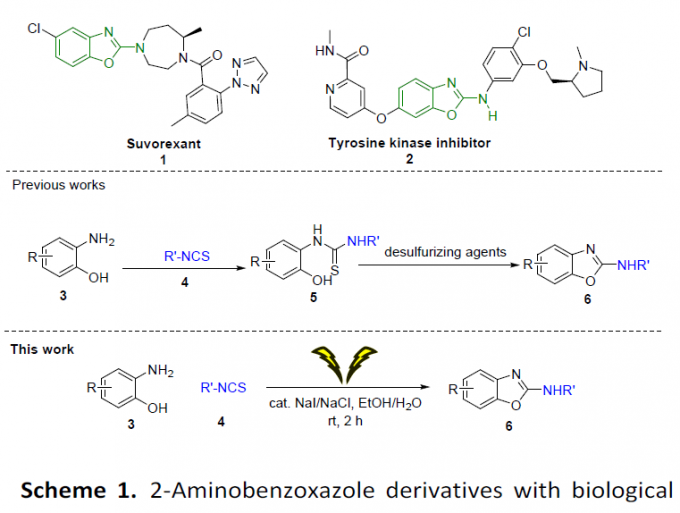
2-氨基苯并噁唑已经成为药物化学中重要的杂环骨架单元,并且具有这一骨架的诸多衍生物能够表现出不同形式的生物活性,例如Merck公司研发出的Suvorexant (1)已经批准用于失眠症 (insomnia)的治疗,酪氨酸激酶抑制剂 (tyrosine kinase inhibitor, 2)用于结直肠癌 (colorectal cancer)的治疗已经进入临床试验阶段 (Scheme 1)。目前, 2-氨基苯并噁唑相关的合成方法学研究主要涉及带有离去基团的2-取代苯并噁唑与胺的取代反应以及苯并噁唑底物的直接胺化反应。虽然上述的反应方法学通常具有较高的收率,然而,却存在反应条件苛刻、采用有毒的试剂与有毒有机溶剂等弊端。同时,通过邻羟基硫脲 (5)的氧化环化过程,同样能够完成2-氨基苯并噁唑 (6)的合成 (Scheme 1)。最近,Wu等[1]报道采用双重催化剂 (dual-catalysts) Cu2O/TBAB体系进行邻位取代胺与芳基异硫氰酸酯之间的一锅脱硫/脱氢环化 (desulfurization/dehydrogenative cyclization)的绿色反应方法学,然而,该方法学同样存在试剂昂贵、反应时间较长、反应条件苛刻等不利因素。之后,Yadav等[2]采用Eosin Y作为光氧化还原催化剂,将预先制备的硫脲通过可见光媒介下的环化脱硫 (cyclo-desulfurization)过程,成功完成氨基苯并噁唑分子的构建。尽管这一策略选用绿色LED与富氧空气 (oxygen air)作为绿色活化剂 (green activator),然而,同样存在不足之处,例如,采用化学计量的碱以及有害溶剂DMF。
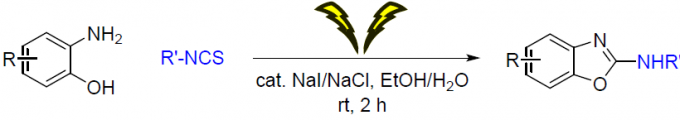
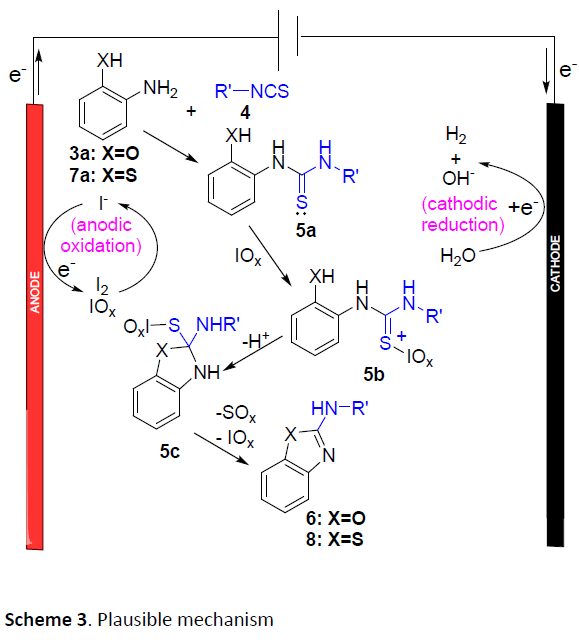
在过去几十年中,电合成 (electrosynthesis)作为一种通用与环境友好的合成策略,通过电流 (electric current)或“清洁”电子 (“clean” electrons)代替环境有害型氧化剂。其中,有机硫化合物的电化学氧化 (electrooxidation) [3]为当前有机合成方法学研究中较为新颖的方向之一。2017年,Noel等[4]首次报道将硫醇与硫醚通过电化学氧化,产生亚砜/砜以及二硫醚的合成转化方法学。随后,Lei等[5]报道在电化学氧化条件,通过分子内脱氢形成C-S键的反应策略,进而顺利完成一系列苯并噻唑分子的构建。同时,Guan等[6]报道采用硫代羧酸的电化学氧化过程,进而构建酰胺键的反应策略。尽管电化学氧化的合成策略能够有效地避免采用的有毒的氧化剂,并且,能够通过电压 (voltage)或电流 (current)的调节,进而实现反应选择性的精细调控 (fine-tuned)。然而,在电化学的反应策略中,却需要采用过量的有毒电解质[7]。此外,Little等[8]-[9]报道通过电化学碘化物媒介的C-N与C-O键生成策略,从而顺利完成一系列苯并噁唑衍生物的构建。在这一反应策略中,采用苯并噁唑作为起始原料或在有机溶剂中通过两步反应过程,进而完成一系列苯并噁唑衍生物的合成。然而,开发出一种采用简单起始原料,能够更为绿色地实现苯并噁唑衍生物一步构建的合成转化策略,仍然存在较多的挑战。在此,作者成功开发出一种通过2-氨基苯酚与异硫氰酸酯作为起始原料,进而高效合成2-氨基苯并噁唑分子的一锅串联加成-环化脱硫 (one-pot tandem addition-cyclodesulfurization)策略。这一策略中,采用催化量的环境无害型NaI/NaCl试剂作为反应媒介/电解质 (mediator/electrolyte),并选择无毒的乙醇/水体系作为反应溶剂。同时,上述反应能够在更加温和的条件下进行。
首先,作者采用2-氨基苯酚3a与异硫氰酸苯酯4a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。最终,确定最佳的反应条件为:采用催化量的NaI/NaCl作为反应媒介/电解质,乙醇/水混合体系作为反应溶剂,采用石墨棒(graphite rod)分别作为阳极与阴极,电流密度 (current density)为13 mA/cm2,在无隔膜电解槽 (undivided cell)中,室温下进行相应的电解反应,即可获得95%收率的目标产物6aa。
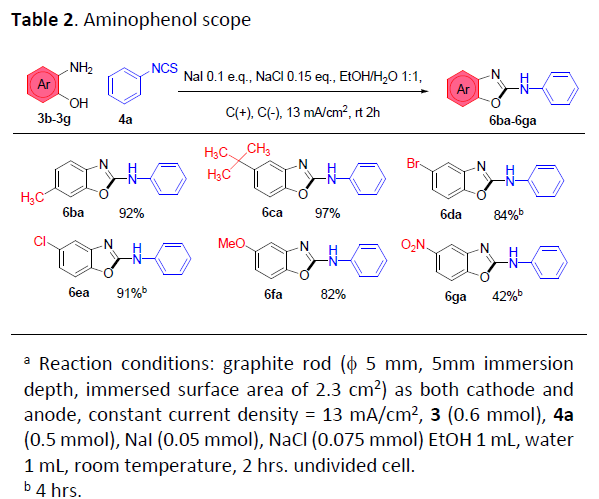
在获得上述最佳反应条件后,作者开始对氨基苯酚的底物应用范围进行考察(Table 2)。研究表明,芳基中带有一系列不同取代基团的氨基苯酚,例如甲基、叔丁基、甲氧基、卤素等,均能够与4a顺利反应,并获得相应的产物6ba–6fa,收率为82-97%。然而,对于具有强吸电子基取代的氨基苯酚底物,却仅能够获得中等收率 (产率为42%)的目标产物6ga,这可能源自于吸电子基团的存在,能够同时降低氨基与羟基的亲核性,从而使反应机理步骤中,硫脲中间体形成速率减慢 (5a in Scheme 3)或使后续环化步骤中的反应速率减慢。
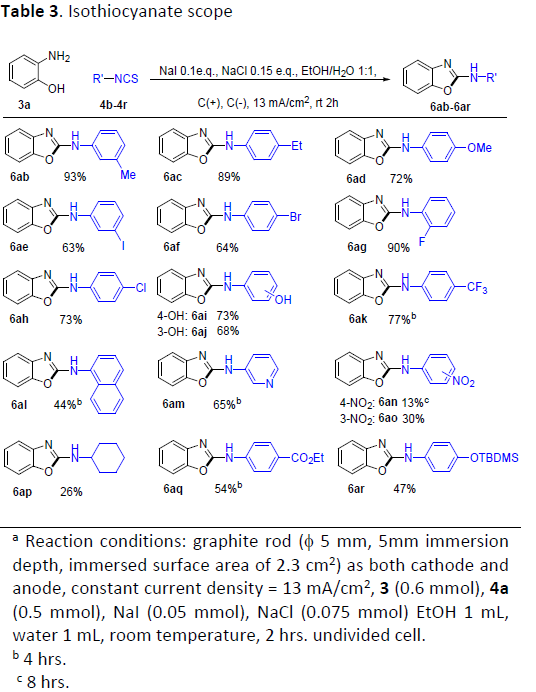
接下来,作者对异硫氰酸酯的底物适用范围进行进一步研究 (Table 3)。实验中,作者观察到,通常,与带有吸电子基团取代的异硫氰酸酯相比,带有供电子基团取代的异硫氰酸酯底物能够更为有效地参与上述转化过程。其中,芳基中带有甲基、乙基、甲氧基、卤素、羟基以及三氟甲基取代的异硫氰酸酯底物,均能够与3a顺利地反应,进而获得相应的杂环产物6ab–6ak,收率为63-93%。其次,具有1-萘基与3-吡啶基等缺电子基团取代的异硫氰酸酯底物,则需要适当延长反应时间,并同样能够获得相应产物6al与6am。同时,对于芳基中具有较强吸电子基团,例如硝基的取代异硫氰酸酯底物,则仅能够获得较低收率的目标产物6an与6ao (收率分别为13 %与33 %)。并且,上述反应条件对于脂肪族异硫氰酸酯底物,例如4p,同样无法获得较高的反应收率。这可能源自于带有烷基的相应中间体在经历氧化步骤之后,变得更加不稳定 (5b in Scheme 3)。值得注意的是,对于芳基中带有活性官能团 (例如-CO2Et与-TBS)取代的异硫氰酸酯底物,同样能够与上述的电化学反应条件良好的兼容,并获得相应的杂环产物6aq与6ar。
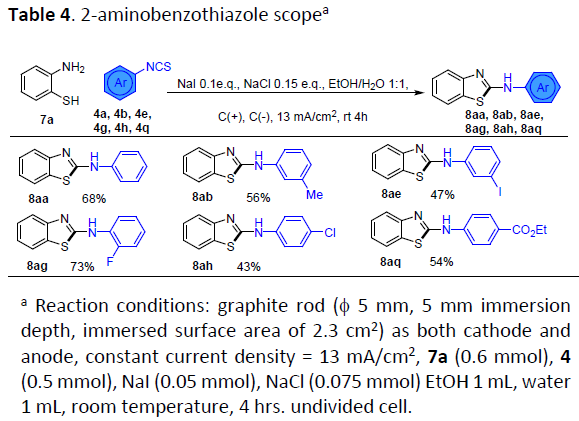
同时,作者进一步将2-氨基苯酚替换为相应的2-氨基硫酚,在上述标准条件下进行相关的加成-脱硫环化过程 (Table 4)。结果表明,芳基中具有不同基团取代的异硫氰酸酯底物,均能够有效地与氨基硫酚7a进行反应,并获得相应的2-氨基苯并噻唑产物8aa、8ab、8ae、8ag、8ah以及8aq,收率为43-73%。
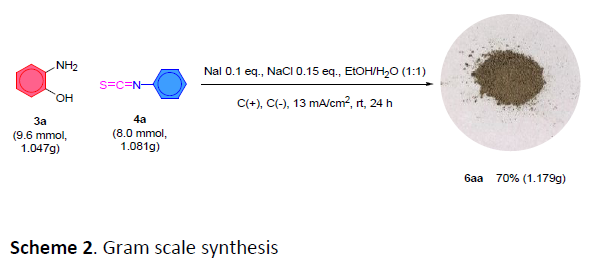
为进一步表明上述反应方法学的实用性,作者进行相关的克级规模反应研究(Scheme 2)。该小组采用底物3a与4a,在上述标准条件下,反应时间为24 h,最终获得70%收率的2-氨基苯并噁唑6aa (为潜在的抗5-LOX抑制剂,inhibitor against 5-LOX)。
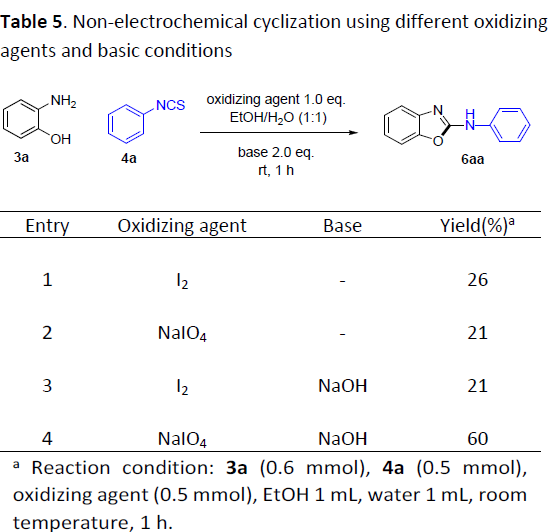
最后,作者提出一种可能的反应机理,主要涉及如下三步:(1) 通过酚与异硫氰酸酯之间的亲核加成过程,形成硫脲5a,(2) 通过硫脲的氧化过程,形成中间体5b,(3)通过环化与消除过程,产生最终的目标产物 (Scheme 3)。其中,通过阳极氧化产生的I2与高碘酸盐作为反应过程中的活性氧化剂。由此,作者推测,上述反应过程同样能够在无外加电流以及通过采用I2或高碘酸盐 (简化表示为IOx)代替相应碘化钠的条件下有效地进行。然而,作者却观察到,与上述电化学反应条件 (Table 1, entry 2)相比,相应目标产物的收率显著降低 (Table 5, entry 1-2)。同时,能够检测出较多量的异硫氰酸酯原料,这表明反应过程中,亲核加成步骤的速率十分缓慢。而相应的亲核加成步骤通常在碱性条件下更为有利,因此,作者接下来选择在氢氧化钠存在的条件下,对上述反应进行深入研究。实验结果表明,在碱存在下,采用碘以及NaIO4作为氧化剂,反应过程中,起始原料能够完全消耗。然而,较为有趣的是,采用NaIO4作为氧化剂,能够获得更高收率的杂环产物6aa (Table 5, entries 3-4)。上述事实表明,在碱性环境中,电化学环化过程的活性氧化剂为高碘酸盐,而非I2。同时,与非电化学的反应条件相比,电化学条件下的环化过程能够获得更高的产物收率,可能归因于氢氧根离子在阴极的缓慢形成。
总结
本文作者开放出一种高效的电化学合成策略,通过2-氨基苯酚在水相溶剂中,经过一锅的串联加成-环化反应过程,从而获得一系列2-氨基苯并噁唑衍生物。值得注意的是,反应过程中较高的产物收率源自于在阴极原位产生的氢氧根离子能够促进亲核加成步骤的进行以及在阳极能够有效地形成环化步骤中所必须的IOx氧化剂。同时,该方法学无需采用外部电解质、碱以及氧化剂,反应条件温和、底物应用范围广泛、具有优良的官能团兼容性,并且,更加的环境友好。




















No comments yet.