作者:石油醚
本期热点研究,我们邀请到了本文第一作者,来自上海交通大学的孙成海博士为我们分享。
2023年4月21日,Angew. Chem. Int. Ed.在线发表了来自上海交通大学瞿旭东教授与孔旭东长聘教轨副教授课题组的合作成果「Engineering the Substrate Specificity of a P450 Dimerase Enables the Collective Biosynthesis of Heterodimeric Tryptophan-Containing Diketopiperazines」。本项研究中,通过对异源二聚化吡咯并吲哚类生物碱生物合成途径中的关键P450酶进行酶工程改造,得到四个突变体蛋白(F387A, F387G, F388N以及E73S),它们可以有效拓展关键P450酶的底物范围,并催化形成至少93个该类复杂生物碱,实现了对异源二聚化吡咯并吲哚类生物碱的集约式生物合成。
“Engineering the Substrate Specificity of a P450 Dimerase Enables the Collective Biosynthesis of Heterodimeric Tryptophan-Containing Diketopiperazines”
Chenghai Sun, Bao-Di Ma, Guangjun Li, Wenya Tian, Lu Yang, Haidong Peng, Zhi Lin, Zixin Deng, Xu-Dong Kong* and Xudong Qu*
Angew. Chem. Int. Ed., 2023, doi: 10.1002/anie.202304994”
Q1. 请对“Engineering the Substrate Specificity of a P450 Dimerase Enables the Collective Biosynthesis of Heterodimeric Tryptophan-Containing Diketopiperazines”作一个简单介绍。
异源二聚化吡咯并吲哚是一类重要的生物碱,其丰富的结构多样性赋予了多种多样的生物学活性,因此拓展该类生物碱的结构多样性对于深入探索其生物活性具有重要意义。在前期工作中,我们发现了首个能够合成该类生物碱的二聚化P450酶NascB,并解析了其催化机制(Nat. Commun., 2018, 91, 4428);阐明了二聚环化P450酶催化反应过程中的区域/立体选择性机制,并利用酶工程方法实现了底物偶联方式的精准控制(Nat. Commun., 2020, 11, 6251);开发了分枝杆菌全细胞催化体系用于该类生物碱的高效生物合成,发现了其该骨架具备优异的神经保护活性(J. Org. Chem., 2021, 86, 11189);以及对吡咯并吲哚类生物碱进行了系统总结并提出了新的分类方法(Nat. Prod. Rep., 2022, 39, 1721)。不过由于目前已知的P450酶对上方底物的选择性极为严谨(只能识别cWLPL, cWLAL, cWLVL),因此要深度开发此类生物碱的药学用途,还需要解决P450酶的底物识别专一性问题,突破吡咯并吲哚生物碱结构多样性少的瓶颈。
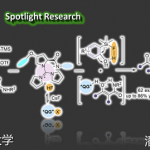
在本项研究中,联合课题组通过基因组挖掘和进化分析,首先发现了一例可识别底物cWLFL的新型二聚化酶NASAO。进一步通过序列和结构分析,发现了P450酶中的三个氨基酸位点(F387, F388和E73)对上方底物的选择性具有重要的调控作用。随后,通过对上述位点的突变改造,获得了四个突变体(F387A, F387G, F388N以及E73S),其可以识别并催化另外8个野生型酶不能识别的底物(cWLFL, cWLIL, cWLLL, 7Cl-cWLPL and 5/6/7/8F-cWLPL),生成12个底物自身二聚的吡咯并吲哚类生物碱(图1)。为了深入理解突变体的底物调控机制,联合课题组又解析了多个突变体的晶体结构,并通过分子动力学模拟(MD)分析阐明其动态调控机制,揭示了突变体F387G和E73S可分别通过减少空间位阻和调节底物通道来控制底物特异性。最后,通过将P450突变体转入至齿垢分枝杆菌,并交叉喂养两种不同的环二肽底物,实现了该类天然产物的集约式生物合成,产生了至少93种以上新结构交叉二聚的吡咯并吲哚生物碱产物。这部分工作不仅在获得的吡咯并吲哚生物碱数量上实现了大的飞跃(是此前已知的两倍之多),还为改造其他吡咯并吲哚P450偶联酶的底物选择性提供了重要思路,为后期深入探究该类天然产物的生物活性奠定了坚实的基础。
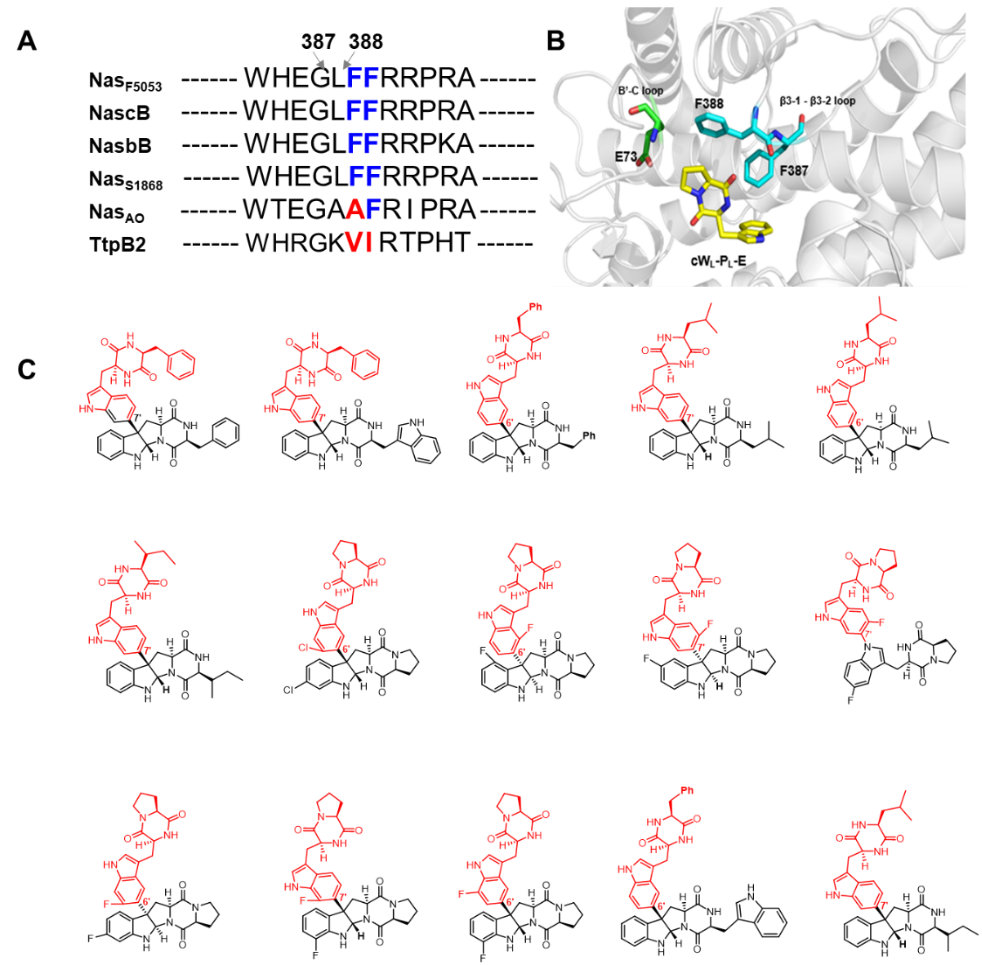
图 1. A)不同P450偶联酶的比对分析; B)偶联酶NasF5053 (PDB: 6VXV)的上方底物结合口袋中的关键氨基酸残基; C)获得的自身偶联的新结构吡咯并吲哚生物碱。
Q2. 有关本次研究的时候遇到过怎样的困难呢?又是怎样克服的呢
这项研究前期实验很顺利,包括酶的挖掘、改造、反应筛选以及产物的分离纯化都没有偏离我们最初的预期太多,在蛋白质结晶方面,由于这类P450结晶本身具有难度,加之疫情原因,我们花了大半年时间才拿到底物-突变蛋白复合物晶体结构,然而这些突变体的晶体结构与野生型蛋白具有近乎完全一致的构象,并不能直观的显示突变体具有不同底物选择性的分子基础,这有些偏离我们的预期。后面我们设法通过分子动力学模拟(MD)来解析调控机制,但是在这个过程中我们遇到了些困难,例如如何搭建P450酶不同催化步骤的模拟体系等,通过不断地学习和探索,我们最终发现突变体F387G和E73S可分别通过减少空间位阻和调节底物通道来控制底物特异性,特别是在得到E73S突变体的MD结果以后,我们在高兴之余也对酶促反应的精细调控过程有了更加深刻的认知。
Q3. 本次研究主体,有没有什么让您感觉特别辛苦和烧脑呢?
我觉得这项研究最累人的地方在于产物的分离纯化,放大每个反应时,需要先用化学合成方法合成足够量的底物,此外需要配置大量的培养基进行全细胞催化,最后要进行大量的萃取的实验,对于有些较容易分离的化合物可以直接过柱纯化,但是有些需要在液相上进行半制备,整个分离纯化过程比较耗体力,但是这个过程不怎么烧脑。烧脑的部分来自化合物的结果鉴定,由于这类生物碱相对较复杂且具有较多的手性中心,在确定其结构过程中需要整理大量的数据来确定每个信号的归属以及手性中心的构型,解谱有点像破案推理,虽然很烧脑但也很有趣。
Q4. 将来想继续研究化学的哪个方向呢?
未来的研究将基于生物催化、生物合成以及合成生物学等生物技术,实现对具有重要药用价值的天然产物以及手性分子的高效合成和改造。
Q5. 最后,有什么想对各位读者说的吗?
做科研,选准、选对方向,静下心来全力以赴就好。
作者教育背景简介

教育背景:
2016-2019 武汉大学 博士(导师:瞿旭东教授)
2019-2021 上海交通大学 博士后 (导师:邓子新院士 瞿旭东教授)
2021- University of Greifswald 博士后 (导师:Uwe. T. Bornscheuer)
相关介绍:
孙成海,2019年毕业于武汉大学,博士期间曾获“武汉大学学术创新二等奖”,随后进入上海交通大学并获得上海市“超级博士后激励计划”资助。目前在德国Greifswald大学Uwe. T. Bornscheuer教授课题组进行酶工程改造方向的研究。迄今以第一作者(含共同第一作者)身份在Nature Communications (2篇); Angew. Chem. Int. Ed.; The Journal of Organic Chemistry; Natural Product Report; Antiviral research等杂志上发表论文6篇。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载





















No comments yet.