作者:石油醚
本期热点研究,我们邀请到了本文第一作者,来自芝加哥大学的谢嘉欣博士为我们分享。
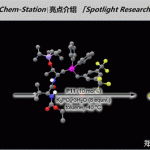
2023年2月17日,JACS在线发表了来自美国芝加哥大学董广彬教授课题组题为「Asymmetric Total Synthesis of (+)-Phainanoid A and Biological Evaluation of the Natural Product and Its Synthetic Analogues」的研究论文:文中详细阐述了董广彬教授团队对Phainanoids合成策略的设计演化和修正,特别是关键结构片段合成和骨架构建策略所进行的至关重要的系统性模型研究,由此成功发展了一系列过渡金属介导的反应策略实现了对Phainanoids中高张力的4,5―螺环骨架和 [4.3.1] 螺桨烷骨架的高效立体选择性构建。最后,通过对D/E/F三环中间体的动力学拆分和5,5―氧杂螺环内酯片段的对映选择性合成,实现了对Phainanoid A的首次不对称全合成,并确认了天然产物的绝对立体化学和免疫抑制生物活性。
“Asymmetric Total Synthesis of (+)-Phainanoid A and Biological Evaluation of the Natural Product and Its Synthetic Analogues
Jiaxin Xie, Zhong Zheng, Xin Liu, Nan Zhang, Shinyoung Choi, Chuan He, and Guangbin Dong*
J. Am. Chem. Soc. 2023, 145, 4828–4852. Doi:10.1021/jacs.2c13889”
Q1. 请对“Asymmetric Total Synthesis of (+)-Phainanoid A and Biological Evaluation of the Natural Product and Its Synthetic Analogues”作一个简单介绍。
Phainanoids是由中科院上海药物研究所岳建民院士团队从热带植物海南叶下珠(Phyllanthus hainanensis)中提取得到的一类达玛烷三萜(Dammarane-type triterpenoids)天然产物。这一家族天然产物高度复杂而独特的化学结构和优越的免疫抑制活性引起了合成化学界广泛的关注。2021年,我所在的芝加哥大学董广彬教授课题组率先实现和报道了对这一天然产物家族成员Phainanoid A的外消旋全合成。本次工作详细阐述了我们对Phainanoids合成策略的设计演化和修正,特别是关键结构片段合成和骨架构建策略所进行的至关重要的系统性模型研究,由此我们成功发展了一系列过渡金属介导的反应策略实现了对Phainanoids中高张力的4,5―螺环骨架和 [4.3.1] 螺桨烷骨架的高效立体选择性构建。通过对D/E/F三环中间体的动力学拆分和5,5―氧杂螺环内酯片段的对映选择性合成,我们最终实现了对Phainanoid A的首次不对称全合成,并确认了天然产物的绝对立体化学和免疫抑制生物活性。通过对天然产物、相关模型化合物和合成中间体的生物活性评估,我们建立了此类分子初步的构效关系,有望对设计结构简化的新型免疫抑制药物提供参考意见。
Q2.在研究的时候遇到过怎样的困难呢?又是怎样克服的呢?
天然产物全合成,尤其是针对高度复杂的天然产物,最大的困难一定是原料的快速高效大量制备,通俗地说就是“备料”,因为全合成研究的过程中前沿探索需要大量的原料,“备料”的速度就决定了实验进展的速度,所以我也把“备料”称为全合成的决速步。全合成研究中“此路不通”的现象是非常常见的,在有限的人力条件下,“备料”的困难也会被进一步放大。为了尽可能避免宝贵原料的浪费从而减小“备料”带来的困难,通过系统模型研究发展关键的合成策略就显得至关重要。因为模型化合物的结构极大简化,合成难度更小也更容易实现短时间内大量原料的制备。这项研究中最值得一提的是基于雌酮(estrone)的模型研究,其高度相关的化学结构却极大缩短的合成路线更快地帮助我解决了关键的半频哪醇重排扩环反应、HWE片段偶联反应和串联Heck/homoallylic elimination反应的条件优化。这些关键策略的模型和真实底物的策略转化研究几乎是平行完成的,对我们成功实现Phainanoid A的全合成起到了至关重要的作用。
Q3. 本次研究主体,有没有什么让您感觉特别辛苦和烧脑呢?
天然产物全合成最辛苦的永远是“备料”(笑),而烧脑的部分则主要体现在将模型研究的成果转化到真实底物中去。模型研究的最大缺陷就在于哪怕结构再接近再相似,模型化合物也不是真实底物,策略转化的过程中必然会遇到困难,其中最典型的就是4,5-螺环骨架和 [4.3.1] 螺桨烷骨架的构建部分。2017年我们在Organic Letters上发表和奠定了利用Pd/QPhos催化体系实现4,5―螺环骨架构建的核心策略,然而从最简单的单环模型底物(初始最优条件)到稍微复杂的三环模型底物(反应溶剂和温度进一步优化)再到拥有复杂官能团的三环真实底物(反应试剂和催化剂进一步优化),策略的转化都经历了大量的条件优化,而这些优化过程往往是非常烧脑的。类似的,[4.3.1] 螺桨烷骨架的构建也出现了模型化合物中最优条件在真实底物上效果极差的现象。通过实验结果的反复分析和思考,我才在大量文献检索后找到了隐藏在文献SI(Supporting Information)中的有效信息并成功用在了反应优化上最终实现合成目标。
Q4. 将来想继续研究化学的哪个方向呢?
活性天然产物或者药物小分子合成。有机合成就像拼图,我很享受这种从无到有创造的过程。
Q5. 最后,有什么想对各位读者说的吗?
科学研究是一项非常辛苦但也非常rewarding的工作,我们都渴望成功,但失败才是常态。保持平常心,坚持不懈,做自己喜欢的研究。多跨领域读文献扩展知识面,不要只局限在自己研究的小领域,特别感兴趣的文章也别忘记读读SI,可能有惊喜(笑)。
作者教育背景简介

教育背景:
2011-2015年就读于北京大学化学与分子工程学院,在杨震教授和陈家华教授的指导下从事复杂降三萜天然产物全合成研究。
2022年在董广彬教授的指导下于芝加哥大学获得博士学位,其间从事了Phainanoid家族天然产物的全合成研究工作。
2022年8月加入普林斯顿大学David MacMillan教授课题组从事光催化有机合成方法学的博士后研究。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载























No comments yet.