本次介绍的论文报道了与Prilezhaev环氧化类似机理的氮丙啶的合成法。本反应无需使用过度金属催化剂,使用该方法可以很容易的将烯烃特异性的转化为氮丙啶。
Prilezhaev环氧化与氮丙啶合成
环氧烷可以通过烯烃与过氧化物1进行Prilezhaev环氧化[1]制备(图1A)。另一方面、氮丙啶虽然从结构上还是反应性上都与环丙烷类似,然而使用同样的手法-烯烃的氮丙啶化反应(Aza-Prilezhaev反应)一般来说都需要使用过度金属催化剂。而且,反应机理也不同,是经由金属氮宾进行的反应[2]。另外,限制也很多,大多数例子都是产生氮原子上取代有吸电子基团的产物。另外,在不使用过渡金属催化剂的场合,就需要使用强的氧化剂,或者无法实现立体选择性等缺点[4]。
布里斯托大学的Bower教授等人最近报道了、通过将含有保护基团的羟胺衍生物2在反应体系中脱保护、生成强力的亲电子氨化试剂3。该氨化试剂3可以用于分子内脱芳香胺基化或者分子内C-H胺基化反应[5,6](图1B)。这次Bower教授等人、发现3的游离碱3’与过氧化物1结构类似、从而以此为契机,开发出了烯烃环丙胺化反应,成功合成了氮丙啶5、成功开发出了不使用金属催化剂的Aza-Prilezhaev反应方法(图1C)。
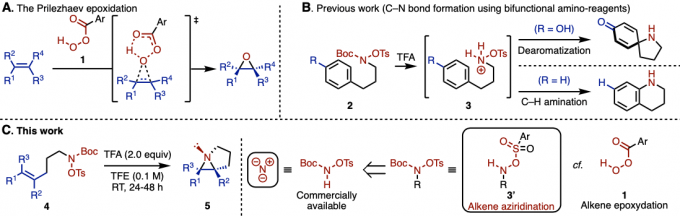
图1. (A) Prilezhaev环氧化 (B) 含有两种离去基团的胺的C-N成键反应 (C) 本论文的反应
“Stereospecific Alkene Aziridination Using a Bifunctional Amino-Reagent: An Aza-Prilezhaev Reaction”
Farndon, J. J.; Young, T. A.; Bower, J. F. J. Am. Chem. Soc.2018, 140, 17846.
DOI: 10.1021/jacs.8b10485
论文作者介绍

研究者:John F. Bower
1999–2003 MSci (Hons., 1st class), University of Bristol
2003–2007 PhD, University of Bristol (Prof. T. Gallagher)
2007–2008 Postdoctoral Associate, University of Texas at Austin (Prof. M. J. Krische)
2008–2010 Postdoctoral Associate, University of Oxford (Prof. T. J. Donohoe)
2010– Royal Society University Research Fellow, University of Bristol
2014–2015 Proleptic Lectureship, University of Bristol
2015–2016 Senior Research Fellow/Senior Lecturer, University of Bristol
2016–2017 Reader in Organic Chemistry, University of Bristol
2017– Professor of Chemistry, University of Bristol.
研究内容:手性催化剂、过度金属催化剂、杂环化学
论文概要
本反应使用2,2,2-三氟乙醇(TFE)为溶剂,烯烃4与三氟乙酸(TFA)在常温下进行分子内反应生成氮丙啶。虽然底物无论是二取代的烯烃,三取代的烯烃和四取代的烯烃,都可以进行该反应,但在缺乏电子的烯烃的底物4c的情况下不能得到氮丙啶5c(图2A)。另外该反应也适用于氮杂双环[4.1.0]环的形成和分子间反应(图2B)。
本反应具有非对映选择特异性,反式苯乙烯衍生物4a可以生成5a、顺式苯乙烯衍生物4b则生成5b、可以生成各自的单一非对映异构产物。此外在C1位与C3位含有取代基的4d与4e底物、也可以以高非对映选择性的生成5d与5e。
从实验结果可以看出,该反应的反应机理与Prilezhaev环氧化类似、通过Aza-Prilezhaev机理进行的(图2C)。也就是说,在离去叔丁氧基羰基后,通过从6到过渡态7的协同烯烃氮丙啶化反应形成5。
综上所述、Aza-Prilezhaev机理进行的、无需使用金属催化剂的新型分子内氮丙啶化反应被开发并报道。从合成容易的底物出发,只需要与TFA反应即可立体特异性的生成氮丙啶,该反应有望可以适用于对过度金属催化剂不稳定的底物,并且可以拓展到分子间反应等应用。
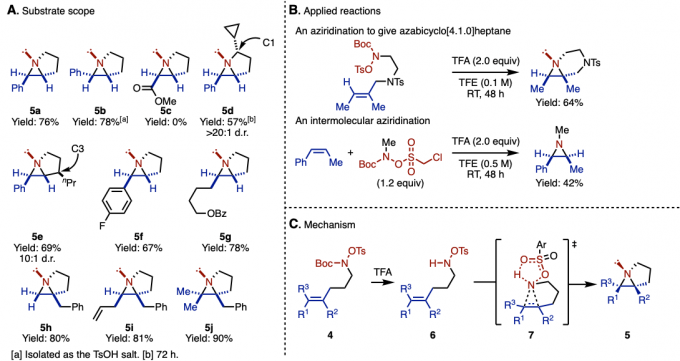
图2. (A) 底物适用范围 (B) 应用实例 (C) 反应机理
参考文献
- Jørgensen, K. A. Chem.Rev. 1989, 89, 431. DOI: 1021/cr00093a001
- Degennaro, L.; Trinchera, P.; Luisi, R. Chem. Rev. 2014, 114, 7881. DOI: 1021/cr400553c
- Jat, J. L.; Paudyal, M. P.; Gao, H.; Xu, Q.-L.; Yousufuddin, M.; Devarajan, D.; Ess, D. H.; Kürti, L.; Falck, J. R. Science 2014, 343, 61. DOI: 1126/science.1245727
- Watson, I. D. G.; Yu, L.; Yudin, A. K. Acc. Chem.Res. 2006, 39, 194. DOI: 1021/ar050038m
- Farndon, J. J.; Ma, X.; Bower, J. F. J. Am.Chem. Soc. 2017, 139, 14005. DOI: 1021/jacs.7b07830
- Paudyal, M. P.; Adebesin, A. M.; Burt, S. R.; Ess, D. H.; Ma, Z.; Kürti, L.; Falck, J. R. Science 2016, 353, 1144. DOI: 1126/science.aaf8713
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.