译自Chem-Station网站日本版 原文链接:【誤解してない?】4s軌道はいつも3d軌道より低いわけではない
翻译:炸鸡 校对:Jiao Jiao
在元素周期表Ar元素往后,就进入第三周期元素了。Ar的基态电子组态为[Ne]3s23p6(为Ar元素完整组态1s22s22p23s23p6的简写),但Ar后一个元素K的基态电子组态却为[Ar]4s1,Ca为[Ar]4s2,Sc才为[Ar]3d14s2,从Sc(钪)开始到Zn结束的第三周期元素的基态电子组态均为(3d)n(4s)2 的形式,电子优先占据4s轨道而不是3d轨道,填充完4s轨道后,再填充3d轨道。但这样的组态方式并不意味着在这些元素中3d轨道的能量更高。原子的基态电子组态并不只是由轨道的能量决定,电子间的排斥作用也发挥了影响。本篇文章就来通过讲解决定原子的电子组态的原理一解大家常有的误解。
围绕电子组态的常有误解
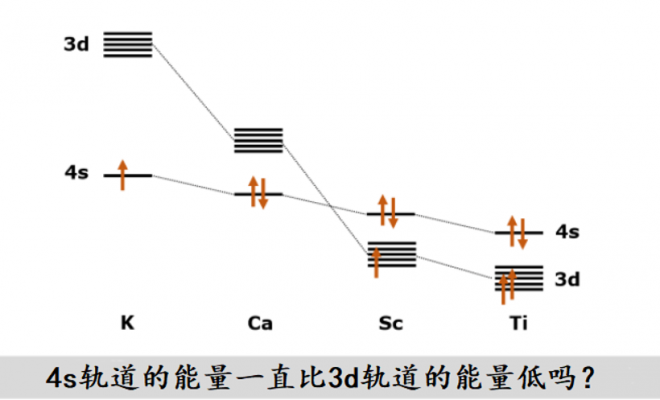
物理化学和无机化学教材里写道:电子占据原子轨道的顺序为1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p,……。不少人会误以为因为电子是从能量低的原子轨道开始占据,所以4s轨道的能量比3d轨道的能量低。
这个想法包含了两个认识误区。一,电子并不绝对是从能量低的轨道开始占据的。二,对于过渡元素(元素周期表中d区中除Zn和Cd(镉)以外的金属元素,以及f区元素)而言,ns轨道的能量比 (n-1)d轨道的能量更高。下面就这两个认识误区进行详细解释。
3d轨道和4s轨道的能量
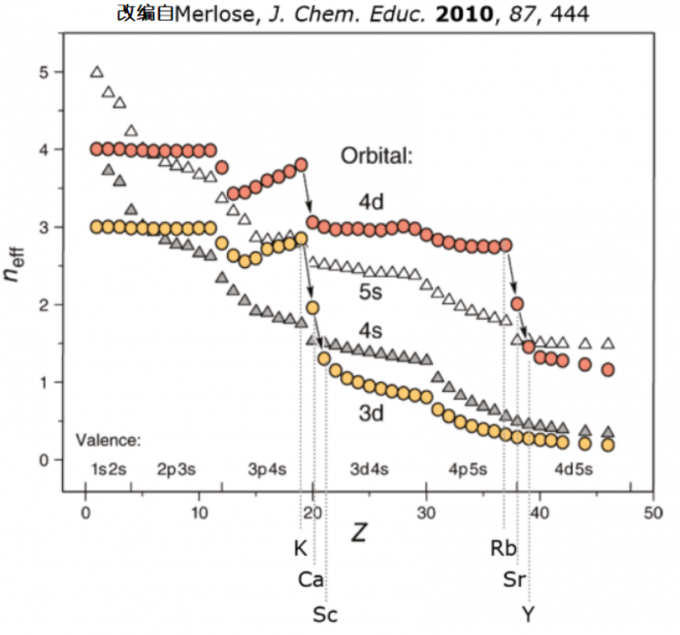
证据之一就是光谱学实验和计算表明的轨道能量图。
图1. 轨道能量与原子序数Z的关系图。3d轨道的能量(黄色)随着K-Ca-Sc的元素转变而急剧下降。纵轴的neff表示有效量子数neff,neff与轨道能量的绝对值ε成反比(neff越小,轨道的能量值越小)。图引用自文献1。
让我们把目光聚焦到黄色圆圈表示的3d轨道能量和灰色三角表示的4s轨道能量上。的确,在K和Ca中,3d轨道的能量高于4s轨道的能量。因此对于K和Ga而言,电子优先占据4s轨道而不是3d轨道的原因可以说是3d轨道的能量比4s轨道高。
然而,从图上可以显著地看到:3d轨道的能量随着从元素从K向Ca过渡而有着显著稳定的趋势,其稳定程度大于4s轨道变化。当元素过渡到Sc时,3d轨道的能量低于4s轨道4。4d轨道的能量与5s轨道的能量差距的变化趋势和3d轨道与4s轨道的能量差距的变化趋势相似。在第五周期的s区元素Rb(铷)和Sr(锶)中,4d轨道的能量高于5s轨道。然而,随着原子序数的增加,4d轨道的能量趋于稳定,到了元素Y(钇)中,4d轨道的能量已经低于5s轨道的能量了。在过渡元素中,(n-1)d轨道的能量是低于ns轨道的能量的。
電子电子组态并不是完全由轨道能量决定
解释清楚了d轨道和s轨道能量的高低变化问题,又一个新问题出现了:如果在过渡金属中(n-1)d轨道的能量低于ns轨道,那么为什么Sc的基态电子组态不是3d3而是3d14s2?
Sc的基态电子组态仿佛暗示我们电子优先填充的是4s轨道而非3d轨道,难道4s轨道的能量比3d轨道的能量还要低不成?
答案是:电子组态不仅仅取决于每个轨道的能量还取决于整个系统的能量,填充轨道时需要考虑到电子间排斥等相互作用。
这个回答具体来说:多电子原子的能量并不是单纯地每个有电子占据的轨道的能量的总和,要使得整个多电子原子的能量最低,还需要考虑电子之间的排斥力。
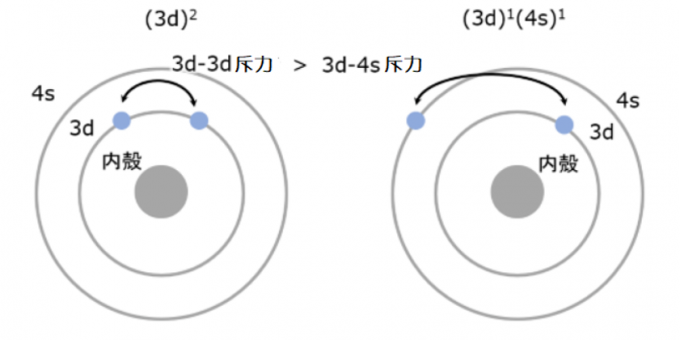
那么回到Sc的基态电子组态,当上一个电子已经填充进3d轨道后,下一个电子该何去何从呢?是继续填充进3d轨道还是转而填充进4s轨道呢?同轨道的两个电子之间的排斥力和异轨道两个电子的排斥力有什么不同?
图2. 两个电子间排斥力示意图。因为3d轨道比4s轨道的内径小,所以同处于3d轨道内的两个电子之间的排斥力要大于3d-4s的两个电子之间的排斥力
3d轨道的主量子数比4s轨道要小,所以较4s轨道更紧凑。同在3d轨道上的两个电子之间的平均距离比一个在3d一个在4s上的距离要小,所以同在3d轨道上的两个电子之间的静电排斥力会大一些。结果就是尽管3d轨道是能量低的那一个轨道,但出于维系整体能量最小的考虑,把一个电子安排进能量较高的4s轨道让两个电子之间的静电排斥力减小的做法更合适。如果这时再来一个电子填充进4s轨道,那么4s轨道就有2个电子了,这两个电子间的斥力是小于3d-4s之间的斥力,因此,将电子放置在4s轨道上是减少原子电子间排斥力的一个很好的策略。
以上的解释就能回答为什么3d系金属元素(第三周期的d区元素)会优先填充4s轨道。要切记3d系金属元素优先占据4s轨道的原因和K,Ga优先占领4s轨道的原因截然不同。在上文的图1里,K和Ga中,4s轨道的能量是比3d轨道低的,所以电子会优先填充4s轨道。
非中性原子的电子组态
以上讨论的一直是中性原子在真空状态下的电子组态。接下来,我们将话题转到关于离子或有化学键的金属原子的电子组态的问题上。
过渡金属阳离子为什么没有s电子
大多数过渡金属在中性条件下具有(n-1)dm-2 ns2(n代表周期,m代表族)的电子组态,但当电离时,具有(n-1)dm-x(x代表氧化数)的电子组态。例如,第10族3d系金属Ni(镍)在中性真空下的电子组态为(3d)8(4s)2,它在真空下的二价阳离子的电子组态为(3d)8。或许照着“因为3d系金属里,4s轨道的能量无疑是较高的那个,所以在3d系的离子里,失去的是4s轨道上的电子而非3d轨道上的电子”的理解方式去理解也说得通。不过,我们也要考虑到轨道能量实际上是随着电离而变化的,过渡金属离子的电子组态实际上相当复杂。
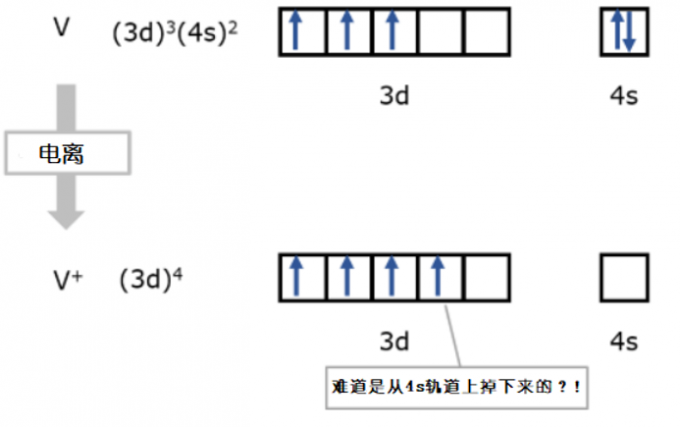
例如,第五族3d系金属V(钒)在中性真空下的基态电子组态为(3d)3(4s)2。然而,失去一个电子的阳离子V+在真空下的基态电子组态却为(3d)4。看到这里,我们就会有一种错觉,好像只是从中性V原子中脱落了一个4s电子,4s轨道上留下的另一个电子就落到了3d轨道上。
图3. 真空下的金属V原子和正一价的V+离子的电子组态的比较。V原子的4s轨道有2个电子。V原子失去一个电子后,4s轨道上残存的另一个电子彷佛“掉落”到了3d轨道上,V+离子的电子组态为(3d)4
要想弄清过渡金属阳离子的电子组态为什么会这样变化,就要明白伴随着离子化3d轨道和4s轨道的能量关系会有什么变化。因为4s轨道呈包围原子核的球形,所以4s轨道上的电子会屏蔽一部分核电荷。离子化时,4s轨道上的一个电子脱除,4s轨道上的电子对核电荷的屏蔽作用也就减弱,又因为3d轨道较4s轨道离原子核更近,3s轨道上的电子也就收到了更强烈的原子核吸引力(即原子核的有效核电荷增加了),3d轨道上的电子也就更加难以移走,3d轨道上的电子也就更稳定3d轨道的能量也就越低。这造成一个结果:当初为了减少电子间相互排斥而把一部分电子转移到4s轨道上,但是伴随着离子化,3d轨道的能量降低了,把全部电子“搬到”3d轨道上于维持整体系统的能量稳定来说是更划算的做法。过渡金属原子中3d和4s轨道的能量以及它们之间的电子排斥之间的权衡是相当微妙的。
0价配合物为何s轨道不能容纳电子
在计算零价氧化金属配合物的d电子数时,往往不认为s轨道中有电子,而是假定所有价电子都容纳在d轨道中。例如,当计算Cr(CO)6的Cr的电子数时,认定为3d6,而不是3d44s2。为什么呢?
不知道读者有没有发现,在前文中提到电子组态,都是指在在“真空”下的电子组态,当我们涉及到化学键的时候,事情又不一样了。4s轨道比3d轨道能量更高,离核更远。如果Cr周围存在配体,4s电子会受到配体电子的较大排斥力。因此,将电子放置在4s轨道上的优势不再存在,在形成化学键的3d金属原子中,价电子存在于3d轨道上。
参考文献与备注
- 遷移金属の電子配置に関する詳細な文献: Schwarz, W. H. E. “The Full Story of the Electronic Configurations of the Transition Metals” Chem. Educ. 2010, 87, 444. DOI: 10.1021/ed8001286
- Wang, S.-G.; Schwarz, W. H. E. “Icon of Chemistry: The Periodic System of Chemical Elements in the New Century” Chem. Int.Ed. 2009, 48. 3404. DOI: 10.1002/anie.200800827
- 比較的詳細に “なぜ 4s 軌道が 3d 軌道よりも先に占有されるか” を説明した文献: Melrose, M. P. Scerrl, E. R. “Why the 4s Orbital Is Occupied before the 3d” Chem. Educ. 1996, 73, 498. DOI: 10.1021/ed073p498
- 3d轨道与4s轨道能量的差异变化与原子序数的关系涉及很多复杂的效应,如内壳电子对屏蔽效率的差异,离心力对角动量的关系等。
必须注意的是,“轨道能量”最初是在多电子系统中基于独立粒子产生的近似概念。3d轨道和4s轨道原本也是以氢原子为模型的薛定谔方程的两个解。其他原子的薛定谔方程无法解出,所以借用氢原子的解(即轨道函数),将电子填充进去。在Koopmans定理下确定了轨道能量,即“如果一个原子失去了一个电子,而其他电子的条件不变,那么此时的电离能量可以认为是失去的电子的轨道的能量”。但实际上随着电离,残余电子的状态应当也在发生变化,多电子原子中的一个电子的能量是单独计算出来的。这篇文章写到“3d轨道在能量上低于4s电子”的意思是“3d电子的电离能量高于4s电子”。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载




















No comments yet.