译自Chem-Station网站日本版 原文链接:【金はなぜ金色なの?】 相対論効果 Relativistic Effects
翻译:炸鸡 校对:Jiao Jiao
相对论是描述以接近光速运动的物体展现出的一系列现象的理论。对于成天和电子﹑原子等微粒打交道的化学人来说,相对论会比较陌生。但是“相对论效应”却悄无声息地存在于人们身边,无论是不是和化学打交道的人。举个身边的例子好了,你有没有想过水银为什么是液体,金为什么是金色的?这都是因为相对论效应。我们大学化学学到的惰性电子对效应也是源自相对论效应,镧系收缩的一部分也是相对论效应造成的。本文将讨论相对论效应的起源,以及相对论效应赋予化合物什么性质。
相对论效应的起源
根据相对论,以接近光速运动的物体的质量m与这个物体静止时的质量m0成正比。
原子序数越大的原子它的核电荷数就越大,那么最内层的电子轨道1s上的电子受到来自原子核的吸引力就越大。这就造成了一个后果:那些原子序数大的原子的1s电子的运动速度接近光速。参照简单的玻尔原子模型,氢原子型原子(即原子核外围只有一个电子的原子或离子)的电子速度与原子序数Z成正比例。在氢原子(Z=1)的情况下,电子的速度约为光速的1/137,而在汞(Z=80)的情况下,电子的速度相当于光速的80/137≈ 58%。因此对于汞原子而言,由相对论效应产生的1s电子质量的增加就不可忽略了。
那么当电子的质量增加了,电子所在的轨道的半径就不可避免地也要发生改变。还是参照玻尔分子模型,氢原子型原子(即原子核外围只有一个电子的原子或离子)的电子轨道表达式如下,电子质量处于分母的位置。很容易就能看出随着电子质量增加,1s轨道的半径会缩小。
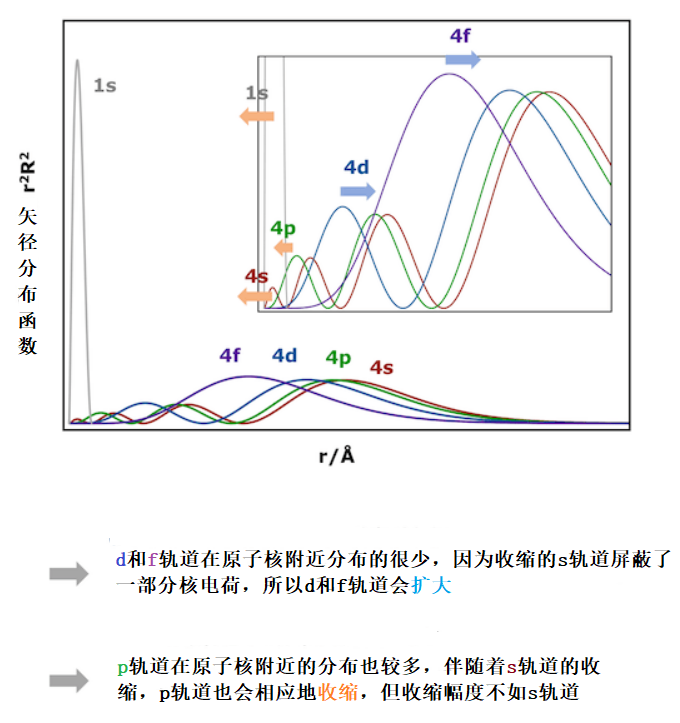
当然,1s轨道的收缩并不只是单纯影响1s轨道。因为原子的各个轨道都是正交的,一旦1s轨道的半径发生变化,其余的电子轨道为了仍能保持正交,2s,3s,4s…轨道纷纷也会缩小。但是p,d,f轨道会怎么变化呢?首先,p轨道会收缩,但是因为角动量和离心力的存在,原子核附近的矢径分布比s轨道要稍微小一点,不会像s轨道那样收缩。d和f轨道受到离心力的影响,原子核附近的矢径分布会变得更加小,再加上本就已经缩小了的s轨道使得d和f轨道受到核电荷屏蔽效应。因此d轨道和f轨道因为相对论效应,矢径分布会扩大,同时从能量上也会更不稳定。
1s 轨道和 4s, 4p, 4d, 以及4f 轨道的矢径分布函数。1s轨道收缩后其他轨道为了仍能保持正交性也会相应地收缩或扩张。图中橘色的箭头表示轨道收缩,蓝色箭头表示轨道扩张。
好!接下来就是揭开谜底的时刻!
在原子序数偏大的原子中,1s 轨道上的电子的运动速度堪比光速,根据相对论效应,电子的质量会变大,进而导致1s轨道收缩。
为了保持轨道的正交性,1s轨道的收缩伴随着s,p,轨道的缩小,d,f轨道的扩大。
由原子序数大的原子的s,p轨道的稳定(收缩)和d,f轨道的不稳定(扩大)引起的现象都被称为相对论效应。此外,所谓的自旋-轨道相互作用也是相对论效应的结果。因此,更严谨地说,p轨道的收缩和d/f轨道的扩张也依赖于电子的自旋,当电子的自旋和轨道的角动量平行时,轨道会收缩或扩大地更厉害。
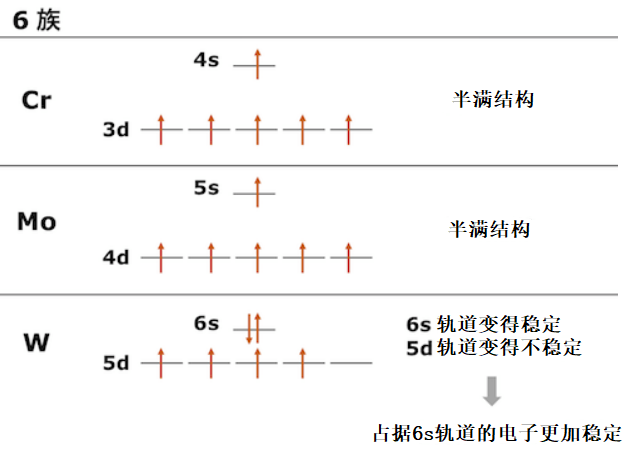
电子排布
第6族的Cr和Mo具有半满d轨道的((n-1)d)5(ns)1 稳定的电子构型。然而,作为第三过渡金属的W打破了d轨道半满的情况,采用了(5d)4(6s)2的电子构型。这是由于相对论效应导致d轨道不稳定,s轨道稳定,因此在s轨道上放置两个电子比放进d轨道形成半满结构更加稳定。
与第二周期金属相比,第三周期金属也更容易采取dns2配置。
惰性电子对效应
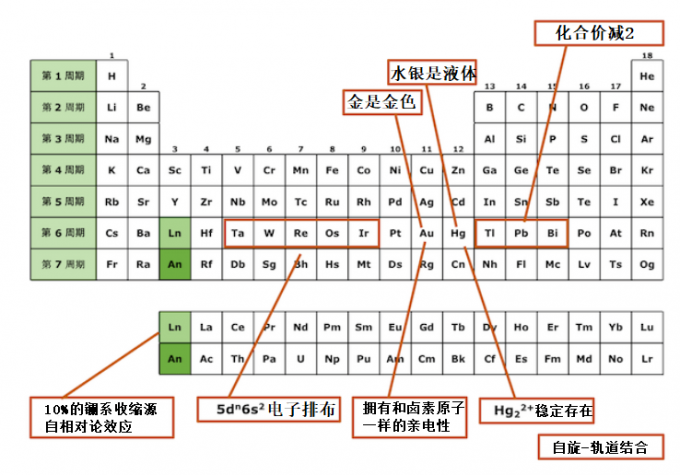
含有重原子的化合物的化合价比同族轻原子的化合物要小2。这是由于价电子的s轨道更稳定,夺取s电子的电离能变高。
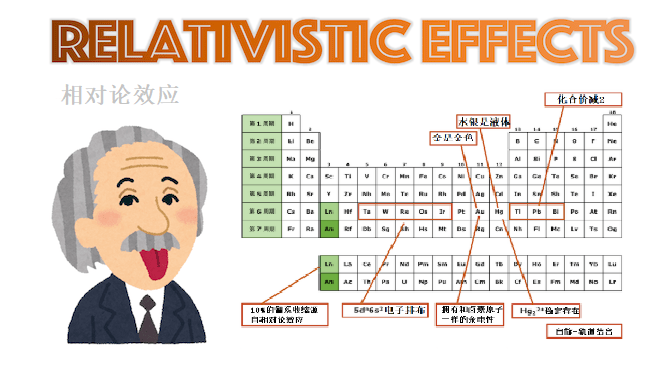
金是金色 银是银色
相对论效应导致金原子的5d轨道不稳定,6s轨道趋于稳定。因此,5d能带到6s能带(严谨来说是费米能级)的跃迁能量对应于可见光区域的蓝色。这种吸收使金呈现金色。
对银而言相对论效应不是很强,所以4d能带→5s能带的跃迁对应紫外区。因此,银不吸收可见光,表现出无色(银色),具有一般的金属光泽。
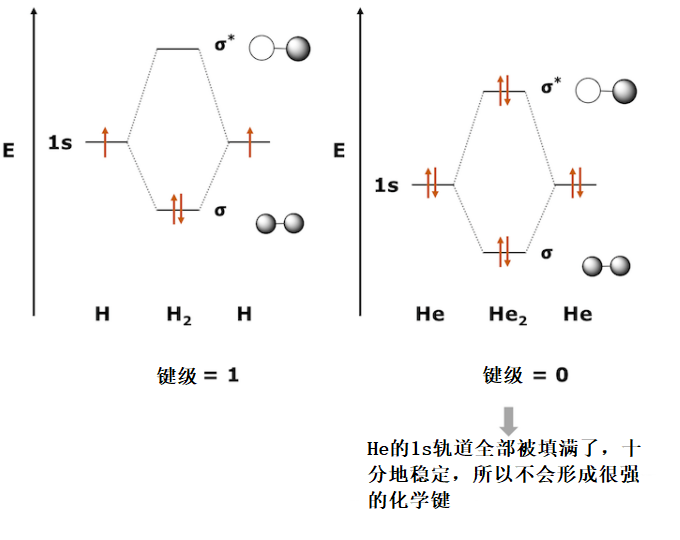
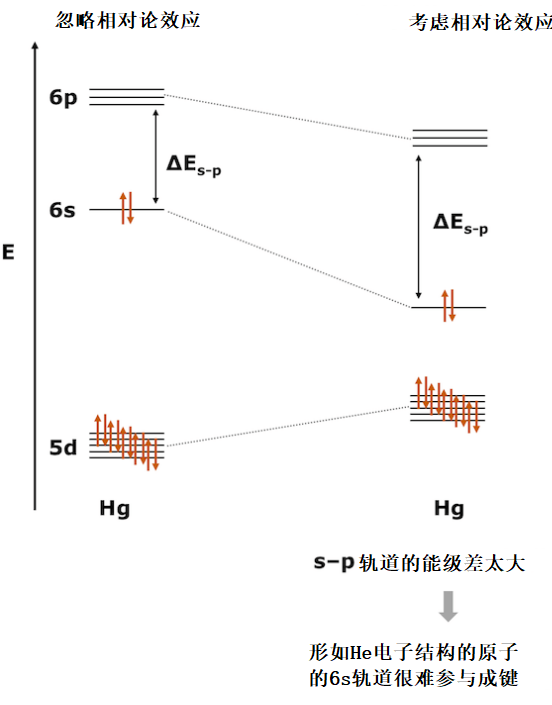
水银常温状态下是液体
为什么水银常温下是液体呢?这里需要先思考H2分子和He2分子。 H2分子在键合σ轨道中容纳两个电子,键级为1,因此分子十分稳定。而在He2分子中,反键合σ*轨道也不得不容纳两个电子,键级为0。也没有可用于杂化的p轨道。这使He2分子成为非常不稳定的分子。事实上,He作为单原子分子是稳定存在的。
水银Hg有两个稳定的6s电子。6p轨道也因为相对论效应产生收缩,但没有6s轨道收缩的那么厉害,所以6s轨道和6p轨道的能量差会大一点。因此,我们可以认为Hg拥有与没有p轨道的He相似的电子结构。因此,6s轨道很少参与Hg-Hg之间的成键,Hg-Hg键变得非常弱。这导致了汞的融点很低,在常温下呈现液体状态。
Hg22+离子
通过上文中的说明我们可以知道Hg2分子难以形成,但[Hg2]2+却在溶液和化合物中稳定存在。例如,汞形成Cl-Hg-Hg-Cl等稳定的线性分子,其中就有[Hg2]2+的化合物。这种双原子分子离子是汞的一种特殊性质,是其他金属所不具备的。这是因为(1)由于6s轨道和6p轨道之间的能量差较大,难以形成spn杂化轨道(sp2和sp3),并且(2)由于6s轨道和5d轨道之间的能量差相对较小,sdz2混合轨道相对较容易形成。
总结
最后用元素周期表来总结下今天所介绍的相对论效应吧。
参考文献
- 網羅的なレビュー: Pyykkö, P. Rev. 1988, 88, 563. DOI: 10.1021/cr00085a006
- 比較的短い読み物: Norbby, L. J. Chem. Educ. 1991, 68, 110. DOI: 10.1021/ed068p110
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


























No comments yet.