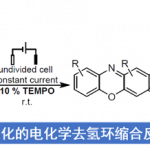
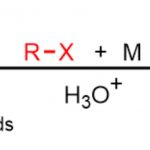
本次介绍的文章报道了氨基甲酸异戊酯/脲与芳基重氮盐的环氨基重氮化反应。本反应中使用易于获得并且可以长期储存的重氮盐用作反应引发剂和自由基清除剂。
氨基甲酸酯/脲的环化反应
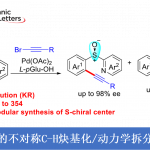
含有烯丙醇或烯丙胺的烯烃的胺基化,从原料易得且大量存在的观点出发、是一种广泛用于合成多官能脂族化合物的方法。其中,已经有许多关于含有烯丙基的氨基甲酸酯或脲的分子内环化形成C-N键的反应的报道。例如,很早以前对于C-N键形成,就有诸如通过卤鎓中间体的氨基卤化和使用钯催化剂的氨基甲酰化等实例报道[1]。近年来,通过改变自由基清除剂可以自在的导入官能团,而通过氨基甲酸酯/脲形成的自由基中间体进行的反应方法学开发受到关注 (图1A)。
2000年,Nicolaou等人、使用2-碘代苯甲酸(IBX)报告了加氢胺化反应[2]。接着在2013年,Li等人、使用银催化剂与Selectfluor®开发出了环氨基氟化反应[3]。然而,使用这些酰胺自由基作为驱动力的环化反应中使用的所有试剂都是非常昂贵的,而且,反应时间长也是一个需要改善的地方。作为解决这些问题的方法,Knowles等人在2015年使用可见光氧化还原催化剂和弱碱通过质子共轭电子转移(PCET)生成酰胺自由基,成功进行了环化反应构建C-N键[4]。
这一次,布里斯托尔大学的Clayden教授和等人,成功开发了以异戊烯氨基甲酸酯/脲为底物,通过使用芳基重氮盐作为自由基清除剂,通过酰胺基自由基中间体进行的环氨基重氮化反应(图1B)。该反应使用富电子的异戊烯氨基甲酸酯/脲与缺电子的重氮盐的组合进行的,无需光催化剂参与。
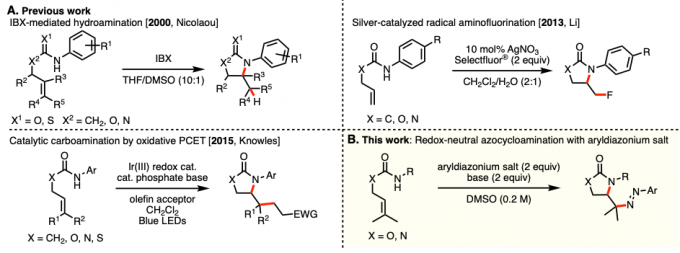
图1. 氨基甲酸酯或脲的分子内环化反应
“Transition Metal-Free Cycloamination of Prenyl Carbamates and Ureas Promoted by Aryldiazonium Salts”
Abrams, R.; Lefebvre, Q.; Clayden, J. Angew. Chem., Int. Ed. 2018,57, 13587.
论文作者介绍

研究者:Jonathan Clayden
经历:
1986-1989 B.A., Churchill College, University of Cambridge
1989-1992 Ph.D., University of Cambridge (Prof. Stuart Warren)
1992-1994 Posdoc, École Normale Supérieure (Prof. Marc Julia)
1994-2000 Lecturer in Chemistry, University of Manchester
2000-2001 Reader in Chemistry, University of Manchester
2001-2015 Professor in Organic Chemistry, University of Manchester
2015- Professor of Chemistry, University of Bristol
研究内容:新型阻转异构体的合成、反应开发、生物活性物质的合成
论文概要
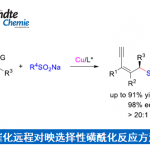
本反应、以DMSO为溶剂,在NaPO2(OBu)2存在下、O-异戊烯基氨基甲酸酯或N-异戊烯基脲(1)与p–三氟甲基苯基重氮盐(2)在室温下反应30分钟、以高产率得到了环化体。本反应对脲的氮原子上含有烷基或者含有苯环的底物都适用(图2Aa)。
另外,对于在异戊烯基部分具有各种烷基的底物,反应也能进行(图2Ab)。通过使用循环伏安法的各种对照实验和机理阐明研究的结果,了解到重氮盐在碱NaPO2(OBu)2存在下,短时间从2分解为2*是反应的引发阶段。本反应推测的机理如下 1) 2的分解形成苯基自由基2*、2) 碱存在下、氨基甲酸酯/脲1形成酰胺自由基4、3) 对烯烃进行自由基环化加成、4) 自由基被2捕捉、5) 碱存在下,5与另外一分子的1形成3的同时使得4再生(图2B)。
综上,作者使用重氮盐,开发出了异戊烯氨基甲酸酯/脲的环氨基重氮化反应。本反应的特点是有趣的是,不使用金属催化剂的情况下进行的”redox-neutral”反应。
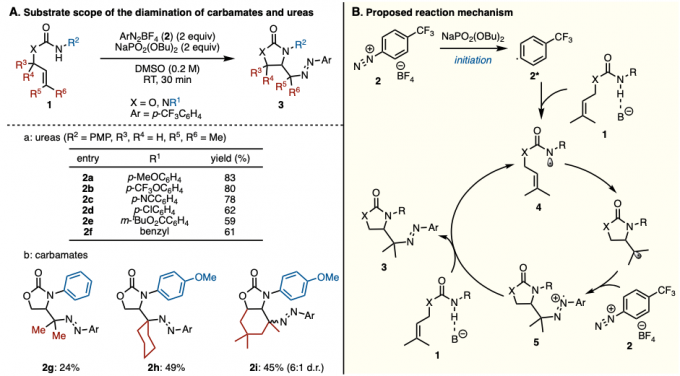
图2. (A) 底物适用范围 (B) 推定的反应机理
参考文献
- (a)Balko, T. W.; Brinkmeyer, R. S.; Terando, N. H. Tetrahedron Lett.1989, 30, DOI: 10.1016/S0040-4039(01)93707-4 (b) Tamaru, Y.; Hojo, M.; Higashimura, H.; Yoshida, Z.-I. J. Am. Chem. Soc. 1988,110, 3994. DOI: 10.1021/ja00220a044
- Nicolaou, K. C.; Zhong, Y.-L.; Baran, P. S. Angew. Chem., Int. Ed. 2000, 39, 625. DOI: 10.1002/(SICI)1521-3773(20000204)39:3<625::AID-ANIE625>3.0.CO;2-#
- Li, Z.; Song, L.; Li, C. J. Am. Chem. Soc.2013, 135, 4640. DOI: 10.1021/ja400124t
- Choi, G. J.; Knowles, R. R. J. Am. Chem. Soc. 2015, 137, 9226. DOI: 10.1021/jacs.5b05377
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















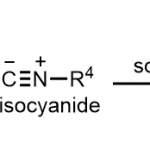
No comments yet.