接上篇
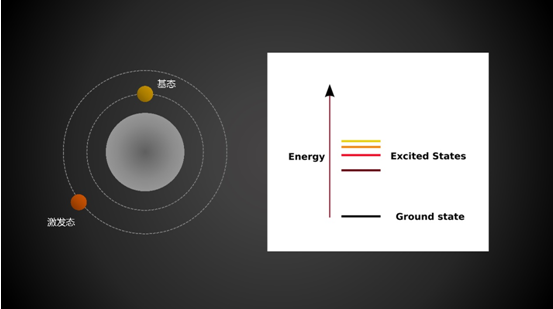
原子与化合物通常所处的低能稳定状态,称为基态;而能量高于基态的能量状态称为激发态。对于原子来说,元素周期表上的价电子排布即为基态,电子由能量较低的轨道激发到能量较高的轨道,即为激发态。
关于激发态和基态的关系,小编觉得知乎上的一个说法惟妙惟肖。
若要表示激发态,右上角挂星就好,分子A吸收光达到激发态,表示为
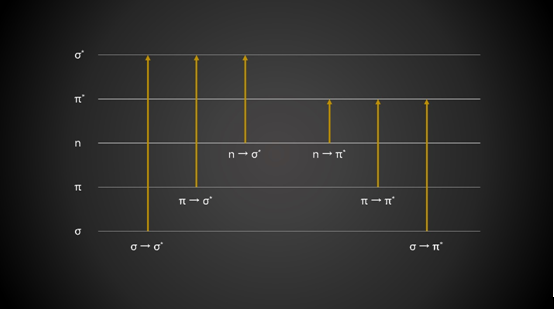
跃迁跃迁则用下图表示,挂星的表示反键
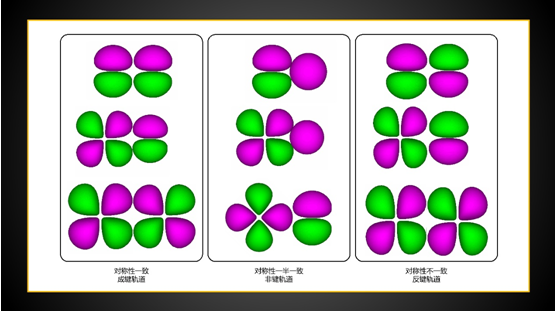
σ、π为成键轨道,σ*、π*为反键轨道,n为非键轨道。
激发态的表示方法整理如下:
分子从基态变为激发态,性质会有很大不同,总结如下:
- 能量
激发态分子与基态之间的能差一般可达几百kJ/mol,这比将基态分子加热到高温所增加的能量多得多。内能增加,则其化学性质更为活泼。
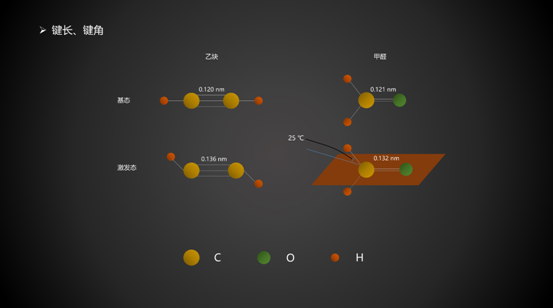
2. 键长、键角
与基态相比,激发态分子键长增加,键能降低,化学键变弱,使得化学反应的发生更容易。键角也有改变。以乙炔为例,基态时,所有原子排列成一条直线;激发态时,两个H原子成反式构型。从能量角度考虑,基态时直线能量最低;激发态时反式构型能量最低。
3. 电子构型
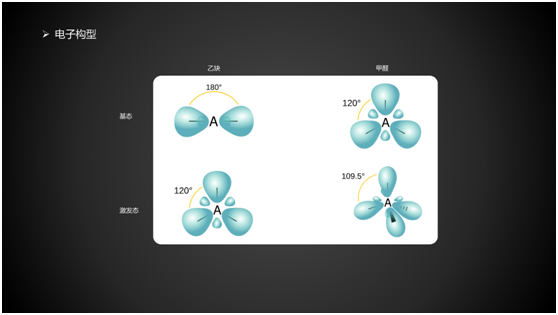
图片来自维基百科 Orbital Hybridisation 经加工
4. 分子极性
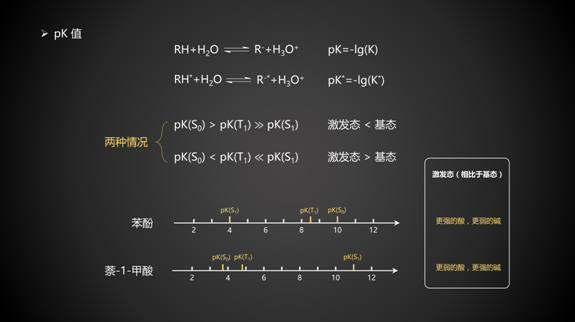
5. pK值
激发态的分子,酸碱性也会发生改变。举例如下:
6. 氧化还原电位
以亚甲蓝和Fe2+的反应为例,亚甲蓝为电子受体,Fe2+为电子给体。基态时亚甲蓝的电子亲和力比给体低,反应的吉布斯自由能△G>0,反应不能自发进行。而在激发态时,反应则能够进行。
7. 电离势,电子亲和能
分子由基态到激发态,电离势降低,电子亲和能增加。电离势降低,则更容易失去电子,可作为电子给体;电子亲和能增加,更容易获得电子,可作为电子受体。
8. 前线轨道,对称性
分子被激发后,HOMO和LUMO的位置发生颠倒,激发后新行程的前线轨道都只有一个电子占据。既可以给电子,也可以得电子,正所谓进可攻退可守。中学告诉我们,化学反应的实质,是旧物质的消失,和新物质的产生;是旧的化学键的断裂和新的化学键的产生。大学告诉我们,化学反应的实质就是电子在各种分子轨道中移动和充填的过程。
该过程不仅与电子所处轨道的能量有关外,而且与该轨道的对称性有关。这牵扯到两个诺奖成果——前线轨道理论和分子轨道对称性理论。以后再详细论述。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



























No comments yet.