一、引言
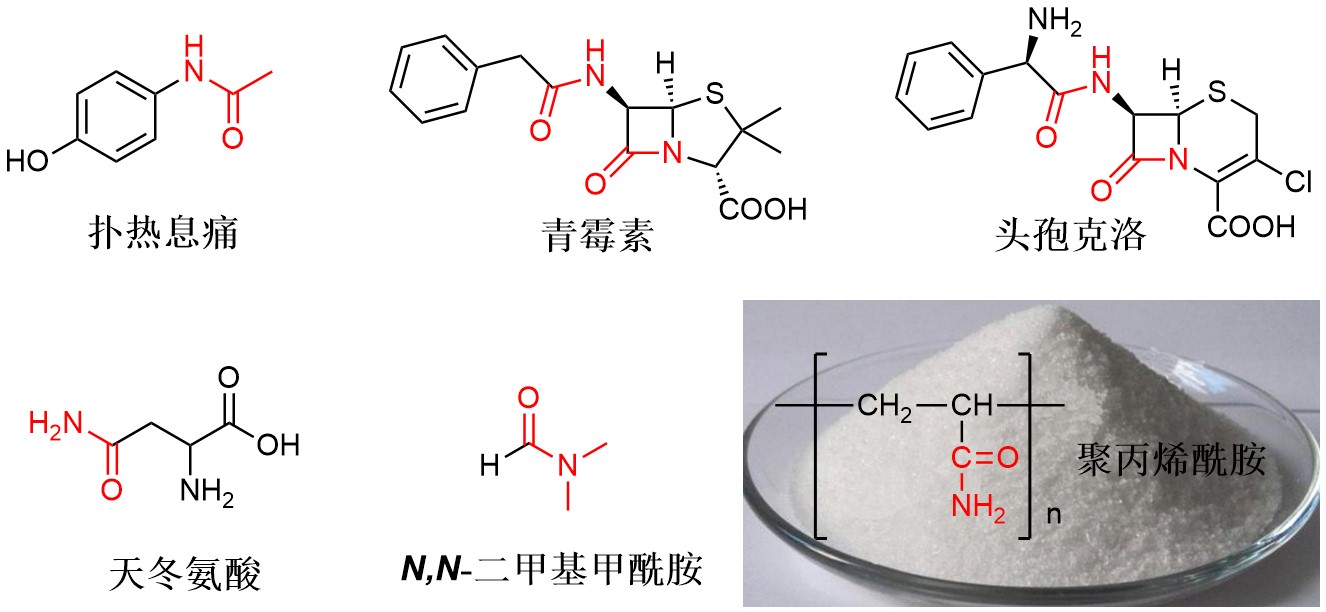
酰胺(Amides)是一类重要的羧酸衍生物,广泛存在于药物、氨基酸、蛋白质等分子中,此外酰胺类化合物还是良好的溶剂以及聚合物单体,在人类生产生活中发挥重要用途。鉴于此,许多合成酰胺的方法被报道并成为基础且重要的有机化学反应,例如经典的Beckmann重排、Passerini反应、Ugi反应等。
图 1 广泛存在的酰胺类化合物
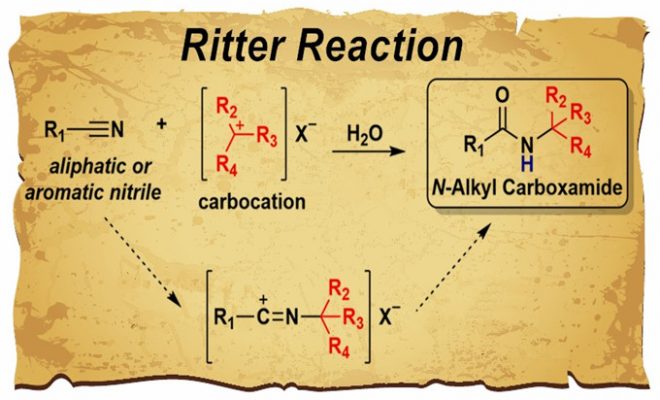
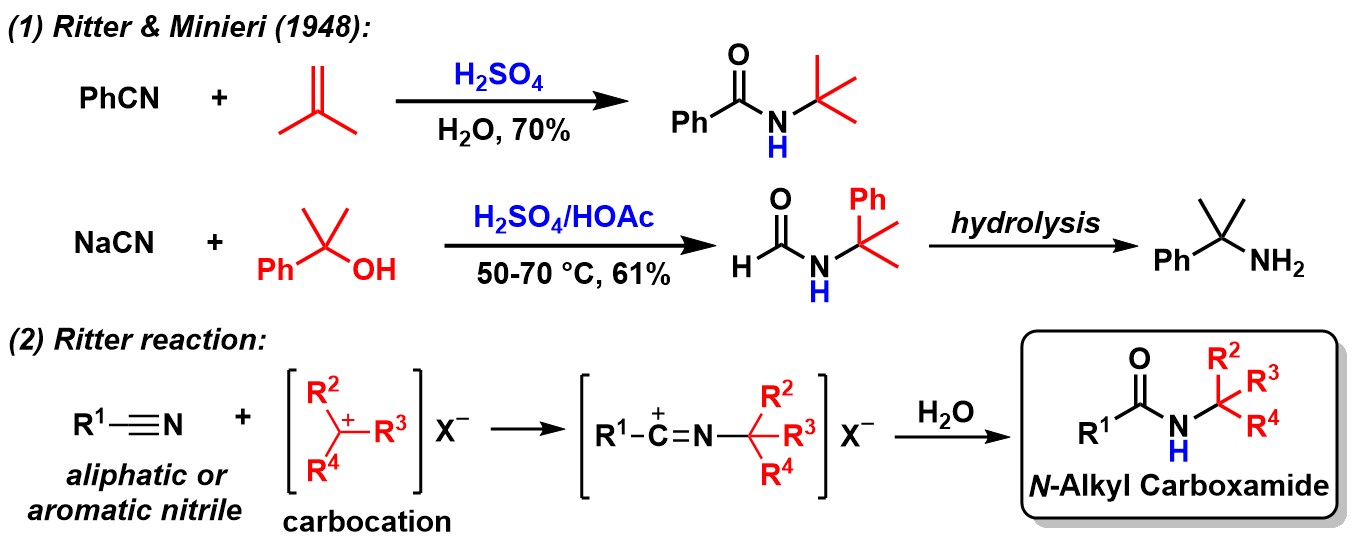
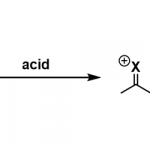
鉴于腈类化合物和烯烃都是廉价且丰富的基础化工原料,由它们合成价值更高的酰胺类化合物具有巨大的优势和广阔的应用前景。1948年,Ritter和Minieri发现腈类化合物在酸性条件下可与烯烃或叔醇形成酰胺产物,如果腈类化合物换成HCN形成的甲酰胺化合物会进一步水解最终得到烷基胺产物[1]。后来,经过不断发展,人们将腈类化合物与碳正离子反应生成N-烷基酰胺化合物的反应称作Ritter反应。
图 2 经典的Ritter反应及其通式
二、反应机理
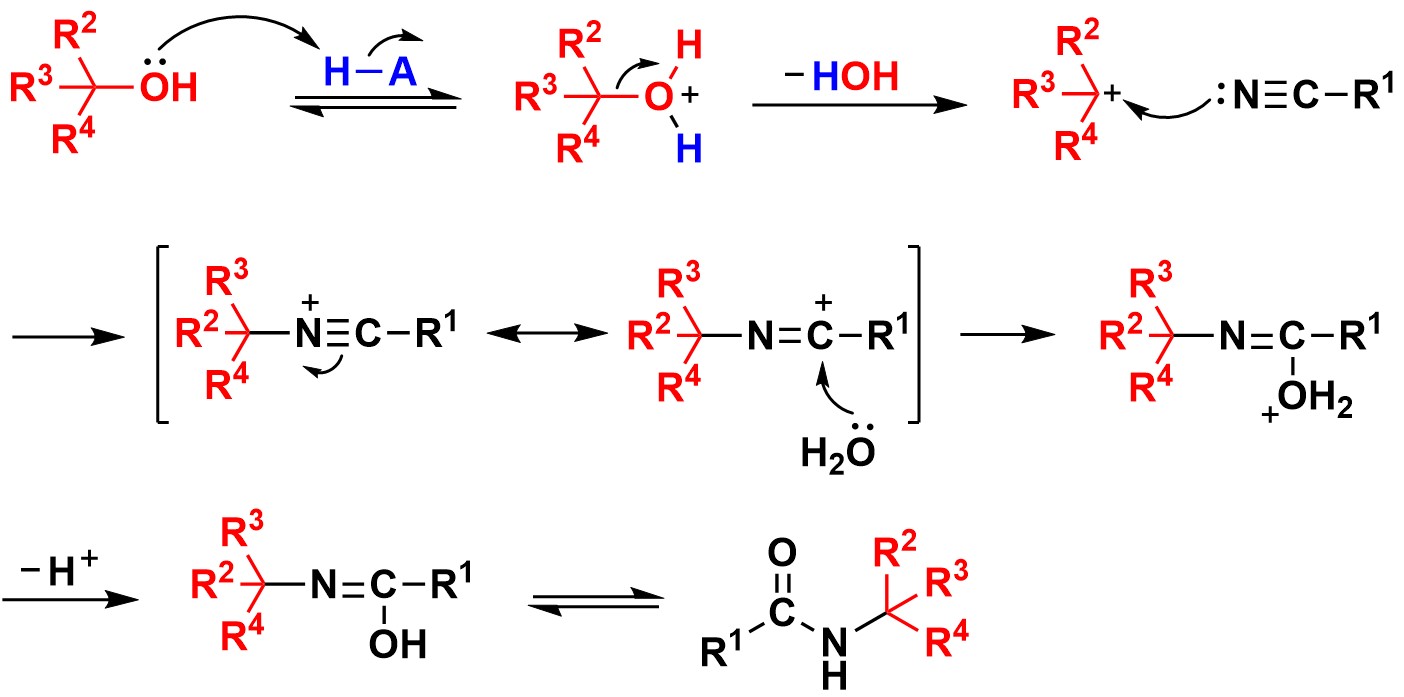
广义上,腈类化合物与碳正离子反应生成N-烷基酰胺的反应统称为Ritter type反应,实际上使用最多的碳正离子前体依然是烯烃和醇,常用的酸包括质子酸H2SO4、HClO4、RSO3H、PPA等和Lewis酸如AlCl3、BF3OEt2、SbCl5等。Ritter反应的机理并不复杂,与Beckmann重排反应具有相似性,现以底物醇为例对反应机理进行简要介绍。首先醇羟基被质子化后以水的形式离去得到碳正离子,腈类化合物的氰基亲核进攻碳正离子得到腈鎓离子(nitrilium ion),进一步共振将正电荷分布在电负性更小的碳原子上,反应体系中的水分子捕获碳正离子并互变异构得到稳定的酰胺产物。[2]
图 3 Ritter反应的机理
三、合成应用
(1)潜在多巴胺受体配体(potential dopamine receptor ligand)的合成[3]
2002年,F. Compernolle等人报道了潜在多巴胺受体配体的合成,其中关键中间体六元环内酰胺的构建正是通过分子内Ritter反应实现的。苄位叔醇在甲磺酸作用下形成较稳定的碳正离子并随即被分子内氰基“捕获”,最终以76%的可观产率得到环内酰胺产物。
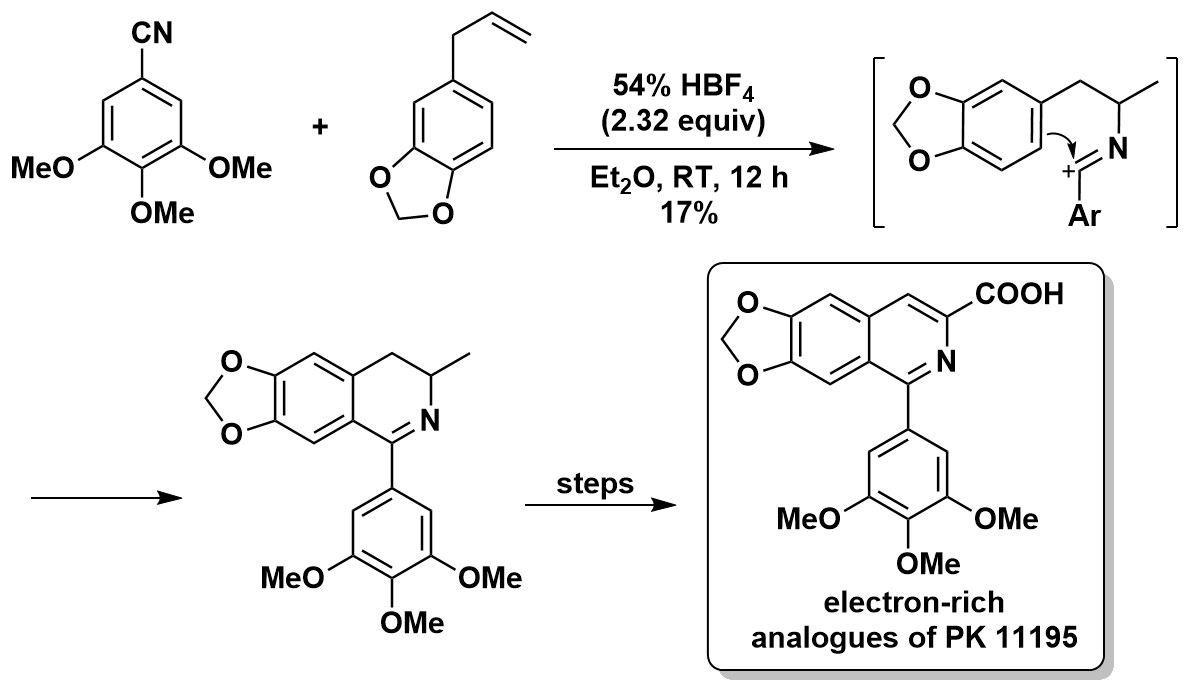
(2)富电子PK 11195类似物的合成(electron-rich analogues of PK 11195)[4]
2004年,Y. L. Janin等人在利用经典的强酸条件下的Ritter反应构建合成富电子PK 11195类似物关键中间体时发现反应物存在大量的分解,随即他们对反应条件进行了改变并发现HBF4是更合适的酸,尽管产率不甚满意。需要指出的是,在这个反应过程中并未引入H2O形成酰胺产物,实际上亚胺正离子会被富电子的苯环原位捕获。
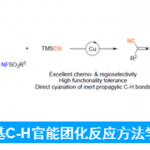
(3)催化循环的Ritter反应[5]
自从1948年Ritter反应被报道以来,它始终是高效合成酰胺的重要方法之一并且在复杂分子全合成领域发挥举足轻重的作用。然而,反应通常需要化学计量的酸是其弊端之一,也无疑限制了它对酸敏感底物的应用。为此,近些年围绕催化循环的Ritter反应相继得到报道。
参考文献
- [1] Ritter, J. J., Kalish, J. New reaction of nitriles. II. Synthesis of t-carbinamines. J. Am. Chem. Soc. 1948, 70, 4048-4050. DOI: 10.1021/ja01192a023
- [2] Kurti L, Czakó B. Strategic applications of named reactions in organic synthesis[M]. Elsevier, 2005. pp. 382-383. ISBN: 0-12-429785-4
- [3] Compernolle, F. Tetrahedron 2002, 58, 4225-4236. DOI: 10.1016/S0040-4020(02)00350-2
- [4] Janin, Y. L., et al. Tetrahedron 2004, 60, 5481-5485. DOI: 10.1016/j.tet.2004.05.004
- [5] Guérinot A, Reymond S, Cossy J. Ritter reaction: recent catalytic developments. Eur. J. Org. Chem. 2012, 19-28. DOI: 10.1002/ejoc.201101018
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.