概要
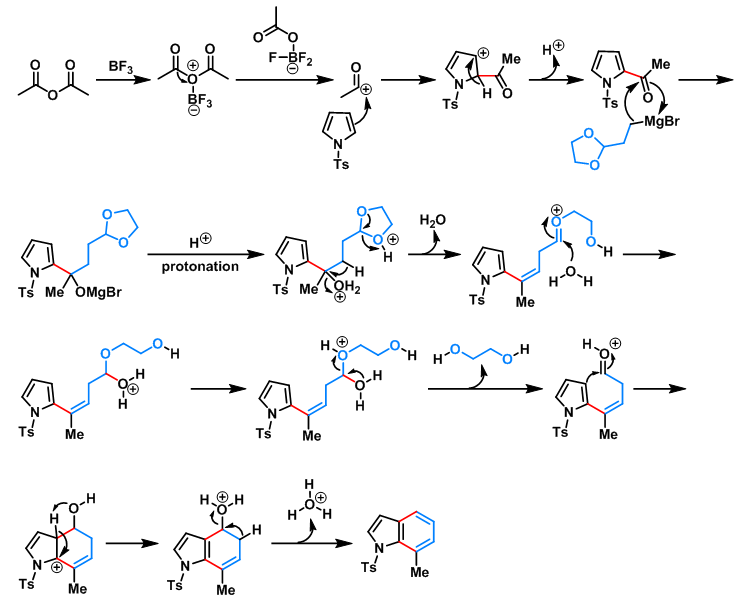
Natsume 吲哚合成(Natsume indole synthesis)是通过采用Lewis酸 (如AlCl3及 BF3·Et2O)参与的吡咯环的亲电取代反应,随后,经官能团化过程而进行的吲哚环的合成。该反应由日本Research Foundation Itsuu Laboratory的夏目充隆(Natsume Mitsutaka)研究室1990年首次报道。目前,该反应已经广泛应用于各类烷基取代吲哚类化合物的合成及吲哚类生物碱的全合成。
基本文献
[1] H. Muratake, M. Natsume, Heterocycles 1990, 31, 683. doi: 10.3987/COM-90-5333. [2] K. Okabe, H. Muratake; M. Natsume, Tetrahedron 1990, 46, 5113. doi: 10.1016/S0040-4020(01)87818-2.反应机理
反应实例
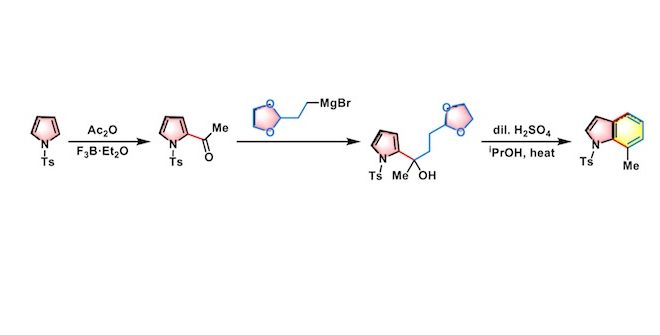
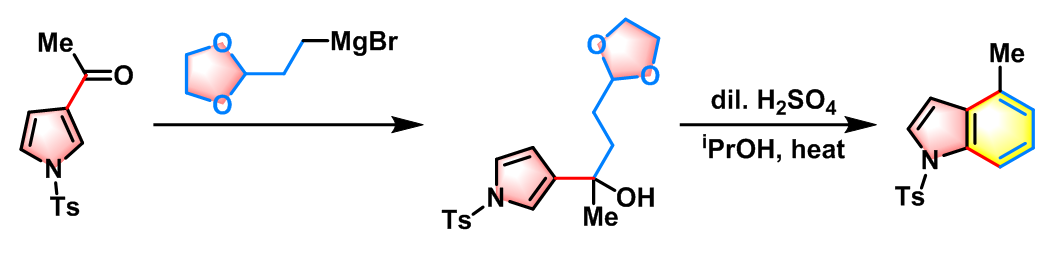
4-烷基吲哚的合成[1]
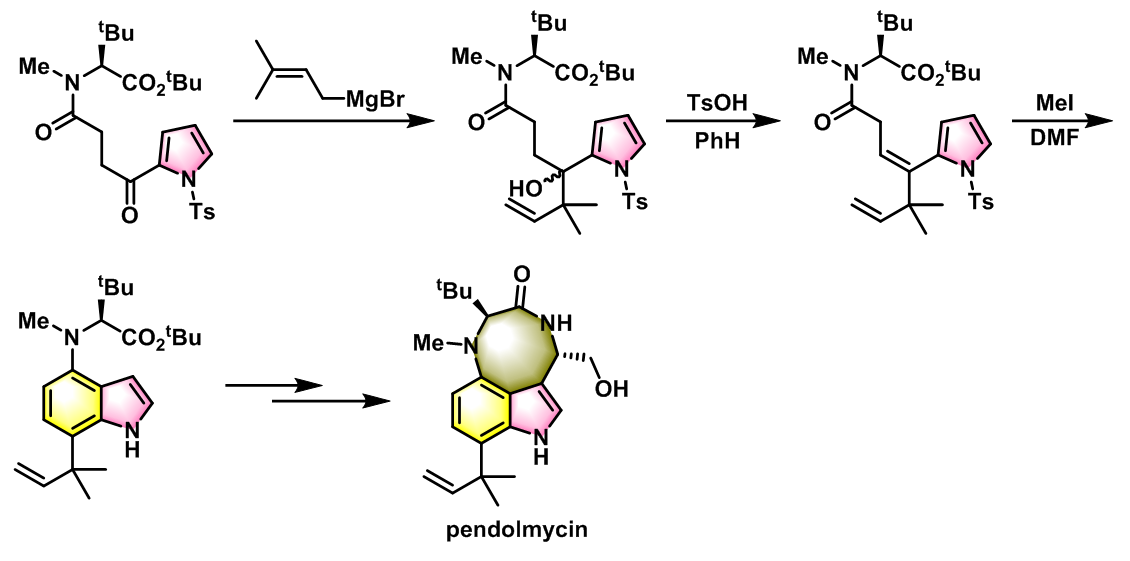
吲哚类生物碱pendolmycin的全合成[2]
实验步骤
- Friedel-Crafts酰基化[3] [4]
25oC下,将BF3•OEt2(2.2 eq.)加入到乙酸酐(1.1 eq.)的DCE溶液(底物浓度为0.36 M)中。将上述反应混合物搅拌10 min后,加入吡咯(1eq.)的DCE溶液(底物浓度为1M),将上述混合物在该温度下搅拌,直至反应结束。反应结束后,加入冷水淬灭反应,并用DCM进行萃取。将合并的有机相减压除去溶剂后获得粗产物。将粗产物采用硅胶柱色谱(乙酸乙酯/甲苯 1:4 v/v作为洗脱剂)进行分离纯化,获得相应乙酰基化产物。最后,在正己烷溶剂中进行重结晶获得纯净的酰基化产物。
- Grignard 反应
-20°C,氩气气氛下,将2-(1,3-二噁烷-2-基)乙基溴化镁(1eq.)的THF (浓度为溶液加入到酰基吡咯(1eq.)的THF (底物浓度为0.09 M)溶液中。将上述反应混合物搅拌15 min后,加入sat. NH4Cl/H2O淬灭反应,淬灭结束后,再加入DCM进行萃取。将合并的有机相采用无水硫酸钠进行干燥后,减压除去溶剂。粗产物采用Prep-TLC(正己烷/EtOAc 5:2 v/v作为展开剂)分离纯化获得相应成环前体。
- 吲哚成环反应
将第二步反应产生的成环前体(1eq.)的6% H2SO4-异丙醇溶液(底物浓度为0.03 M)加热回流30min。反应结束后,将反应液进行冷却后加水稀释,再加入DCM进行萃取。将合并的有机相采用无水硫酸钠进行干燥后,减压除去溶剂。粗产物采用Prep-TLC(正己烷/EtOAc 9:l v/v作为展开剂)分离纯化获得最终目标产物。
实验技巧
参考文献
- [1] H. Muratake, M. Natsume, Heterocycles 1990, 31, 683. doi: 10.3987/COM-90-5333.
- [2] K. Okabe, H. Muratake; M. Natsume, Tetrahedron 1990, 46, 5113. doi: 10.1016/S0040-4020(01)87818-2.
- [3] J. Rokach, P. Hamel, M. Kakushima, G. M. Smith, Tetrahedron Lett. 1981, 22, 4901. doi: 10.1016/S0040-4039(01)92377-9.
- [4] M. Kakushima, P. Hamel, R. Frenette, I. Rokach, J. Org. Chem. 1983,48, 3214. doi: 10.1021/jo00167a014.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.