作者:杉杉
导读:
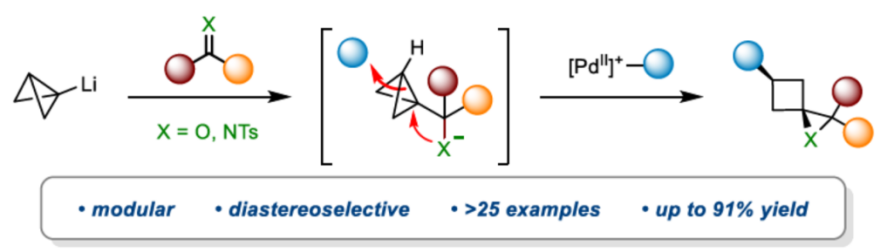
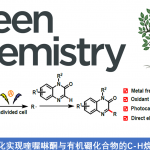
近日,英国Bristol大学的V. K. Aggarwal课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的通过张力释放驱动的采用BCB (bicyclo[1.1.0]butane)分子参与的环氧化与氮杂环丙烷化反应方法学,进而成功完成一系列螺环环氧化物与螺环氮杂环丙烷分子的构建。
Strain-Release Driven Epoxidation and Aziridination of Bicyclo[1.1.0]butanes via Palladium Catalyzed σ-Bond Nucleopalladation
B.Wölfl, N.Winter, J. Li, A. Noble, V. Aggarwal, Angew. Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202217064.
正文:
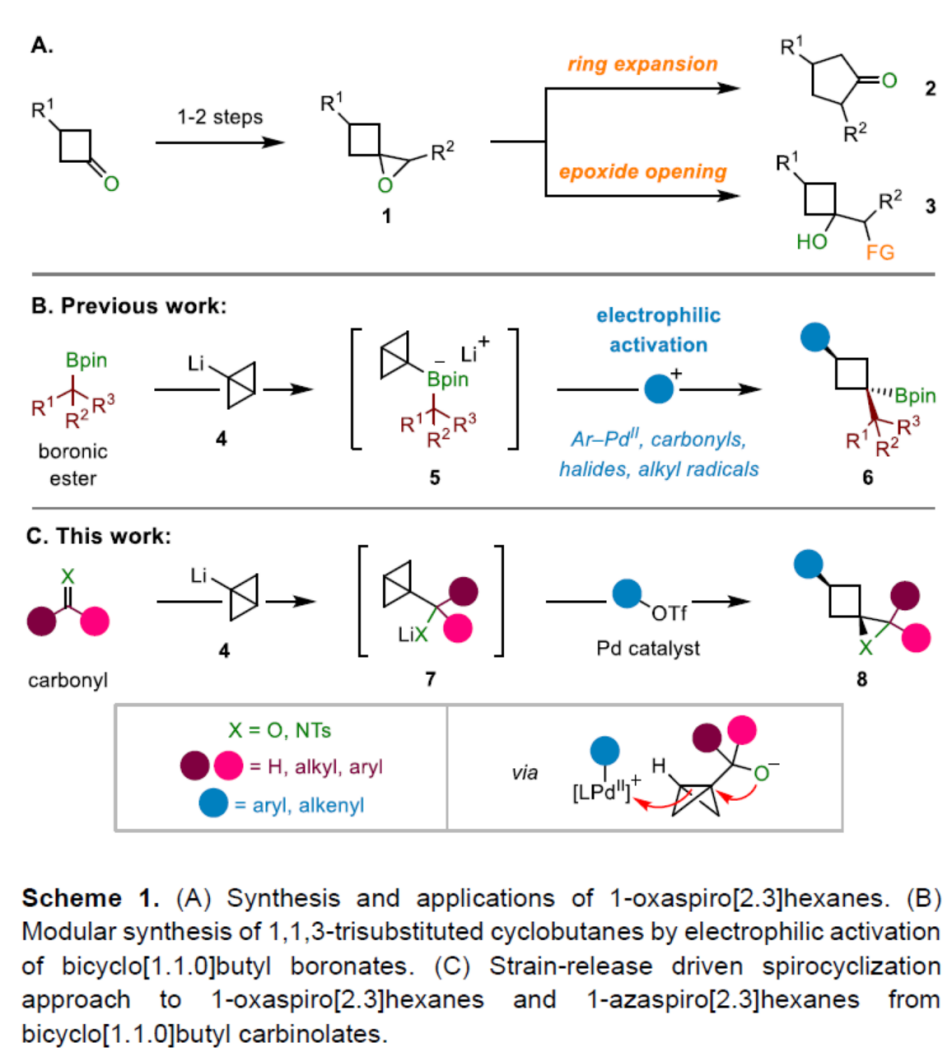
目前,通过螺环环氧化物参与的合成转化方法学研究,已经备受广泛关注 (Scheme 1A)[1]-[3]。这里,受到近年来对于通过环丁酮砌块构建1-氧杂螺[2.3]己烷分子[4]-[5]以及1,1,3-三取代环丁烷分子模块化合成 (modular synthesis)反应方法学[6]-[7] (Scheme 1B)相关研究报道的启发,英国Bristol大学的V. K. Aggarwal课题组成功设计出一种全新的通过张力释放驱动的采用BCB (bicyclo[1.1.0]butane)分子参与的环氧化与氮杂环丙烷化反应方法学 (Scheme 1C)。
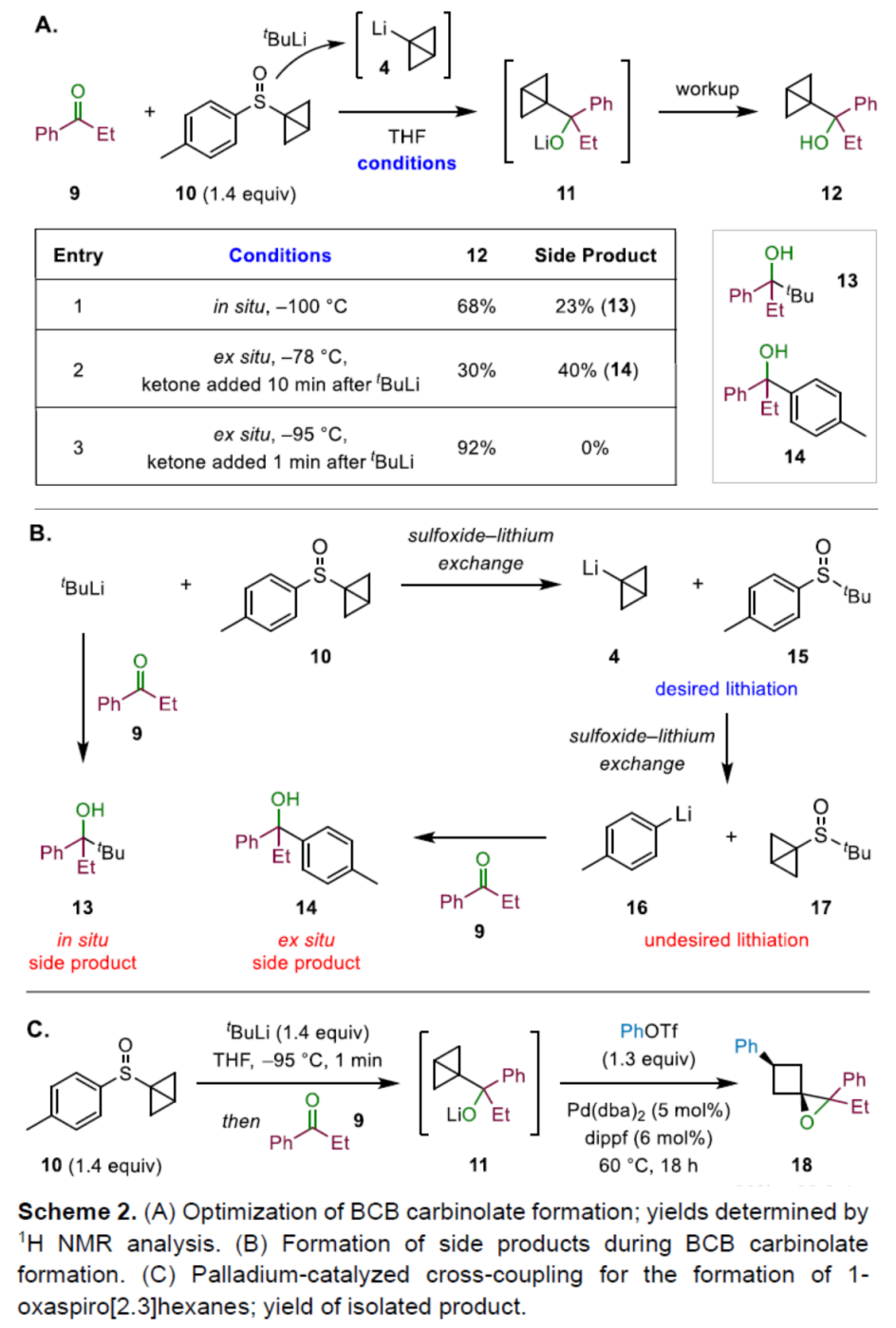
首先,作者采用苯丙酮9与亚砜衍生物10作为模型底物,进行相关反应条件的优化筛选 (Scheme 2)。进而确定最佳的反应条件为:在-95 oC (液氮-丙酮浴)条件下,将叔丁基锂的戊烷溶液滴加至BCB-亚砜衍生物10的THF溶液中,并剧烈搅拌1 min,之后再滴加苯丙酮9的THF溶液,接下来,再次向冷浴中加入干冰,并继续搅拌1 h。移开冷浴后,再加入Ph-OTf,之后加入含有Pd(dba)2与dippf的THF溶液,并升温至60 oC,反应18 h后,最终获得相应的1-氧杂螺[2.3]己烷衍生物18。
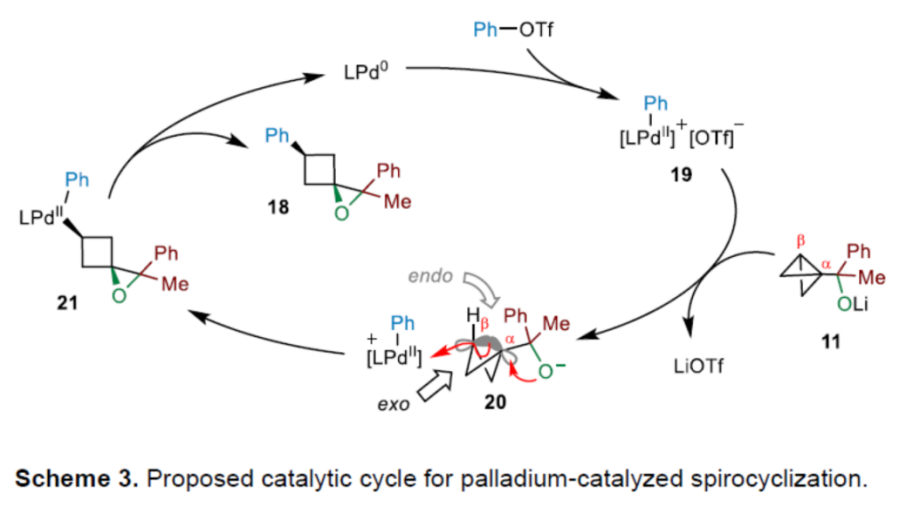
之后,基于前期相关的文献报道[8],作者提出如下合理的反应机理 (Scheme 3)。
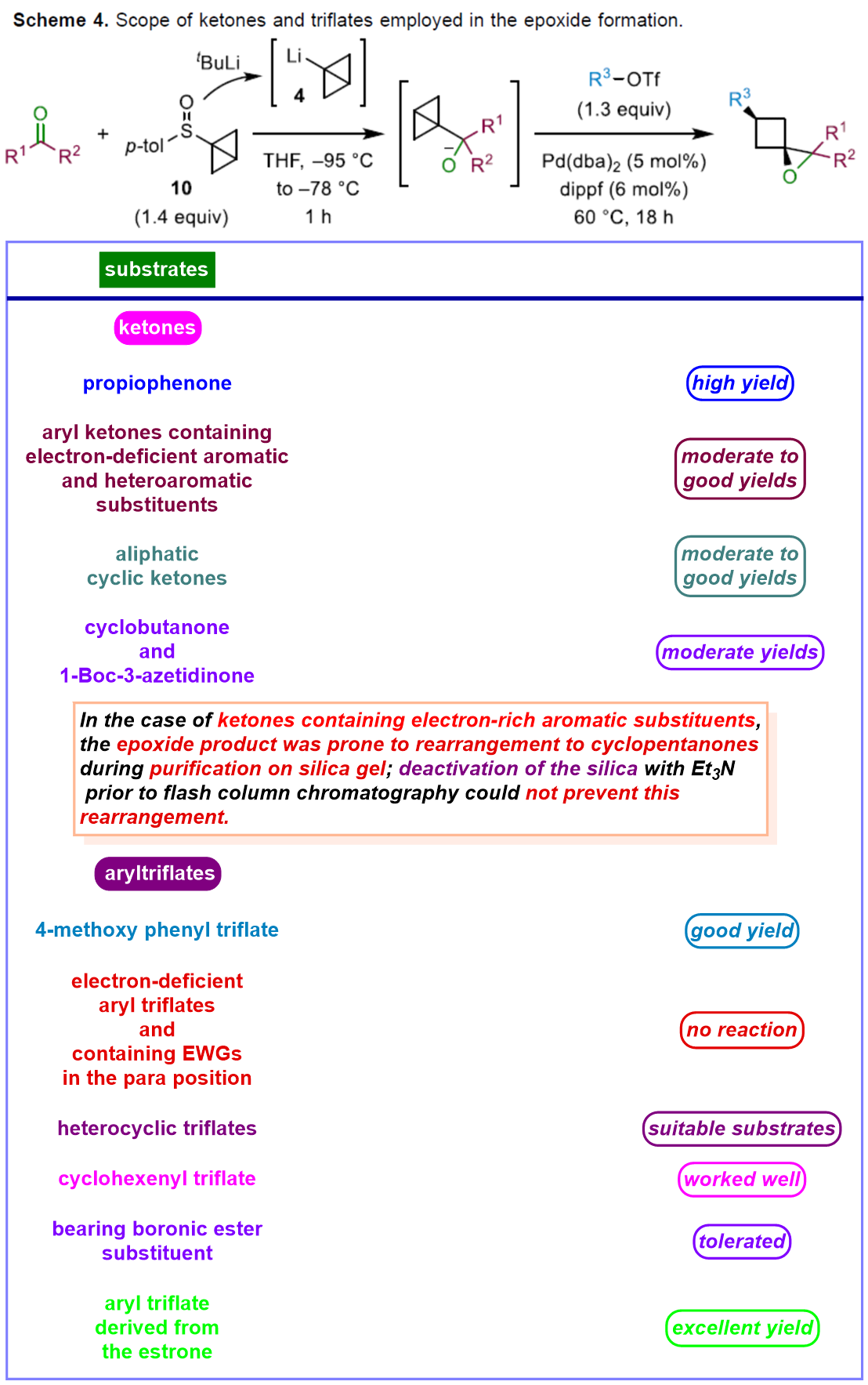
在上述的最佳反应条件下,作者分别对一系列酮底物以及三氟甲磺酸酯底物的应用范围进行深入研究 (Scheme 4)。
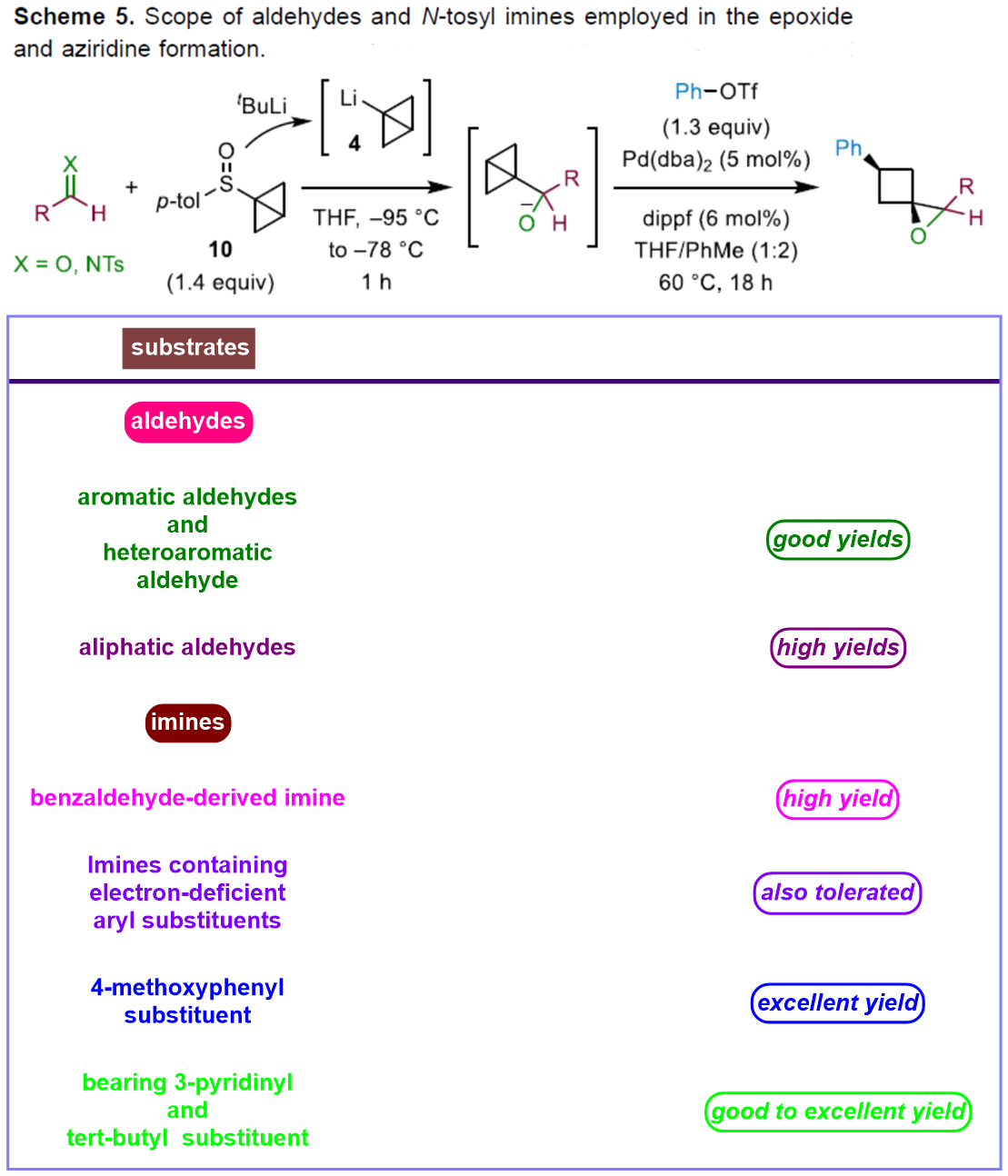
同时,作者对一系列醛与亚胺底物 (Scheme 5)的应用范围进行深入研究。
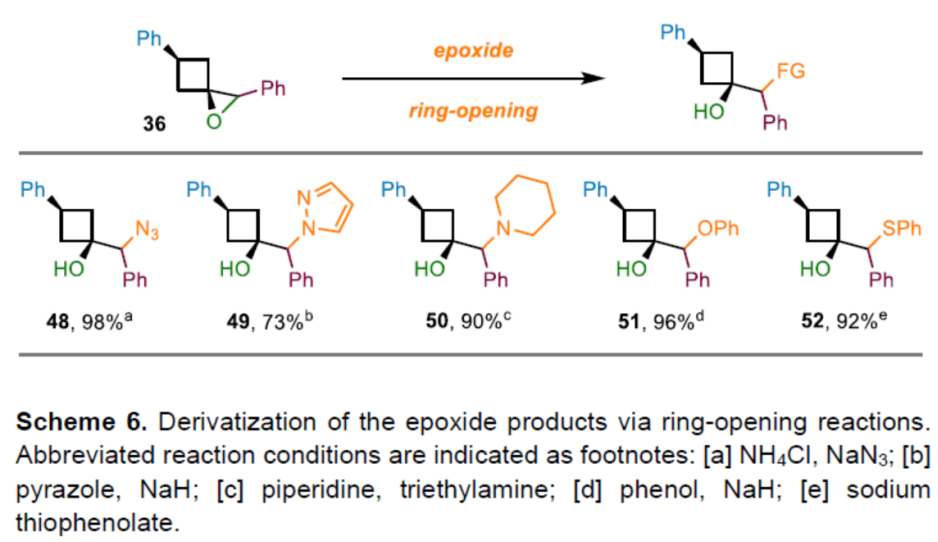
之后,该小组通过如下的一系列研究进一步表明,这一全新的环氧化与氮杂环丙烷化策略具有潜在的合成应用价值 (Scheme 6)。
总结:
英国Bristol大学的V. K. Aggarwal团队成功设计出一种全新的通过张力释放驱动的采用BCB (bicyclo[1.1.0]butane)分子参与的环氧化与氮杂环丙烷化反应方法学,进而成功完成一系列螺环环氧化物与螺环氮杂环丙烷分子的构建。这一全新的环氧化与氮杂环丙烷化具有广泛的底物应用范围以及良好的合成应用价值等优势。
参考文献:
- [1] E. Leemans, M. D′hooghe, N. De Kimpe, Chem. Rev. 2011, 111, 3268. doi: 10.1021/cr100295j.
- [2] Z. Li, V. Gevorgyan, Angew. Chem. Int. Ed. 2012, 51, 1225. doi: 10.1002/anie.201106969.
- [3] S. Ahmad, W. N. Washburn, A. S. Hernandez, S. Bisaha, K. Ngu, W. Wang, M. A. Pelleymounter, D. Longhi, N. Flynn, A. V. Azzara, K. Rohrbach, J. Devenny, S. Rooney, M. Thomas, S. Glick, H. Godonis, S. Harvey, H. Zhang, B. Gemzik, E. B. Janovitz, C. Huang, L. Zhang, J. A. Robl, B. J. Murphy, J. Med. Chem. 2016, 59, 8848. doi: 10.1021/acs.jmedchem.6b00676.
- [4] A. Cocco, M. G. Rubanu, M. L. Sechi, A. Frongia, P. Mastrorilli, L. Degennaro, M. Colella, R. Luisi, F. Secci, Org. Biomol. Chem. 2021, 19, 1945. doi: 10.1039/D0OB00771D.
- [5] Y. Liu, H. Li, S. Chiba, Org. Lett. 2021, 23, 427. doi: 10.1021/acs.orglett.0c03935.
- [6] L. Lewis-Borrell, M. Sneha, I. P. Clark, V. Fasano, A. Noble, V. K. Aggarwal, A. J. Orr-Ewing, J. Am. Chem. Soc. 2021, 143, 17191. doi: 10.1021/jacs.1c07964.
- [7] A. Fawcett, A. Murtaza, C. H. U. Gregson, V. K. Aggarwal, J. Am. Chem. Soc. 2019, 141, 4573. doi: 10.1021/jacs.9b01513.
- [8] S. H. Bennett, A. Fawcett, E. H. Denton, T. Biberger, V. Fasano, N. Winter, V. K. Aggarwal, J. Am. Chem. Soc. 2020, 142, 16766. doi: 10.1021/jacs.0c07357.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.